Уродинамические и метаболические эффекты реконструкции мочевого пузыря подвздошно-кишечным J-резервуаром
Автор: Костюк И.П., Крестьянинов С.С., Васильев Л.А., Карандашов В.К.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.8, 2013 года.
Бесплатный доступ
Проведен анализ хирургического лечения 68 пациентов, которым была выполнена континентная деривация мочи путем формирования ортотопического мочевого резервуара. Объем перенесенных вмешательств включал - цистэктомию n = 46 (67,6%), полную надлеваторную эвисцерацию малого таза - 14 (20,6%) и ее переднюю модификацию - 8 (11,8%). Показанием к хирургическому лечению были рак мочевого пузыря - 48 (70,6%), колоректальный рак - 11 (16,2%), рак шейки - 4 (5,9%), рак тела матки - 2 (2,9%) и рак яичников - 3 (4,4%). В 13 (19,1%) случаях при формировании мочевого резервуара применили методику Hautmann, в 27 (39,7%) - методику Studer. У 28 (41,2%) пациентов сформировали подвздошно-кишечный J-резервуар. Исследованы уродинамические характеристики резервуаров и вызываемые ими метаболические изменения. Показано, что J-резервуар сопоставим с классическими технологиями Studer и Hautmann по уродинамическим показателям и приводит к меньшим метаболическим изменений в послеоперационном периоде. Данный метод позволяет избегать развития натяжения в зоне анастомоза между уретрой и мочевым резервуаром даже при недостаточной длине брыжейки тонкой кишки.
Цистэктомия, эвисцерация малого таза, реконструкция мочевого пузыря, ортотопическая цистопластика, континентная деривация мочи, рак мочевого пузыря, рак шейки матки, колоректальный рак, j-резервуар, метаболические расстройства
Короткий адрес: https://sciup.org/140188188
IDR: 140188188 | УДК: 616.62-089.844.168
Текст научной статьи Уродинамические и метаболические эффекты реконструкции мочевого пузыря подвздошно-кишечным J-резервуаром
Хирургические вмешательства, сопровождавшиеся удалением мочевого пузыря (МП), ранее рассматривались как тяжелые инвалидизирующие операции, сопряженные с высокими показателями летальности, тяжелыми послеоперационными осложнениями и последующим неблагоприятным прогнозом в отношении качества и продолжительности жизни больных. Это во многом было обусловлено как несовершенством техники выполнения данных вмешательств, так и методов деривации мочи. Современные технологии выполнения обширных вмешательств на органах малого таза (МТ), сопровождающихся цистэктомией (ЦЭ) и методики реконструкции МП принципиально изменили отношение к данным вмешательствам и способствовали их популяризации. Ортотопическое замещение МП стало стандартной формой его реконструкции не только после изолированных ЦЭ, выполненных по поводу рака мочевого пузыря (РМП), но и после эвисцераций малого таза (ЭМТ), выполненных в связи с местным распространением опухолей других органов. Обоснованием к выбору ортотопической цисто-пластики является отработанная хирургическая техника, низкий риск развития осложнений и удовлетворительные отдаленные функциональные результаты. Цель создания ортотопических мочевых резервуаров – максимальная медицинская и социальная реабилитация больных, которым выполнена ЦЭ. Это достигается формированием необладдера с достаточной емкостью, низким внутри- просветным давлением и адеватной защитой верхних мочевых путей (ВМП).
Для ортотопической реконструкции МП используют различные отделы желудочно-кишечного тракта: сегменты подвздошной кишки, восходящий, поперечный, нисходящий и сигмовидный отделы ободочной кишки, иногда стенку желудка. Наиболее распространенными методиками ортотопической цистопластики последних десятилетий являются техники Camey, Hemi Kock, Hau-tmann и Studer.
M. Camey в 1958 г. сформулировал концепцию использования сохраненного сфинктера мочеиспускательного канала для регуляции удержания мочи после ЦЭ. Описанная позже техника ортотопическая илеоци-стопластика – операция Camey I (1979) стала стимулом в бурному развитию технологий ортотопической подвздошно-кишечной пластики МП [6]. Относительно простая операция Camey I в настоящее время представляет главным образом исторический интерес. Важной последующей модификацией в операции Camey II (1990) была детубуляризация и реконструкция кишечного сегмента. Это привело к снижению перистальтической сократимости стенок резервуара и уменьшению давления в его просвете, что значимо улучшило функциональные результаты операции [7].
При реализации ортотопической илеоцистопласти-ки по Hautmann, создается более сферический, чем при операции Camey II, резервуар путем W-образной техники

его формирования. Это позволило добиться большей емкости резервуара [3].
Многие ранее известные способы континентной гетеротопической интестинопластики (Kock pouch, Mainz pouch I, Le Bag и др.) были адаптированы к ортотопической реконструкции. Так, континентная гетеротопическая мочевая деривация, предложенная N.G. Kock, была адаптирована автором и позднее усовершенствована M.A. Ghoneim как ортотопическая методика, получившая название «илеоцистопластика Hemi Kock» (1987) [5, 9].
В 1988 г. U.E. Studer [10] предложил ортотопическое замещение МП тонкокишечным резервуаром низкого давления, который является усовершенствованным вариантом ортотопической цистопластики Hemi Kock [10]. Отличие данного метода состоит в том, что в приводящем тубулярном сегменте не формируется клапан. Сохраненный приводящий сегмент подвздошной кишки длиной 20 см предотвращает возникновение рефлюкса в ВМП. Первый отчет был опубликован автором в 1995 г. Функциональные результаты описанных методик ортотопической илеоцистопластики варьируют и обладают как преимуществами, так и недостатками.
В настоящее время стало возможным выбрать именно тот метод мочевой деривации, который позволит выполнить операцию с наименьшим риском развития осложнений и обеспечит наилучшее качество жизни пациента после операции с учетом конкретных условий [4]. В течение последних десятилетий предпочтение отдают методикам Studer и Hautmann. Это обусловлено хорошей воспроизводимостью хирургической техники и низкой частотой развития осложнений. Тем не менее, и данные технологии не лишены недостатков. Они связаны с изначальной большой реабсорбционной площадью кишечной слизистой сформированных резервуаров, а также нередко возникающим натяжением тканей, при формировании резервуаро-уретрального анастомоза, вследствие короткой брыжейки тонкой кишки. Для разрешения указанных недостатков и предпринято настоящее исследование.
Цель исследования
Оценить характеристики подвздошно-кишечного J-резервуара при его использовании в качестве ортотопического мочевого резервуара и сравнить их с распространенными методиками Studer и Hautmann.
Материалы и методы
Проведен анализ хирургического лечения 68 пациентов, которым с января 2007 г. по июнь 2011 г. была выполнена континентная деривация мочи путем формирования ортотопического мочевого резервуара. Объем перенесенных вмешательств включал: – цистэктомию – n = 46 (67,6%), полную надлеваторную эвисцерацию малого таза – 14 (20,6%) и ее переднюю модификацию – 8 (11,8%). Показанием к хирургическому лечению были рак мочевого пузыря – 48 (70,6%), колоректальный рак – 11 (16,2%), рак шейки – 4 (5,9%) и тела матки 2 (2,9%), а также рак яичников
– 3 (4,4%) (табл. 1). Мужчин было 54 (79,4%), женщин 14 (20,6%) . Возраст пациентов колебался от 38 до 67 лет. В 13 (19,1%) случаях при формировании мочевого резервуара применили методику Hauthman, в 27 (39,7%) – методику Shtuder (табл. 2). У 28 (41,2%) пациентов сформировали подвздошно-кишечный J-резервуар. Этапы формирования J-резервуара представлены на рисунках 1–4.
Комплексное уродинамическое обследование подвздошных резервуаров, выполнялось через 3, 6, 12 и более месяцев после операции. Интерпретация результатов проводилась в соответствии с терминологией и стандартами Международного общества по удержанию мочи (International Continence Society – ICS). Функция удержания мочи и ее нарушения оценивались на основании опроса больных по классификации McGuire [8].
Табл. 1. Локализация первичной опухоли и объем выполненного хирургического вмешательства
|
Локализация опухоли |
Цистпростат-эктомия |
Полная ЭМТ |
Передняя ЭМТ |
Всего |
|
Мочевой пузырь |
46 |
– |
2 |
48 (70,6%) |
|
Толстая кишка |
– |
11 |
– |
11 (16,2%) |
|
Шейка матки |
– |
3 |
1 |
4 (5,9%) |
|
Тело матки |
– |
– |
2 |
2 (2,9%) |
|
Яичники |
– |
– |
3 |
3 (4,4%) |
|
Всего |
46 (67,6%) |
14 (20,6%) |
8 (11,8%) |
68 |
Табл. 2. Методики деривации мочи при различном объеме резекционного этапа хирургического вмешательства
|
Методика деривации |
Цистпростат-эктомия |
Полная ЭМТ |
Передняя ЭМТ |
Всего |
|
По Хаутману |
13 |
– |
– |
13 (19,1%) |
|
По Штудеру |
24 |
– |
3 |
27 (39,7%) |
|
J-резервуар |
9 |
14 |
5 |
28 (41,2%) |
|
Всего |
46 (67,6%) |
14 (20,6%) |
8 (11,8%) |
68 |
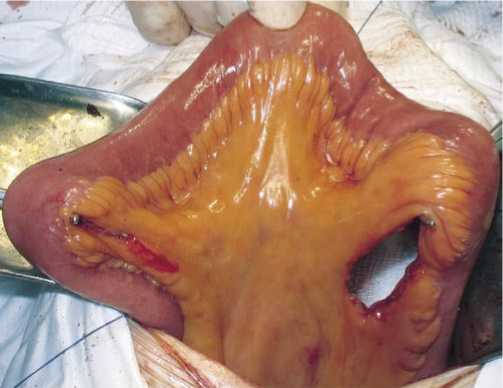
Рис. 1. Выделение сегмента подвздошной кишки для формирования мочевого резервуара
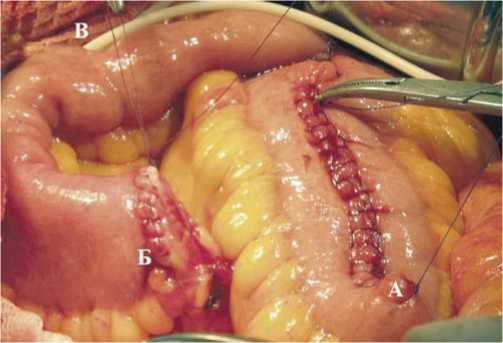
Рис. 4. Сформированный подвздошно-кишечный J-резервуар (А), подготовленный для ортотопической заместительной пластики мочевого пузыря. Б – мочеточнико-резервуарный анастомоз. В – мочеточниковые интубаторы, введенные в резервуар через его недетубулизированную часть

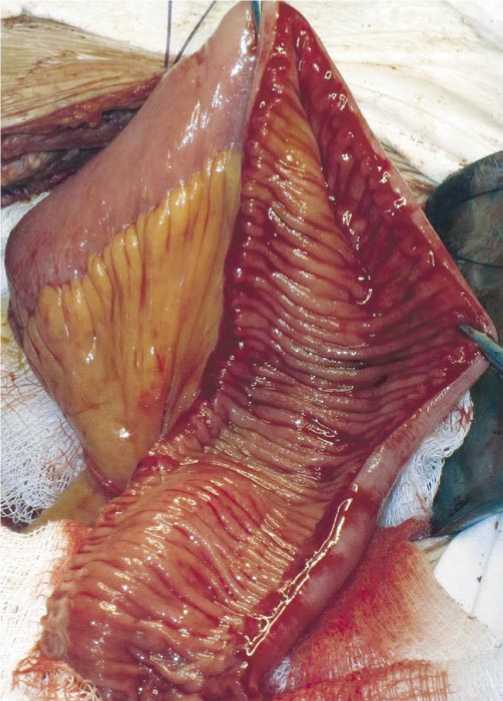
Рис. 2. Детубуляризация 2/3 сегмент подвздошной кишки, мобилизованного для формирования мочевого J-резервуара
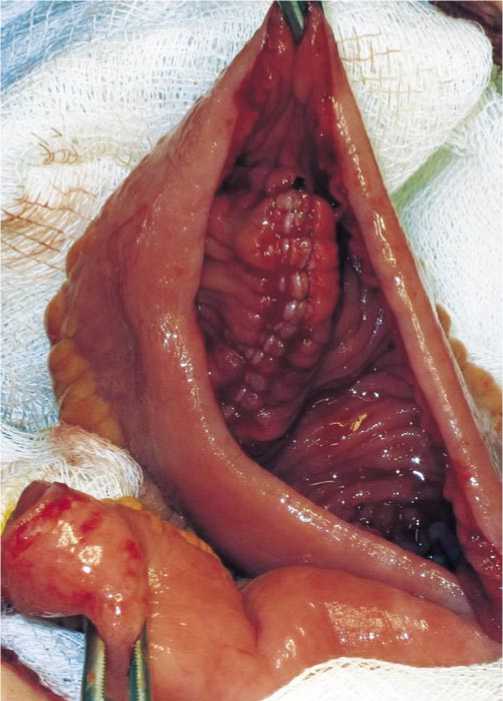
Рис. 3. Создание полости подвздошнокишечного J-резервуара
Результаты и их обсуждение
Важным критерием успеха ортотопической цисто-пластики является степень удержания мочи, от которой зависит социально-психологическая адаптация пациен- тов а, следовательно, и качество их жизни [1]. Динамика континенции мочи и качества жизни представлена в таблице 3, из которой видно, что через 1 год после операции недержание мочи 1 и 2 степени оставалось у 3-х пациенток, которое было у них и до операции. У 2 больных ургентное недержание мочи при сильном позыве субъективно воспринималось как выраженное ощущение дискомфорта в области МП, наблюдалось. Таким образом, недержание мочи наблюдалось у 5 (7,3%)больных, показатель дневной континенции составил 94,1%. Безупречную ночную континенцию отмечали 32 (47,1%) больных. Хорошее или удовлетворительное качество жизни отмечали 65 (95,6%) больных.
Табл. 3. Показатели континенции и качества жизни больных в различные сроки после операции, абс (%)
|
Сроки после операции Показатели кнтиненции |
3 мес., n = 68 |
6 мес., n = 68 |
12 мес., n = 68 |
≥ 24 мес., n = 57 |
|
Дневная континенция |
56 (82,4) |
60 (88,2) |
64 (94,1) |
55 (96,5) |
|
Ночная континенция |
9 (13,2) |
20 (29,4) |
32 (47,1) |
36 (63,2) |
|
Стрессовое недержание мочи |
3 (4,4) |
3 (4,4) |
3 (4,4) |
2 (3,5) |
|
Ургентное недержание мочи |
9 (13,2) |
5 (7,3) |
2 (2,9) |
– |
|
Хорошее и удовлетворительное качество жизни |
57 (83,8) |
62 (91,2) |
65 (95,6) |
55 (96,5) |

Таким образом, при исследовании функции удержания мочи к концу первого года после ортотопической илеоцистопластики (ИЦП) наблюдалось постепенное улучшение показателей дневной и ночной континенции, а также качества жизни, которые спустя 2 года уже существенно не изменялись. Стрессовое недержание мочи, выявленное у 3 пациенток до операции, сохранялось на протяжении всего срока наблюдения.
При анализе частоты дневного и ночного недержания мочи в течение 1-го года после ортотопической ИЦП наблюдалось статистически достоверное снижение этих показателей, которые спустя 2 года оставались на том же уровне. На рисунке 2 показана динамика частоты недержания мочи в различные сроки после операции.
Для определения лучшего метода ортотопической деривации мочи была проведена оценка степени удержания мочи в зависимости от способа ИЦП. Результаты представлены в таблице 4. Было установлено, что во все сроки после операции показатели дневной и ночной кон-тиненции при различных способах ИЦП статистически не отличались друг от друга.
Установлено, что через 3 месяца после операции происходит статистически достоверное (р < 0,05) снижение показателей максимального уретрального давления закрытия и функциональной длины уретры у мужчин и женщин с нормальной функцией удержания. Эти показатели у 54 мужчин снижались, с 72,4 до 60,4 см вод. ст. и с 120,3 до 92,1 мм, а у 14 женщин с 66,4 до 48,2 см вод. ст. и с 32,6 до 22,8 мм, соответственно. Их значения оставались без существенной динамики в течение 12 месяцев наблюдения независимо от пола и метода цистопластики. Через год максимальное уретральное давление закрытия и функциональная длина уретры у мужчин составляли 62,2 см вод. ст. и 92,5 мм, а у женщин – 52,3 см вод. ст. и 24,6 мм, соответственно.
Результаты цистометрического и уродинамического исследований представлены в таблице 5. При оценке накопительной функции наиболее важными показателями были объем «первого позыва» и максимальная емкость неоцистиса. Первый позыв расценивался как объем жидкости, приводящий к появлению первого ощущения заполнения резервуара, а максимальная емкость соответствовала объему, при котором пациент начинал испытывать болевой дискомфорт внизу живота, и/или появлялось подтекание мочи или дискомфорт в поясничной области в результате резервуарно-мочеточникового рефлюкса.
Максимальные объемные характеристики в группе больных после ИЦП по методу Hautmann были следующими: объем первого позыва и максимальная емкость резервуара увеличились в течение года более чем в 2 раза, с 330,4 ± 25,7 мл и 396,4 ± 37,6 мл после первых 3-х месяцев до 718,3 ± 132,4 мл и 776,2 ± 182,4 мл спустя год после операции.
При ИЦП по Studer рос рост объема первого позыва и максимальная емкость резервуара были меньшими
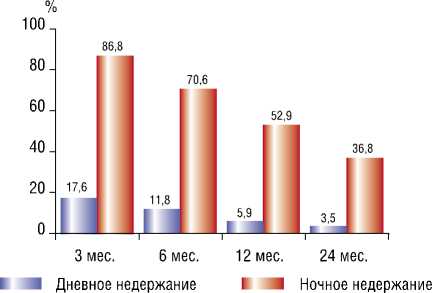
Рис. 5. Частота недержания мочи в различные сроки после ортотопической илеоцистопластики, %
Табл. 4. Показатели удержания мочи у пациентов с различными вариантами ортотопической ИЦП в различные сроки после операции
Показатели внутрирезервуарного давления при первом позыве, максимальной емкости и максимальном сокращении неоцистиса были статистически достоверно ниже в группе больных с резервуаром по методу Ha-utmann. Эти показатели снижались, соответственно, с 20,8 ± 4,2, 35,2 ± 4,3 и 51,8 ± 6,2 см вод. ст. через 3 месяца после операции до 15,5 ± 2,7, 21,2 ± 5,3 и 33,3 ± 8,4 см вод. ст. к концу первого года после операции. Статистически достоверных различий между показателями давления в группах J-образной цистопластики и по методу Studer не было. При формировании мочевого J-резервуара показатели внутрирезервуарного давления при первом позыве, максимальной емкости и максимальном сокращении резервуара через 3 месяца были 23,3 ± 3,3, 38,6 ± 9,6 и 54,6 ± 12,6 см вод. ст., а через 12 снизились до 21,8 ± 5,2, 32,4 ± 3,1 и 44,3 ± 2,2 см вод. ст. соответственно. При использовании метода Studer данные показатели в указанные сроки снижались с 25,3 ± 3,7, 35,6 ± 5,7 и 56,8 ± 14,3 см вод. ст. до 21,1 ± 4,5, 32,2 ± 4,2 и 41,6 ± 2,4 см вод. ст. соответственно.

У всех пациентов отмечалась тенденция к постепенному увеличению интервалов между перистальтическими сокращениями (средний объем жидкости, вызывающий каждое последующее сокращение). Значение этого показателя было достоверно выше у пациентов с резервуаром Hautmann и через год после операции составила 158 ± 50,2 мл.
Уникальная способность детрузора поддерживать в просвете МП низкое давление, несмотря на увеличение количества поступающей мочи получило название адаптационной способности или комплайнс (от англ. сompliance – податливость). В русской литературе этот термин чаще формулируется как растяжимость или эластичность. Снижение растяжимости приводит к повышению внутрирезервуарного давления и отрицательно сказывается на состоянии уродинамики ВМП.
Растяжимость кишечного резервуара с течением времени повышалась у всех больных, но наибольшая и статистически значимая была у больных после ИЦП по методу Hautmann – 32,7 ± 8,5 мл/см вод. ст. через 3 месяца после операции и 65,5 ± 9,2 мл/см водн. ст. спустя 12 месяцев после операции. Статистически значимых различий между значениями последних двух показателей у больных после формирования J-резервуара (26,2 ± 5,1 мл/см вод. ст. и 44,3 ± 7,1 мл/см вод. ст.) и цистопластики по методу Studer (24,8 ± 5,2 мл/см водн. ст. и 43,2 ± 8,1 мл/см водн. ст. не отмечено.
Оценка метаболических эффектов ортотопической цистопластики различными методами проведена путем исследования кислотно-основного состояния капиллярной крови, а также калия, натрия и хлора венозной крови производили через 1 месяц после операции, затем каждые три месяца в течение 1 года и каждые 6 месяцев в течение 2 года после операции. У пациентов с J-образным резервуаром через 3 месяца после операции оказались ниже нормы только средние значения дефицита оснований (таблицы 6 и 7). В остальные сроки дефицит оснований был в норме. Средние значения pH крови, парциального давления углекислого газа, калия, натрия и хлора во все сроки наблюдения у больных с подвздошно-кишечным
Табл. 5. Основные показатели цистометрии и опорожнения мочевых резервуаров при различных вариантах илеоцистопластики через 3 и 12 месяцев после операции
|
Показатель |
Методика |
|||||
|
по Хаутману, n = 13 |
по Штудеру, n = 27 |
J–резервуар, n = 28 |
||||
|
3 мес. |
12 мес. |
3 мес. |
12 мес. |
3 мес. |
12 мес. |
|
|
Объем первого позыва (мл) |
292–374* (330,4 ± 25,7) |
588–1096* (718,3 ± 132,4) |
246–346 (292,7 ± 32,2) |
478–574 (533,2 ± 28,2) |
194–259 (227,2 ± 30,3) |
502–566 (534,7 ± 29,3) |
|
Максимальная емкость (мл) |
345–482* (396,4 ± 37,6) |
653–1240* (776,2 ± 182,4) |
318–421 (374,2 ± 35,2) |
516–631 (588,4 ± 25,2) |
252–308 (284,5 ± 31,8) |
548–612 (582,3 ± 28,5) |
|
Давление (Pdet) при первом позыве (см вод. ст.) |
16–25* (20,8 ± 4,2) |
12–19* (15,5 ± 2,7) |
21–32 (25,3 ± 3,7) |
17–25 (21,1 ± 4,5) |
19–28 (23,3 ± 3,3) |
16–28 (21,8 ± 5,2) |
|
Давление (Pdet) при макси–мальной емкости (см вод. ст.) |
30–46* (35,2 ± 4,3) |
16–25* (21,2 ± 5,3) |
29–51 (35,6 ± 5,7) |
29–35 (32,2 ± 4,2) |
27–58 (38,6 ± 9,6) |
25–33 (32,4 ± 3,1) |
|
Давление при максимальном сокращении (см вод. ст.) |
44–60* (51,8 ± 6,2) |
21–43* (33,3 ± 8,4) |
44–81 (56,8 ± 14,3) |
37–49 (41,6 ± 2,4) |
44–76 (54,6 ± 12,6) |
41–49 (44,3 ± 2,2) |
|
Интервалы между сокращениями (мл) |
68–102* (92,0 ± 8,2) |
119–234* (158 ± 50,2) |
64–93 (78,8 ± 11,2) |
89–117 (106,4 ± 7,7) |
74–94 (84,6 ± 5,3) |
91–114 (106,1 ± 7,2) |
|
Комплаентность (мл/см вод. ст.) |
22,2–48,6* (32,7 ± 8,5) |
51,2–76,3* (65,5 ± 9,2) |
15,4–35,8 (24,8 ± 5,2) |
32,9–54 (43,2 ± 8,1) |
19,0–32,9 (26,2 ± 5,1) |
33,4–58,2 (44,3 ± 7,1) |
|
Максимальная скорость мочеиспускания (мл/сек) |
12,6–25,2* (21,2 ± 4,3) |
9,2–15,8* (13,1 ± 2,6) |
17,6–24,6 (23,4 ± 2,2) |
12,7–21,9 (16,5 ± 3,4) |
14,3–26,3 (20,8 ± 2,2) |
9,4–18,6 (13,8 ± 2,4) |
|
Количество остаточной мочи (мл) |
38–85* (50,6 ± 12,86) |
82–316* (150,2 ± 44,5) |
17–49 (27,7 ± 9,7) |
44–165 (67,5 ± 16,2) |
25–65 (34,5 ± 7,2) |
60–218 (114,2 ± 27,1) |
Примечание : * – р < 0,05.
Табл. 6. Показатели кислотно-основного состояния у пациентов с различными методами ортотопической илеоцистопластики
|
Месяц |
по Хаутману, n = 13 |
по Штудеру, n = 27 |
J-резервуар, n = 28 |
||||||
|
pH |
дефицит оснований |
pC02, мм.рт.ст. |
pH |
дефицит оснований |
pC02, мм.рт.ст. |
pH |
дефицит оснований |
pC02, мм.рт.ст. |
|
|
1 мес. |
7,30 ± 0,05 |
-7,54 ± 4,14 |
34,21 ± 3,15 |
7,31 ± 0,06 |
-7,47 ± 5,24 |
34,48 ± 3,35 |
7,34 ± 0,05 |
-3,97 ± 3,42 |
37,68 ± 4,38 |
|
3 мес. |
7,31 ± 0,03 |
-8,04 ± 2,28 |
35,17 ± 3,27 |
7,30 ± 0,04 |
-8,34 ± 2,68 |
35,67 ± 3,79 |
7,36 ± 0,06 |
-2,72 ± 4,48 |
37,02 ± 3,91 |
|
6 мес. |
7,32 ± 0,06 |
-5,07 ± 4,24 |
37,38 ± 2,41 |
7,32 ± 0,08 |
-5,70 ± 4,84 |
37,80 ± 2,01 |
7,38 ± 0,07 |
-1,97 ± 3,84 |
38,88 ± 3,51 |
|
12 мес. |
7,35 ± 0,08 |
-2,75 ± 2,14 |
37,44 ± 3,52 |
7,36 ± 0,04 |
-2,68 ± 2,84 |
37,94 ± 3,13 |
7,37 ± 0,05 |
-0,75 ± 2,24 |
38,96 ± 3,97 |
Табл. 7. Концентрация калия и натрия плазмы крови у пациентов с различными методами ортотопической илеоцистопластики, ммоль/л
|
Месяц |
по Хаутману, n = 13 |
по Штудеру, n = 27 |
J-резервуар, n = 28 |
||||||
|
К+ |
Na+ |
Cl- |
К+ |
Na+ |
Cl- |
К+ |
Na+ |
Cl- |
|
|
1 мес. |
4,95 ± 0,46 |
139,22 ± 4,73 |
107,3 ± 3,96 |
4,91 ± 0,58 |
139,12 ± 4,83 |
106,3 ± 3,26 |
5,07 ± 0,62 |
140,3 ± 3,56 |
105,3 ± 3,06 |
|
3 мес. |
4,98 ± 0,42 |
142,92 ± 9,14 |
106,8 ± 2,16 |
4,94 ± 0,46 |
143,02 ± 9,04 |
105,9 ± 3,63 |
5,10 ± 0,41 |
142,7 ± 4,69 |
103,4 ± 3,38 |
|
6 мес. |
5,16 ± 0,14 |
137,12 ± 4,53 |
105,8 ± 3,76 |
5,26 ± 0,07 |
137,72 ± 4,71 |
105,3 ± 3,66 |
4,92 ± 0,38 |
139,64 ± 3,02 |
104,5 ± 3,24 |
|
12 мес. |
5,11 ± 0,23 |
143,07 ± 3,02 |
105,6 ± 2,92 |
4,91 ± 0,33 |
142,87 ± 4,12 |
105,6 ± 2,86 |
4,90 ± 0,51 |
142,27 ± 5,02 |
103,8 ± 3,16 |
J-резервуаром были в норме. Средние значения pH у больных с резервуаром по Studer и Hautmann через 1 месяц после операции были ниже нормы и соответствовали умеренному ацидозу. Через 1 месяц после операции по Studer дефицит оснований был равен -7,47 ± 5,24, после операции по Hautmann -7,54±4,14. К третьему месяцу значения были еще ниже -8,34 ± 2,68 и -8,04 ± 2,28, соответственно. К 12 месяцу значения дефицита оснований возвращались к нормальным значениям.
Заключение
Предложенный способ формирования подвздошнокишечного мочевого резервуара без дополнительных затрат, усложнения техники, увеличения длительности и травматичности операции позволяет реализовывать континентную ортотопическую деривацию мочи с сопоставимыми с классическими технологиями Studer и Hautmann уродинамическими показателями и лучшими показателями метаболических изменений в послеоперационном периоде. Данный метод позволяет избежать развития натяжения в зоне анастомоза между уретрой и мочевым резервуаром даже при недостаточной длине брыжейки тонкой кишки.
Список литературы Уродинамические и метаболические эффекты реконструкции мочевого пузыря подвздошно-кишечным J-резервуаром
- Bachor R. Continence after total bladder replacement: urodynamics analysis of ileal neobladder/R. Bachor [et al.]//Brit. j. urol. -1990. -Vol. 65. -P. 462-467.
- Camay M. Le entroplasty apres cystoprostatectomie total pour cancer de la vessie/M. Camay [et al.]//Eur. urol. -1979. -Vol. 13. -P. 114-123.
- Hautmann R.E. The ileal neobladder/R.E.Hautmann [et al.]//J. urol. -1988. -Vol. 139. -P. 39-42.
- Hautmann R.E. Urinary diversion: ileal conduit to neobladder/R.E. Hautmann//J. urol. -2003. -Vol. 169. -P. 834-842.
- Kock N.G. Replacement of the bladder by the urethral Kock pouch, functional results, urodinamics and radiological features/N.G. Kock [et al.]//J. urol. -1989. -Vol. 141. -P. 1111-1116.
- Lilien Q.M. 25 yers experience with replacement of the human bladder (Camey Procedure)/Q.M. Lilien [et al.]//J. urol. -1984. -Vol. 132. -P. 886-891.
- Le Duc A. An original antireflux ureteroileal implantation technique: long term folo-ww up/A. Le Duc [et al.]//J. urol. -1987. -Vol. 137. -P. 1156-1158.
- Mc Guire E.J. Clinical assessment of urethral sphincter function/E.J. McGuire [et al.]//J. urol. -1993. -Vol. 150. -P. 1452-1454.
- Stein J.P. Carcinoma of bladder: innovations in management/J.P. Stein//-Berlin. -1998. -P. 155-168.
- Studer U.E. Three years experience with an ileal low pressure bladder substitute/U.E. Studer [et al.]//Br. j. urol. -1989. -Vol. 63. -P. 43-52.


