Уснея нитевидная (Usnea Utilissima Stirt): фармакогностический анализ и оценка жизнеспособности мезинхимальных стромальных клеток человека в эксперименте in vitro
Автор: Капустина Ю.А., Цыбденова А.П., Рабданова Н.П.
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Рубрика: Медицина
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
С древних времен известно использование лишайников в качестве лечебного средства. Народы Сибири, Дальнего Востока и жители лесотундровой зоны среди лишайников активно применяли Уснею против легочных, кожных и желудочно-кишечных болезней в виде настоев, отваров, порошков и др. [4; 8]. В данной работе представлены исследования Уснеи нитевидной (Usnea Utilissima Stirt), даны фармакогностические характеристики. Описаны внешние признаки растения, проведена микроскопия, фитохимический анализ подтвердил наличие некоторых биологически активных вещества, показатели доброкачественности и содержание экстрактивных веществ и отсутствие посторонних органических и минеральных примесей. Также была определена жизнеспособность первичной линии клеток при введении в питательную среду для культивирования водного раствора лишайника в разных концентрациях [1].
Фармакогностический анализ, лишайники, стромальные мезинхимальные стволовые клетки человека, клеточные технологии
Короткий адрес: https://sciup.org/148332676
IDR: 148332676 | УДК: 615.322. 576.5 | DOI: 10.18101/2306-1995-2025-2-23-32
Текст научной статьи Уснея нитевидная (Usnea Utilissima Stirt): фармакогностический анализ и оценка жизнеспособности мезинхимальных стромальных клеток человека в эксперименте in vitro
В традиционной медицине многих стран лишайники использовались как лечебное средство. Род Usnea (семейство Пармелиевые; лишайниковые аскомице-ты) представляет собой типичную группу в основном бледно-серовато-зеленых кустистых лишайников. В мире известно более 360 видов Usnea. Уснея издавна считалась средством лечения различных заболеваний, а в восточных странах, таких как Китай, Япония, Тайвань, Индия, также использовалась в качестве косметического средства, консерванта и дезодоранта [2; 6].
Биологически активные вещества, содержащиеся в лишайниках, обладают широким спектром лекарственных свойств, включая противомикробные, противомикотические, противовирусные, противовоспалительные и радиозащитные действия. Несмотря на это, состав лишайников и механизмы действия их компонентов еще недостаточно изучены [4; 6]. Исследования показывают, что конкретные метаболиты, такие как секвойетанидин и лихеновые кислоты, обладают значительным потенциалом в разработке новых терапевтических средств. Долгое время большинство достижений фундаментальных и прикладных исследований в области медицины зависели от экспериментов, проводимых на животных1. Однако с целью минимизации количества подопытных животных или полной их замены для изучения токсичности различных препаратов и соединений в настоящее время широко используются культуры клеток человека и животных в качестве модельных систем [1].
Культуры клеток позволяют не только контролировать морфофизиологические особенности клеток, но и обеспечивают большую воспроизводимость результатов. Кроме того, такие методы существенно сокращают временные и экономические затраты. Важным аспектом является и биоэтика: использование клеточных культур способствует уменьшению необходимости в испытаниях на животных, что соответствует современным этическим стандартам в научных исследованиях.
Таким образом, интеграция исследований на основе клеточных культур и изучение биологически активных веществ из лишайников открывает новые горизонты для разработки эффективных лекарственных средств и минимизации воздействия на живые организмы.
В настоящее время технология культивирования клеток человека считается одним из ключевых направлений, без которого невозможно дальнейшее развитие научных исследований в биологии, медицине и фармакологии. Клеточные и тканевые культуры сегодня применяются не только в качестве модельных систем для изучения механизмов патогенеза различных заболеваний и оценки эффективности и токсичности новых лекарственных средств, но и для исследования клеточного взаимодействия, дифференцировки и дедифференцировки клеток, трансдукции сигналов, а также реакции клеток на внешние воздействия и многих других процессов.
С каждым годом растет популярность нового направления — медицины, базирующейся на технологиях культивирования клеток человека. Это открывает новые горизонты для диагностики и терапии, обеспечивая более точные и персонализированные подходы к лечению заболеваний.
Клеточные технологии — это одно из приоритетных направлений современной медицины [11].
Целью данного исследования явилось изучение влияния водного раствора Уснеи нитевидной ( Usnea utilissima Stirt ) на рост и развитие мезенхимальных стромальных клеток пупочного канатика человека в эксперименте in vitro, а также проведение фармакогностического анализа данного лекарственного растительного сырья. Для достижения поставленной цели были сформулированы следующие задачи:
-
1. Провести анализ морфологических и функциональных характеристик культивируемых стромальных мезенхимальных стволовых клеток пупочного канатика человека.
-
2. Оценить жизнеспособность стромальных мезенхимальных стволовых клеток пупочного канатика человека в условиях присутствия водного раствора уснеи нитевидной ( Usnea utilissima Stirt ) в среде культивирования.
-
3. Изучить фармакогностические характеристики лишайника: внешние признаки, микроскопический анализ, фитохимический анализ, показатели доброкачественности, наличие посторонних примесей.
Материалы и методы исследования
Работа с клеточной культурой проводилась на базе ООО «Малое инновационное предприятие “Байкальский центр биотехнологий”».
Для достижения поставленной цели в исследовании проводились стандартные процедуры ведения клеток в культуре, включая пересев клеток, замену среды, микроскопию и подсчет клеток. Эти методы позволили обеспечить оптимальные условия для роста и развития мезенхимальных стромальных клеток пупочного канатика человека, а также получить точные данные о влиянии водного раствора уснеи нитевидной ( Usnea utilissima Stirt ) на их жизнеспособность и морфологические характеристики1.
Объектом исследования служили мезенхимальные стромальные клетки вар-тонова студня пупочного канатика человека. Водный раствор лишайника был приготовлен из средства «Уснея», фирма-изготовитель: ООО «Шалфей», г. Иркутск, «Фиточаи байкальские», серия: 011217.
В работе использовали среду для культивирования клеток человека DМЕМ (ПанЭко, Россия), содержащую 10% бычьей сыворотки, 1% пенициллин-стрептомицина (5000 Ед/мл) и 1% гентамицина. Пассирование клеток осуществляли с применением раствора Версена и 0,25% раствора трипсина (ПанЭко, Россия). Клетки культивировали во флаконах из пластика площадью 25 см², а также использовали 6-луночные плоскодонные планшеты (Eppendorf, Германия) [11].
Для ведения культуры клеток было необходимо использовать следующее оборудование: ламинарный бокс II класса биобезопасности (Ламинарные системы, Россия), инкубатор с параметрами 5% СО 2 , 95% влажности и температурой 37 °C (Binder, Германия; Biosan, Латвия), инвертированный микроскоп (Биолаб, Россия) и центрифугу (Россия).
Для оценки влияния водного раствора лишайника на жизнеспособность клеток были исследованы 5 экспериментальных групп: 1-я группа — негативный контроль, к клеточной суспензии добавляли среду ДМЕМ без фетальной сыворотки; 2-я группа — позитивный контроль, суспензия клеток вносилась в среду ДМЕМ с содержанием 10%-ной фетальной сыворотки; 3-я, 4-я, 5-я экспериментальные группы. Клетки вносили в питательную среду ДМЕМ+10% фетальной бычьей сыворотки и добавляли водные растворы лишайника в концентрации 0,1; 0,01; 0,001% соответственно.
Контроль жизнеспособности клеток проводился через 7 суток с использованием метода подсчета клеток в камере Горяева. Для этого клетки отделяли от поверхности культурального пластика, как и при пересеве, с помощью растворов Версена и трипсина. Затем в камеру Горяева вносили необходимый объем клеточной суспензии (10 мкл).
Производили подсчет количества клеток по следующей формуле, где х — искомое количество клеток в 1 мл раствора (суспензии), a — сумма клеток, посчитанных в 15 квадратах; b — фактор разведения: х = а*250 х Ь х 10000 /15.
Было проведено изучение анатомо-диагностических признаков сырья и определены показатели влажности, золы общей и нерастворимой в хлористоводородной кислоте, содержание экстрактивных веществ согласно методикам, принятым на официальные виды согласно ГФ XV издания, проведение качественные реакции на основные группы БАВ.
Фармакогностический анализ проводился в лаборатории, на кафедре фармации. Для фармакогностического анализа применяли методы микроскопии, фито-химический анализ по идентификации лекарственного растительного сырья [6], для определения показателей доброкачественности проводили сжигание в фарфоровом тигле в муфельной печи, для определения содержания экстрактивных веществ использовали метод многократной экстракции.
Для получения статистических данных применяли программу STATISTICA 6.0.
Результаты и обсуждение
В начале XX в. стали возможными выделение клеток из тканей животных и их культивирование вне организма, то есть in vitro. Клеточные технологии представляют собой широкий спектр подходов и методов, среди которых можно выделить получение клеток, свободных от микробной контаминации; обеспечение роста и развития клеток, изолированных из различных тканей и органов, а также методы оценки состояния клеток в культуре и анализа их динамики развития. Эти технологии играют ключевую роль в биомедицинских исследованиях и позволяют изучать механизмы заболеваний, тестировать новые препараты и разрабатывать клеточные терапии [9].
Использование различных линий клеточных культур позволяет выбрать оптимальный объект для исследования и изолированно изучать специфику цито-протекторного действия на клетки различных органов и тканей человека. В современности клеточные технологии активно применяются в медицине с целью заживления различных ран, что включает восстановление структурной и функциональной активности поврежденных тканей в тех случаях, когда традиционные методы лечения оказываются малоэффективными или бессильными. В связи с этим возникает необходимость создания адекватных условий для роста клеток in vitro, которые способны поддерживать их жизнеспособность и функциональность, что имеет важное значение для успешного применения клеточных терапий и развития новых медицинских подходов [10].
В последние десять лет особое внимание уделяется изучению реакций стволовых клеток человека, как эмбриональных (ЭСК), так и мезенхимальных клеток, обладающих тканеспецифичной природой (МСК), на различные стрессовые воздействия, включая тепловой шок и окислительный стресс. Эти исследования нацелены на разработку эффективных протоколов для применения стволовых клеток в регенеративной медицине.
Интересно отметить, что ответная реакция клеток может варьироваться в зависимости от их типа, а также от характера и уровня оказываемого стресса. Клетки могут реагировать различными способами, включая индукцию пролиферации, дифференцировку, остановку клеточного цикла, репарацию повреждений, старение, апоптоз или опухолевую трансформацию. Понимание этих различных реакций имеет важное значение для клинической практики и может раскрыть механизмы, стоящие за процессами регенерации тканей [8].
При анализе морфофизиологических особенностей культивируемых мезенхимальных стволовых клеток человека из пупочного канатика было выявлено, что стволовые клетки человека, используемые в работе, относились к первичной выделенной культуре 4-го пассажа.
При проведении микроскопии было установлено, что исследуемые клетки имеют размер от 50 до 150 мкм и обладают веретеновидной или звездчатой формой благодаря вытянутым отросткам длиной 30–50 мкм. Эти клетки проявляли адгезивные свойства, прилипая к поверхности пластика в течение 30–60 минут после пересевания. Ядра клеток располагались централизованно (рис. 1А). Исследуемые клетки формировали монослой на поверхности культурального пластика и выглядели как густая сеть отростков с клоногенным характером роста (рис. 1Б).
А. Морфоструктурные особенности мезен- химальных стволовых клеток человека in vitro. Увеличение x250.
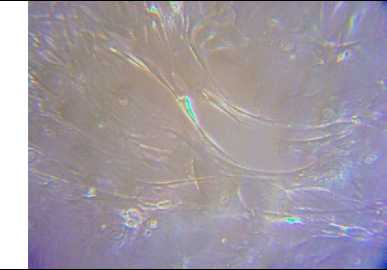
Рис. 1. Особенности морфологии и физиологии мезенхимальных стволовых клеток человека пупочного канатика человека в культуре
Б. Морфофизиологические особенности роста мезенхимальных стволовых клеток человека in vitro. Увеличение x250.
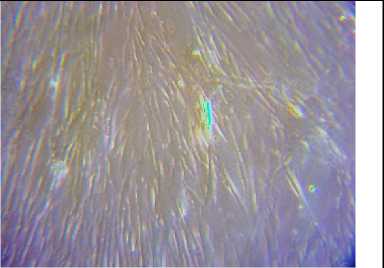
Культуры дифференцированных клеток проявляли высокую адгезивность к поверхности культурального пластика и были способны делиться в питательной среде, формируя монослой; таким образом, они функционировали как полноценные клеточные тест-модели. В ходе определения жизнеспособности клеток было установлено, что экстракты уснеи нитевидной не обладают цитотоксическим действием в концентрациях 0,1–0,001% на культурах клеток. При концентрации 0,01% Уснеи нитевидной отмечались адгезия, положительный пролиферативный ответ и индукция роста в среде культивирования.
В настоящее время изолированные и культивированные мезенхимальные стромальные клетки (МСК) пупочного канатика представляют собой перспективный объект для хранения в ведущих биобанках мира, и число зарегистрированных клинических испытаний с их использованием постоянно увеличивается [2]. К МСК пупочного канатика также относят клетки, выделенные из целого фрагмента канатика, что в англоязычной литературе обозначается как « total umbilical cord-derived cells » [8].
Безопасность и эффективность водного раствора лишайника Уснеи была установлена в отношении культуры мезенхимальных стромальных клеток человека, выделенных из пупочного канатика. Полученные результаты представлены в пяти группах на рис. 2.
В культуральную суспензию мезенхимальных стромальных клеток пупочного канатика человека вносили водный раствор Уснеи нитевидной в концентрациях 0,001; 0,01 и 0,1% — 3-й, 4-й и 5-й группы соответственно. 1-я и 2-я группы — контроль негативный (среда ДМЕМ без сыворотки) и контроль позитивный (среда ДМЕМ + 10% фетальной бычьей сыворотки). В экспериментальных группах через каждые 3 суток анализировали морфофизиологическое состояние по сравнению с положительным и отрицательным контролем, проводили замену сред. Завершался эксперимент подсчетом клеток в камере Горяева через 7 дней.
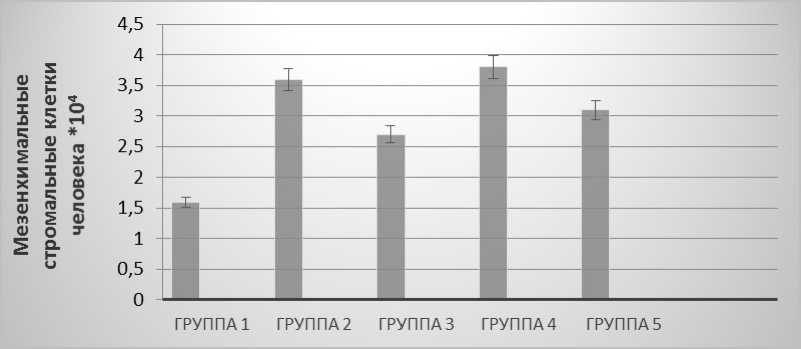
Рис. 2. Пролиферативная активность стромальных мезенхимальных клеток человека при внесении водного раствора уснеи нитевидной
По истечении 7 суток отмечали наибольшее количество клеток в группе 4 (концентрация раствора Уснеи 0,01%), что было близко к показателям контрольной позитивной группы, пролиферативная активность в группах 3 и 5 не достигала значений позитивного контроля, но превышала в количественном отноше- нии показатели негативного контроля на 32 и 53% соответственно. В группе 1 (среда ДМЕМ без фетальной эмбриональной сыворотки) наблюдали гибель клеток: не прикрепленные конгломераты или одиночно присутствующие в суспензии следы клетки. В позитивном контроле — в среде DMEM c 10%-ной эмбриональной сывороткой — клетки адгезировали и делились, через 3 суток образовывали монослой. В среде культивирования в присутствии водного раствора лишайника стромальные мезенхимальные клетки человека также прикреплялись к поверхности культурального пластика и пролиферировали аналогично культуре клеток в среде с добавлением эмбриональной сыворотки (рис. 2).
Таким образом, в ходе эксперимента по влиянию на жизнеспособность культивируемых в течение 7 суток МСК человека водного раствора лишайника Уснеи нитевидной установлено, что клетки в течение всего периода сохраняли морфофизиологические особенности и пролиферативную активность. Ростстимулиру-ющая активность в группе с добавлением водного раствора лишайника в концентрации 0,01% была выше значений позитивной контрольной группы, чем в группах при концентрации 0,1; 0,001% раствора с Уснеей.
Полученные результаты показывают пролиферативную активность в культуре мезенхимальных стромальных клеток человека при введении в среду водного раствора лишайника Уснеи нитевидной.
Использованные в работе клетки представляют собой экономически выгодные и оперативно реагирующие тест-системы, которые могут быть рекомендованы для анализа токсических агентов новых веществ, а также лекарственных и косметических средств, контактирующих с кожей человека.
Определены внешние и микроскопические признаки Уснеи нитевидной ( Usnea Utilissima Stirt ).
Внешние признаки. Цельное сырье
Слоевище имеет бледно-зеленую и пепельно-грязно-зеленую окраску, достигает длины до 30 см и имеет бородовидную форму. Веточки слоевища округлые, тонкие, сильно вытянутые и ветвящиеся, на концах тонкие, с шероховатой поверхностью, покрытые мелкими заостренными сосочками и соредиозными бугорками. Измельченное сырье представляет собой кусочки слоевища различной формы, которые проходят сквозь сито с отверстиями размером 1 мм. Цвет кусочков варьируется от бледно-зеленого до пепельно-грязно-зеленого. Запах сырья душистый.
Микроскопические признаки. Цельное сырье
При рассмотрении слоевища с поверхности видны клетки водорослей и гифы грибов. Таллом Уснеи действительно имеет характерную форму, образованную длинными и параллельно ниспадающими нитевидными ветвями. Эти ветви могут создавать впечатление "падающей" структуры, что придает Уснее уникальный вид. Немногочисленные боковые ответвления добавляют разнообразия, но в целом форма таллома остается аэродинамической, что помогает Уснее адаптироваться к различным условиям окружающей среды.
Определены показатели испытаний (табл. 1) и нормы для измельченного сырья Usnea Utilissima .
Определены внешние признаки цельного, измельченного сырья Usnea Utilissima . Изучены микроскопические признаки. Определены нормы показателей доброкачественности сырья для Уснеи нитевидной.
В ходе данной работы выявлены внешние и микроскопические признаки слоевища уснеи, определены требования к показателям доброкачественности, проведены качественные реакции на биологически активные вещества с помощью общепринятых реакций.
Таблица 1
Фармакогностические характеристики Usnea Utilissima
|
Показатель, % |
||
|
Установленная норма, % |
||
|
Влажность |
7,28 |
не более 8 |
|
Зола общая |
1,38 |
не более 2 |
|
Зола, нерастворимая в хлористоводородной кислоте |
1,15 |
не более 2 |
|
Экстрактивные вещества, извлекаемые спиртом этиловым 70% |
11,09 |
не менее 10 |
|
Частиц, проходящих сквозь сито с отверстиями размером 5 мм |
100 |
не более 5 |
|
Частиц, проходящих сквозь сито с отверстиями размером 0,5 мм |
100 |
не более 5 |
|
Частиц, проходящих сквозь сито с отверстиями размером 0,1 мм |
95,29 |
не более 5 |
|
Другие части этого растения |
– |
не более 5 |
|
Почерневших на изломе |
– |
не более 5 |
|
Органическая примесь |
– |
не более 5 |
|
Минеральная примесь |
– |
не более 5 |
Полученные данные могут быть использованы при создании новых фитопрепаратов на основе представленного лишайника, а также для дальнейших исследований с целью внедрения данного средства в официальную медицину.
Выводы
-
1. Проведен морфофункциональный анализ клеток, в ходе которого были подробно описаны морфологические и физиологические особенности мезенхимальных стволовых клеток пупочного канатика человека in vitro. Исследование включало оценку клеточной морфологии с использованием микроскопии, анализ жизнеспособности клеток с помощью различных методов, а также изучение их способности к дифференциации и пролиферации.
-
2. Установлено сохранение жизнеспособности морфологических и физиологических особенностей мезенхимальных стволовых клеток человека при культивировании в среде, содержащей 0,1–0,001% водного раствора лишайника Уснеи нитевидной.
-
3. Выявлены фармакогностические характеристики Уснеи нитевидной.
Эти результаты подчеркивают потенциал использования водных экстрактов Уснеи в фитотерапии, что может открыть новые перспективы в регенеративной медицине.


