Усовершенствование условий постановки метода непрямого иммуноферментного анализа для диагностики энзоотического лейкоза крупного рогатого скота
Автор: Усольцев К.В., Шангараев Р.И., Горбунова М.Е., Ахмадеев Р.М., Хаертынов К.С.
Рубрика: Ветеринария
Статья в выпуске: 2 т.262, 2025 года.
Бесплатный доступ
Энзоотический лейкоз является наиболее распространенным инфекционным заболеванием крупного рогатого скота, которое наносит значительный экономический ущерб, представляя угрозу исчезновения генофонда основных ценных высокопродуктивных пород. Одним из ведущих факторов, снижающих эффективность оздоровительных мероприятий против данной инфекции, является недостаточная диагностика. Иммуноферментный анализ (ИФА) относится к высокочувствительным серологическим тестам. Международное эпизоотическое бюро рекомендует использовать ИФА как один из основных методов диагностики энзоотического лейкоза крупного рогатого скота. ИФА благодаря высокой чувствительности, специфичности, а также возможности автоматизирования постановки реакции показал высокую эффективность при ликвидации лейкоза в неблагополучных хозяйствах. В механизм ИФА заложено взаимодействие антигена со специфическими к нему антителами. Комплекс «антиген-антитело» выявляется с помощью вспомогательных компонентов реакции, таких как конъюгат антивидовых антител, меченных ферментом, и субстрат с хромогеном. Однако при постановке ИФА возможно появление ложноположительных и ложноотрицательных результатов, уменьшение которых с одновременным улучшением диагностических характеристик анализа имеют актуальность. Целью настоящих исследований являлось усовершенствование условий постановки ИФА для детекции специфических антител против возбудителя лейкоза крупного рогатого скота. Установлено, что водный раствор 2% глутарового альдегида повышает сорбционную активность планшета, оптимальная концентрации вирусного антигена, полученного из хронически инфицированной культуры клеток почек эмбриона овцы для сенсибилизации планшета, составляет 5 мкг/мл, блокирующего раствора – 0,5% интактная сыворотка овцы. Также данная сыворотка оказывает стабилизирующее действие на конъюгат и исключает неспецифическое взаимодействие антивидовых антител с антителами анализируемых образцов. Использование параметра встряхивания планшета в термошейкере повышает коэффициент позитивности положительной сыворотки и, следовательно, чувствительность анализа. Оптимизированный вариант ИФА показал высокую специфичность и чувствительность.
FLK BLV, вирус лейкоза, антиген, антитела, интактная сыворотка овцы, иммуноферментный анализ
Короткий адрес: https://sciup.org/142246128
IDR: 142246128 | УДК: 619:616-097:578.828.11 | DOI: 10.31588/2413_4201_1883_2_262_69
Текст научной статьи Усовершенствование условий постановки метода непрямого иммуноферментного анализа для диагностики энзоотического лейкоза крупного рогатого скота
Недостаточная диагностика является ведущим фактором низкой эффективности оздоровительных мероприятий в неблагополучных по лейкозу крупного рогатого скота хозяйствах [4]. Несмотря на внедрение в практику ветеринарных лаборатории современных методов диагностики лейкоза, таких как полимеразная цепная реакция (ПЦР) [5], серологические методы занимают основное место в массовых диагностических исследованиях. Иммуноферментный анализ (ИФА) является высокочувствительным серологическим методом, который показал высокую эффективность при оздоровлении хозяйства от лейкоза крупного рогатого скота, когда возникает необходимость исследования большого количества образцов сывороток [6]. ИФА основан на индикации специфических антител в сыворотках крови животных, выявляемых при помощи антигенов вируса лейкоза крупного рогатого скота [7]. Основным средством получения антигенов gp51 и р24, используемыми в ИФА тест-системах для диагностики лейкоза скота является вирус, культивируемый в хронически инфицированной культуре клеток почек эмбриона овцы (FLK BLV) [8]. Однако несмотря на то, что метод ИФА широко применяется для эпизоотологического мониторинга лейкоза крупного рогатого скота и сконструированы различные варианты диагностических ИФА тест-систем, уменьшение ложноположительных и ложноотрицательных результатов анализа с параллельным улучшением диагностических параметров тест-системы, таких как чувствительность и специфичность имеют актуальность.
Целью данного исследования являлось усовершенствование условий постановки непрямого твердофазного ИФА для индикации специфических антител против вируса лейкоза крупного рогатого скота
Условия, материалы и методы. Антиген . В работе использовали антигенный материал вируса лейкоза крупного рогатого скота, полученный из FLK BLV и очищенный методом ультрацентрифугирования в градиенте плотности сахарозы [9].
Планшет . В качестве твердой фазы применяли стрипованные планшеты производства АО «Фирма Медполимер» (Россия).
Контрольные образцы . В качестве положительного контрольного образца (ПКО) и отрицательного контрольного образца (ОКО) использовали пробы сывороток крови крупного рогатого скота, которых исследовали коммерческими серологическими наборами и подтверждали наличие/отсутствие специфических антител против вируса лейкоза крупного рогатого скота. Также дополнительно от этих же животных отбирали кровь с целью установления наличия или отсутствия провирусной ДНК методом ПЦР [10].
Сыворотки . Для блокирования свободных центров связывания лунок планшета использовали интактную сыворотку овцы.
Концентрацию белка в овечьей сыворотке измеряли спектрофотометрическим методом с использованием для расчета эмпирической формулы Калькара.
Конъюгат антивидовых антител . В качестве конъюгата антивидовых антител был использован коммерческий препарат антивидовых антител кролика против иммуноглобулинов крупного рогатого скота, меченных ферментом пероксидазой, производства ООО «ИМТЭК» (Россия).
Непрямой вариант ИФА . Определение серологической активности полученного антигена в твердофазном непрямом ИФА осуществляли по общепринятой методике. Для повышения сорбционных свойств лунок планшета использовали глутаровый альдегид в виде 2% раствора на дистиллированной воде по 100 мкл на каждую лунку с инкубированием планшета 2 ч при температуре 37ºС. После инкубации раствор глутарового альдегида сливали и планшет промывали один раз карбонатно-бикарбонатным буферным раствором (КББ), рН которого составил 9,5. После промывки осуществляли сенсибилизацию лунок планшета очищенным на градиенте плотности сахарозы антигеном в концентрациях от 1 до 20 мкг/мл. Антиген разводили на КББ (рН 9,5), объем раствора антигена для каждой лунки равнялся 100 мкл. Планшет с антигеном выдерживали при температуре от 2°С до 8°С в течение 16 ч. Далее раствор антигена сливали и планшет промывали один раз фосфатносолевым буферным раствором ФСБ (рН-7,3) содержащим Твин-20 в концентрации 0,1% (ФСБ-Т). С целью блокировки свободных центров связывания лунок планшета использовали интактную сыворотку крови овцы, которую вносили по 100 мкл на каждую лунку и инкубировали планшет на термошейкере ELMI
ST-3 (Латвия) в течение 2 ч при температуре 37ºС и встряхиванием 300 об/мин. После инкубации раствор овечьей сыворотки сливали и планшет промывали один раз ФСБ-Т. Исследуемые сыворотки разводили на ФСБ-Т и планшет с сыворотками инкубировали на термошейкере в течение 45 мин при температуре 37ºС и встряхиванием 600 об/мин. После чего сыворотки сливали и планшет промывали трехкратно ФСБ-Т. Для индикации образованных комплексов «антиген-антитело» использовали антивидовой конъюгат против иммуноглобулинов крупного рогатого скота. С целью стабилизации конъюгата его рабочее разведение (1:30000 согласно инструкции) разбавляли интактной сывороткой крови овцы в соотношении 1:10. Планшет с конъюгатом инкубировали в аналогичных для исследуемых сывороток крупного рогатого скота условиях. Далее раствор конъюгата сливали и планшет промывали пятикратно ФСБ-Т. Визуализацию образованных комплексов «антиген-антитело-антивидовое антитело» осуществляли добавлением в каждую лунку планшета по 100 мкл субстратного раствора с хромогенным компонентом тетраметилбензидином (ООО ИМТЭК, Россия) с выдерживанием планшета в течение 10 мин в темном месте. Для остановки реакции использовали 1М раствор серной кислоты. Оптическую плотность (ОП) исследуемых образцов определяли на спектрофотометре Multiskan Go Thermo Scientific (США) при длине волны 450 нм.
В качестве основного показателя, характеризующего позитивность анализируемой сыворотки крупного рогатого скота или наоборот, приняли коэффициент позитивности (Р) (отношение оптической плотности исследуемой сыворотки к оптической плотности отрицательного образца). Если коэффициент Р составил ≥2,2, то исследуемую сыворотку крупного рогатого скота приняли как положительную на содержание антител к вирусу лейкоза крупного рогатого скота. Образец интерпретировали как сомнительный, если Р варьировал от 2,0 до 2,2. В качестве отрицательного результата приняли значения коэффициента Р<2,0.
Результаты и обсуждение. С целью усовершенствования условий постановки непрямого варианта ИФА нами была проведена серия экспериментов по изучению влияния глутарового альдегида на сорбционные свойства планшета. Также определяли оптимальную концентрацию антигена вируса лейкоза для сенсибилизации планшета. Изучали блокирующие свойства интактной сыворотки крови овцы и влияние встряхивания планшета на чувствительность и специфичность ИФА
С целью повышения сорбции планшет инкубировали в течение 2 ч при 37ºС 2% водным раствором глутарового альдегида. В данном исследовании глутаровый альдегид выполнял ключевую роль мостика для ковалентного соединения твердой фазы планшета и целевого белка вируса лейкоза крупного рогатого скота.
Оптимальные параметры ИФА определяли методом титрования образцов ПКО и ОКО с разведения 1:25 до 1:3200. Для оценки эффективности сорбционной активности антигена определяли коэффициент позитивности (Р), который представляет собой отношение оптической плотности (ОП) ПКО к ОП ОКО (табл. 1).
Таблица 1 - Влияние глутарового альдегида да сорбционную активность планшета
|
Степень разведения сыворотки |
Глутаровый альдегид |
Без глутарового альдегида |
||||
|
Оптическая плотность (М± SD) |
Р |
Оптическая плотность (М± SD) |
Р |
|||
|
ОКО |
ПКО |
ОКО |
ПКО |
|||
|
1:25 |
0,203±0,06 |
1,214±0,08 |
5,9 |
0,285±0,13 |
0,742±0,05 |
2,6 |
|
1:50 |
0,168±0,08 |
1,025±0,06 |
6,1 |
0,218±0,07 |
0,509±0,07 |
2,3 |
|
1:100 |
0,094±0,15 |
0,927±0,05 |
9,8 |
0,105±0,08 |
0,386±0,04 |
3,6 |
|
1:200 |
0,068±0,03 |
0,783-±0,07 |
11,5 |
0,082±0,06 |
0,301±0,14 |
3,7 |
|
1:400 |
0,049±0,09 |
0,496±0,04 |
10,1 |
0,067±0,04 |
0,254±0,07 |
3,8 |
|
1:800 |
0,032±0,05 |
0,358±0,06 |
11,1 |
0,052±0,15 |
0,226±0,03 |
4,3 |
|
1:1600 |
0,024±0,07 |
0,227±0,04 |
9,4 |
0,036±0,09 |
0,171±0,05 |
4,7 |
|
1:3200 |
0,016±0,06 |
0,129±0,09 |
8,0 |
0,021±0,05 |
0,115±0,08 |
5,4 |
Из таблицы 1 видно, что 2% водный раствор глутарового альдегида повышает сорбционную активность планшета тем самым увеличивая коэффициент позитивности и в целом повышая чувствительность, а также специфичность ИФА.
Для определения оптимальной сенсибилизирующей концентрации антигена вируса лейкоза были использованы следующие его разведения: 1; 2,5; 5; 10 и 20 мкг/мл. Результаты ИФА показали, что наиболее оптимальная концентрация антигена составляет 5 мкг/мл, при которой оптическая плотность (ОП) ПКО составила 1,325, а ОКО – 0,280, а Р был равным 4,7 ед. Также следует отметить, что при концентрациях 2,5 и 1,0 мкг/мл антиген вируса лейкоза проявлял наиболее низкую серологическую активность, коэффициент отношения ОП отрицательного и контрольного образцов был равным 1,23 и 0,94 ед. соответственно.
По литературным данным известно, что в ИФА с целью блокирования свободных центров связывания лунок планшета для снижения неспецифических реакции используются такие белки как бычий сывороточный альбумин, желатин, казеин, а также сыворотка любого вида животного, обезжиренное сухое молоко [11]. Задачей следующего эксперимента было изучение блокирующей активности интактной овечьей сыворотки в 0,5, 1,0, 1,5 и 2,0% концентрациях (по белку). Установили, что наиболее оптимальным в качестве блокирующего раствора является использование 0,5% интактной сыворотки овцы, при которой оптические показатели ОКО не превышали 0,104, а оптическая плотность ПКО равнялась 2,023, коэффициент Р – 19,4. Тогда как оптическая плотность ПКО без блокировки достигла 3,154, а ОКО – 1,76, коэффициент Р – 1,8 (табл. 2).
Таблица 2 – Подбор оптимальной концентрации интактной сыворотки овцы для блокирования остаточных центров связывания лунок планшета
|
Концентрация интактной сыворотки овцы (по белку), % |
Оптическая плотность |
Р |
Оптическая плотность (без блокирующего раствора) |
Р |
||
|
ПКО |
ОКО |
ПКО |
ОКО |
|||
|
0,5 |
2,023±0,08 |
0,104±0,03 |
19,4 |
3,154±0,76 |
1,76±0,56 |
1,8 |
|
1,0 |
1,814±0,05 |
0,099±0,07 |
18,3 |
|||
|
1,5 |
1,048±0,12 |
0,093±0,05 |
11,3 |
|||
|
2,0 |
0,968±0,07 |
0,086±0,09 |
11,2 |
|||
Примечание: Разведение сывороток – 1:25.
С целью стабилизации конъюгата, рабочее разведение (1:30000) разбавляли интактной сывороткой крови овцы в соотношениях 1:1; 1:2; 1:4; 1:8 и 1:10. Для всех исследованных разведениях рабочего раствора конъюгата с интактной сывороткой овцы коэффициент позитивности составил выше 10, следовательно, данная сыворотка оказывает стабилизирующее действие на конъюгат и предотвращает неспецифическое связывание антивидовых антител с антителами анализируемых проб. Тогда как оптическая плотность ПКО без добавления интактной сыворотки овцы в раствор конъюгата – 2,673, а ОКО 1,670, коэффициент позитивности Р – 1,6 (табл. 3).
Таблица 3 - Изучение стабилизирующего действия интактной сыворотки крови овцы на рабочий раствор конъюгата
|
Разведение раствора конъюгата |
Оптическая плотность (конъюгат с интактной сывороткой овцы) |
Р |
Оптическая плотность (конъюгат без интактной сыворотки овцы) |
Р |
||
|
ПКО |
ОКО |
ПКО |
ОКО |
|||
|
1:1 |
1,490±0,09 |
0,1±0,12 |
14,9 |
2,673±0,95 |
1,670±0,78 |
1,6 |
|
1:2 |
1,488±0,07 |
0,103±0,09 |
14,4 |
|||
|
1:4 |
1,485±0,14 |
0,105±0,07 |
14,1 |
|||
|
1:8 |
1,483±0,04 |
0,106±0,05 |
14,0 |
|||
|
1:10 |
1,480±0,05 |
0,108±0,03 |
13,7 |
|||
Примечание: Разведение сывороток – 1:25
Также было изучено влияние встряхивания планшета в термошейкере на специфичность и чувствительность реакции.
Проводили ИФА с ПКО и ОКО без встряхивания и со встряхиванием при 100; 200; 400 и 600 об/мин (рис. 1).
А
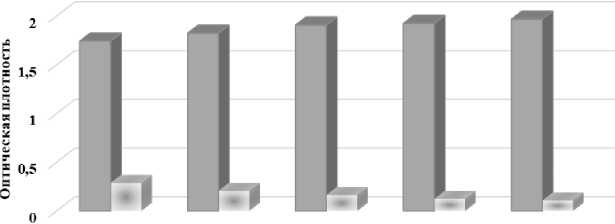
без 100 об/мин 200 об/мин 400 об/мин 600 об/мин встряхивания
Б
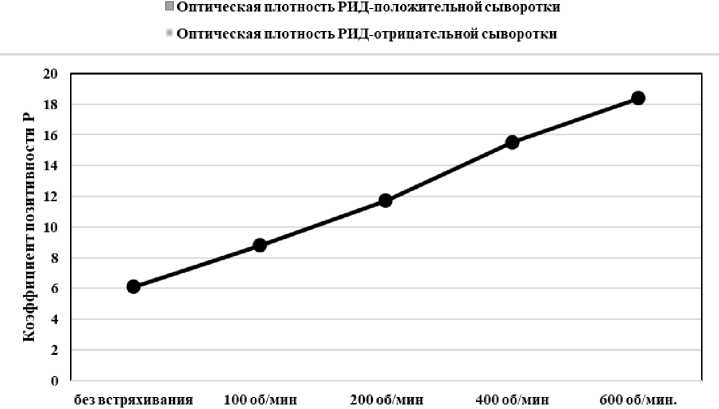
Рисунок 1 - Влияние режима встряхивания планшета в термошейкере А - на оптическую плотность ПКО и ОКО; Б - на коэффициент позитивности ПКО
Таким образом, установили, что чем выше скорость встряхивания, тем выше коэффициент Р РИД-положительной сыворотки, а также специфичность и чувствительность реакции.
Выводы. В результате проведенных экспериментов подобраны оптимальные параметры постановки непрямого твердофазного варианта ИФА для выявления антител к вирусу лейкоза крупного рогатого скота. Установлено, что водный раствор 2% глутарового альдегида повышает сорбционную активность планшета. Определены оптимальные концентрации вирусного антигена для сенсибилизации планшета, которая составляет 5 мкг/мл, блокирующего раствора - 0,5% интактная сыворотка овцы. Также данная сыворотка оказывает стабилизирующее действие на конъюгат и исключает неспецифическое взаимодействие антивидовых антител с антителами анализируемых сывороток. При постановке ИФА использование параметра встряхивания планшета на термошейкере по сравнению с условиями без встряхивания повышает чувствительность анализа. Оптимизированный вариант ИФА показал высокую специфичность и чувствительность.


