Устойчивость потенциальных продуцентов амилазы Alternaria tenuissima и Geomyces pannorum к лиофилизации
Автор: Овсянкина Софья Владимировна, Хижняк Сергей Витальевич, Аболенцева Полина Александровна, Смольникова Яна Викторовна, Олейникова Елена Николаевна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Цель исследования - проверка возможности лиофилизации штаммов Alternaria tenuissima и Geomyces pannorum, выделенных авторами в качестве потенциальных продуцентов амилазы, для пищевой промышленности. Конидии изучаемых штаммов суспендировали в защитных средах и лиофилизировали с помощью лиофилизатора Bio-Rus-4SFD. Использовали три защитные среды: стандартный желатин-сахарозный агар (сахароза 10 %, желатин 1,5 %, агар 0,01 %), рекомендованный Всероссийской коллекцией микроорганизмов; желатин-сахарозный агар с добавлением 1 % аскорбиновой кислоты в качестве антиоксиданта; пептон-сахарозо-глицериновая смесь, разработанная авторами (вода дистиллированная 90 мл, глицерин 10 мл, сахароза 10 г, пептон 3,2 г). Контролем служили конидии, суспендированные в дистиллированной воде без лиопротекторов. Жизнеспособность лиофилизированных конидий оценивали по их способности к прорастанию на агаризованной культуральной среде. Выживаемость конидий G. pannorum при лиофилизации во всех вариантах, за исключением контроля, была статистически значимо (pA. tenuissima. Жизнеспособность лиофилизированных конидий A. tenuissima не зависела от использования защитных сред и составила в контрольном варианте 75,9 %, в варианте с желатин-сахарозным агаром 76,4 %, в варианте с пептон-сахарозо-глицериновой смесью 77,1 %. Жизнеспособность лиофилизированных конидий G. pannorum без использования защитных сред составила 82,0 %, в варианте с желатин-сахарозным агаром 95,3 %, в варианте с пептон-сахарозо-глицериновой смесью 88,1 %. Добавление в защитную среду аскорбиновой кислоты в качестве антиоксиданта привело к статистически значимому (pA. tenuissima до 7,2 %, а доли выживших конидий G. pannorum до 44,4 %.
Амилаза, alternaria tenuissima, geomyces pannorum, лиофилизация, защитные среды
Короткий адрес: https://sciup.org/140299679
IDR: 140299679 | УДК: 663.15 | DOI: 10.36718/1819-4036-2023-2-247-254
Текст научной статьи Устойчивость потенциальных продуцентов амилазы Alternaria tenuissima и Geomyces pannorum к лиофилизации
Acknowledgments : the work has been financially supported by the Ministry of Agriculture of the Russian Federation within the framework of the topic "Designing protective environments for drying and developing modes of lyophilization of probiotic and soil microorganisms".
Введение. Одними из наиболее востребованных ферментов микробного происхождения, применяемых в пищевой и перерабатывающей промышленности, а также в сельском хозяйстве, являются амилазы, на долю которых приходится около 25 % мирового рынка ферментов. Микробные амилазы применяют для конверсии крахмала в олигосахариды и в глюкозу в бродильных и крахмало-паточных производствах, для отбеливания сырья в бумажном и текстильном производствах, в качестве биодобавок к моющим средствам, а также в качестве добавок в крах- малсодержащие корма в птицеводстве и животноводстве для повышения их усвояемости [1–3].
Несмотря на обилие амилолитических штаммов, применяемых в промышленности, постоянно идет поиск новых, в т. ч. нетрадиционных продуцентов микробных амилаз. В качестве одного из перспективных продуцентов амилолитических ферментов рассматриваются грибы р. Alternaria [4–6]. Другим перспективным продуцентом, позволяющим осуществлять процесс при пониженной температуре, являются выделенные из пещер низкотемпературные амилолитические штаммы Geomyces pannorum [7, 8].
Использование штаммов в биотехнологических процессах невозможно без сохранения их исходных вариантов в микробиологических коллекциях. Общепризнанным, наиболее надежным способом такого сохранения считается их сублимационное высушивание из замороженного состояния (лиофилизация) [9, 10]. Главной проблемой при лиофилизации является возможная гибель микробных клеток в процессе замораживания и высушивания. Для решения этой проблемы используют разнообразные эмпирически подбираемые защитные среды, повышающие долю выживших при лиофилизации клеток [11].
Цель исследований – изучение возможности лиофилизации выделенных авторами в ходе предыдущих исследований амилолитических штаммов Alternaria tenuissima К22 и Geomyces pannorum ВКМ F-4777D.
Задачи: проверка возможности сохранения жизнеспособности штаммов при лиофилизации без использования защитных сред, с использованием стандартных защитных сред; выбор за- щитной среды, обеспечивающей максимальное сохранение жизнеспособности исследуемых штаммов при лиофилизации.
Объекты и методы. Объектами исследования служили выделенные авторами штаммы Alternaria tenuissima К22 и Geomyces pannorum ВКМ F-4777D. Штамм Alternaria tenuissima К22 выделен из инфицированного зерна яровой пшеницы, штамм G. pannorum ВКМ F-4777D выделен из грунта карстовой пещеры Караульная-2 и запатентован в качестве низкотемпературного продуцента амилазы [12]. Оба штамма характеризуются высокой амилолитической активностью (рис. 1).
Конидии изучаемых штаммов суспендировали в одной из защитных сред, после чего лиофилизировали в лиофильной сушилке Bio-Rus-4SFD в следующем режиме: замораживание при –36 °C в течение 5 ч; основная сушка при –40 °C в течение 15 ч при давлении 60 Па; вторичная сушка с шагом от 5 °C до 15 °C при давлении 80 Па в течение 5 ч [13, 14].
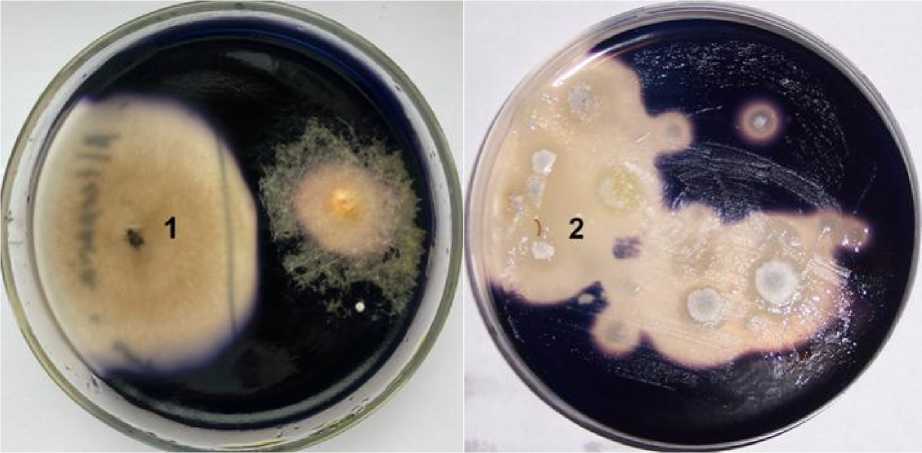
Рис. 1. Амилолитическая активность изучаемых штаммов: 1 – A. tenuissima К22; 2 – G. pannorum ВКМ F-4777D
В качестве защитных сред использовали сахарозо-желатиновый агар (среду Файбича) [15, 16], среду Файбича с 1 % аскорбиновой кислоты в качестве антиоксиданта [17] и разработанную авторами пептон-сахарозо-глицериновую среду следующего состава: пептон ферментативный сухой – 3,2 г; сахароза – 10 г; глицерин – 10 мл;
вода дистиллированная – 90 мл. Контролем служили конидии, суспендированные в дистиллированной воде без добавления лиопротекторов.
Жизнеспособность конидий после лиофилизации определяли прямым методом по их способности к прорастанию на агаризованной питательной среде (рис. 2).
Долю выживших конидий определяли как отношение числа конидий, сформировавших про-ростковые гифы, к общему числу конидий. Среднее число конидий, просмотренных в каж- дом варианте на предмет наличия проростко-вых гиф, составило 168 шт. для A. tenuissima К22 и 282 шт. для G. pannorum ВКМ F-4777D.
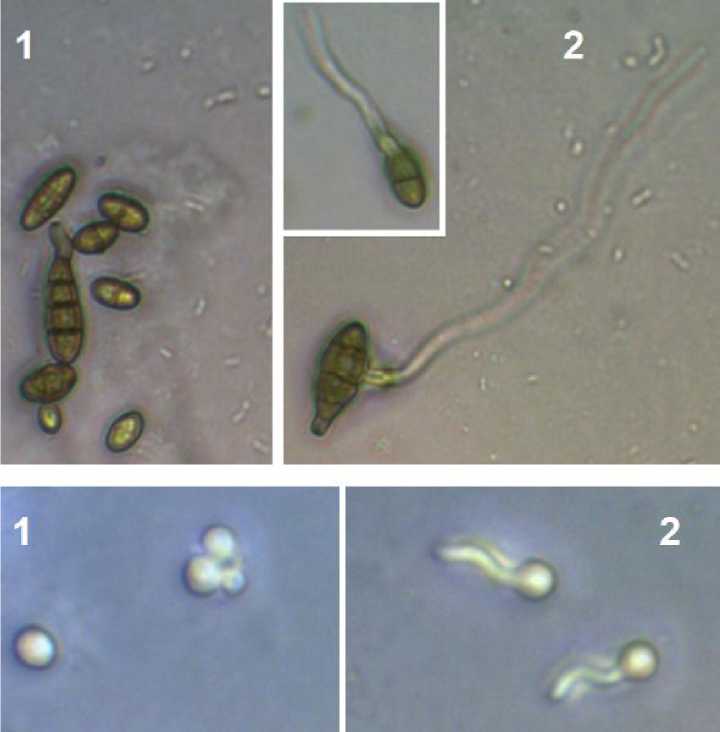
Рис. 2. Примеры непроросших (1) и проросших (2) конидий изучаемых штаммов: верхние фотографии – A. tenuissima К22; нижние фотографии – G. pannorum ВКМ F-4777D
Статистическую значимость различий между контрольным вариантом и вариантами с защитными средами по доле проросших конидий проверяли точным тестом Фишера для таблиц 2 × 2 с использованием GraphPad QuickCalcs в качестве программного обеспечения.
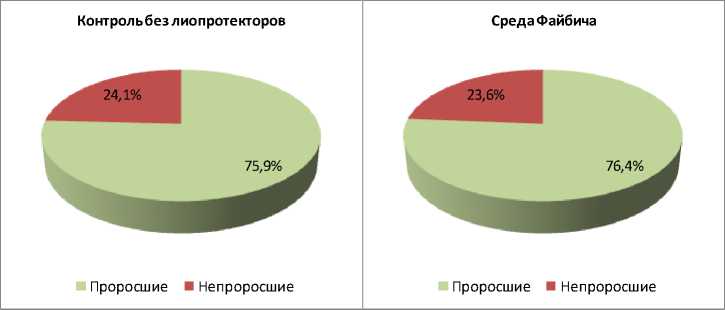
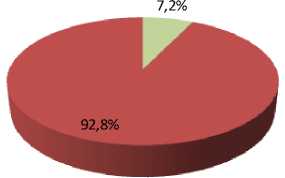
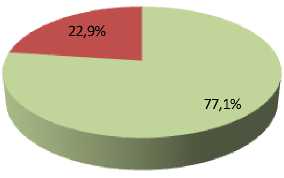
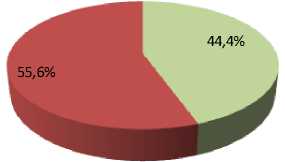
Результаты и их обсуждение. Выживаемость конидий A. tenuissima К22 в контроле (без использования защитной среды) составила 75,9 %. Использование защитной среды Файби-ча и пептон-сахарозо-глицериновой среды не привело к статистически значимому изменению доли выживших конидий, которая составила 76,4 % для среды Файбича и 77,1 % для пептон-сахарозо-глицериновой среды. Введение аскорбиновой кислоты в среду Файбича привело к статистически значимому (p < 0,001) снижению доли выживших конидий до 7,2 % (рис. 3).
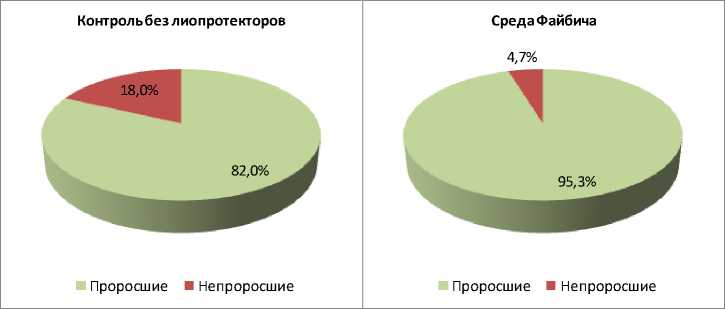
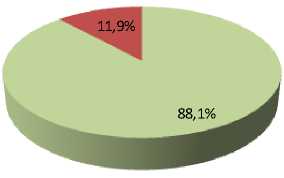
Выживаемость конидий G. pannorum ВКМ F-4777D в контроле (без использования защитной среды) составила 82,0 %. Использование защитной среды Файбича привело к статистически значимому (p < 0,001) увеличению доли выживших конидий до 95,3 %. Пептон-сахарозо-глицериновая среда также статистически значимо (p < 0,05) увеличила долю выживших конидий до 88,1 %. Как и в случае с A. tenuissima К22, введение аскорбиновой кислоты в среду Файбича привело к статистически значимому (p < 0,001) снижению доли выживших конидий G. pannorum ВКМ F-4777D (до 44,4 %) (рис. 4).
Пептон-сахарозо-глицериновая среда
Среда Файбича с аскорбиновой кислотой
-
■ Проросшие ■ Непроросшие
-
■ Проросшие ■ Непроросшие
Рис. 3. Прорастание лиофилизированных конидий A. tenuissima К22 в разных вариантах эксперимента
Пептон-сахарозо-глицериновая среда
Среда Файбича с аскорбиновой кислотой
-
■ Проросшие ■ Непроросшие
-
■ Проросшие ■ Непроросшие
Рис. 4. Прорастание лиофилизированных конидий G. pannorum ВКМ F-4777D в разных вариантах эксперимента
В целом по эксперименту выживаемость ко- тистически значимо (p < 0,001) выше, чем вы- нидий G. pannorum при лиофилизации во всех живаемость конидий A. tenuissima (табл.).
вариантах, за исключением контроля, была ста-
Различия между прорастанием конидий A. tenuissima К22 и G. pannorum ВКМ F-4777D в разных вариантах эксперимента
|
Вариант защитной среды |
Различие |
Статистическая значимость различий |
||
|
раз |
процентных пунктов |
p двустороннее |
p одностороннее |
|
|
Контроль без лиопротекторов |
1,08 |
6,1 |
0,1320 |
0,0691 |
|
Среда Файбича |
1,25 |
18,9 |
< 0,0001 |
< 0,0001 |
|
Среда Файбича с аскорбиновой кислотой |
6,16 |
37,2 |
< 0,0001 |
< 0,0001 |
|
Пептон-сахарозо-глицериновая среда |
1,14 |
11,0 |
0,0005 |
0,0003 |
Таким образом, A. tenuissima К22 и G. Pannorum ВКМ F-4777D при лиофилизации продемонстрировали хорошую выживаемость конидий, которая даже без использования защитных сред сохраняется на уровне, вполне достаточном для практического использования лиофилизированных культур при хранении этих штаммов.
Заключение
-
1. Оба изученных штамма демонстрируют высокую (75,9 % у A. tenuissima К22 и 82,0 % у G. pannorum ВКМ F-4777D) жизнеспособность конидий после лиофилизации без использования защитных сред.
-
2. Защитные среды не оказывают статистически значимого влияния на выживаемость конидий A. tenuissima К22 и статистически значимо повышают выживаемость конидий G. Pannorum ВКМ F-4777D (в 1,16 раза при использовании среды Файбича и в 1,07 раза при использовании пептон-сахарозо-глицериновой среды).
-
3. Введение в среду Файбича аскорбиновой кислоты в качестве антиоксиданта ведет к значительному снижению доли выживших при лиофилизации конидий (в 10,61 раза у A. tenuissima К22 и в 2,15 раза у G. pannorum ВКМ F-4777D).
-
4. На основе полученных результатов можно рекомендовать проведение лиофилизации конидий A. tenuissima К22 без использования защитных сред, а лиофилизацию конидий G. Pannorum ВКМ F-4777D – с использованием защитной среды Файбича либо без использования
Список литературы Устойчивость потенциальных продуцентов амилазы Alternaria tenuissima и Geomyces pannorum к лиофилизации
- De Souza P.M. Application of microbial α-amy-lase in industry – A review // Brazilian Journal of Microbiology. 2010. № 4. P. 850–861.
- Effects of dietary amylase and sucrose on pro-ductivity of cows fed low-starch diets / C.F. Vargas-Rodriguez [et al.] // J. Dairy Sci. 2014. 97(7). P. 4464–4470.
- Cowieson A.J., Vieira S.L., Stefanello C. Exo-genous microbial amylase in the diets of poultry: what do we know? // J. Appl. Poult. Res. 2019. 28 (3). P. 556–565.
- Shafique S., Bajwa R., Shafique S. Alpha-amylase production by toxigenic fungi // Natural Product Research. 2010. 24(15). P. 1449–1456.
- Abd A.A., Mostafa, F. Production and Charac-terization of Fungal α-Amylase from Marine Alternata Utilizing Lignocellulosic Wastes and Its Application // Res. J. Pharm., Biol. Chem. Sci. 2015. 6. P. 813–825.
- Production of Glucoamylase from Novel Strain of Alternaria Alternata under Solid State Fermentation / D.E. Nayab [et al.] // BioMed Re-search International. 2022. P. 9. DOI: 10.1155/ 2022/2943790.
- Хижняк С.В., Пампуха В.Т. Микробные сообщества карстовых пещер как потенциальный источник продуцентов низкотемпературных амилаз // Вестник Омского государственного аграрного университета. 2016. № 1 (21). С. 104–110.
- Влияние температуры на скорость роста амилолитических штаммов Geomyces pannorum / С.В. Хижняк [и др.] // Вестник КрасГАУ. 2018. № 1 (136). С. 214–221.
- Adams J. The principles of freeze-drying // Methods Mol. Biol. 2007. Vol. 368. P. 15–38. DOI: 10.1007/978-1-59745-362-2_2.
- Stacey J.N., Day J. Long-term ex-situ conservation of biological resources and the role of biological resource centers // Methods Mol. Biol. 2007. Vol. 368. P. 1–14. DOI: 10.1007/ 978-1-59745-362-2_1.
- Грачева И.В., Осин А.В. Механизмы повреждений бактерий при лиофилизации и протективное действие защитных сред // Проблемы особо опасных инфекций. 2016. № 3. С. 5–12. DOI: 10.21055/0370-1069-2016-3-5-12.
- Пат. RU 2736223 C1. Психротолерантный штамм мицелиального гриба Geomyces pannorum ВКМ F-4777D – продуцент α-амилазы / С.В. Хижняк [и др.]; патентообладатель Красноярский ГАУ. № 2018137887. Заявл. 26.10.2018, опубл. 12.11.2020, Бюл. № 32.
- Impact of the fermentation parameters pH and temperature on stress resilience of Lactobacil-lus reuteri DSM 17938 / A. Hernandez [et al.] // AMB Expr. 2019. Vol. 9. № 66. DOI: 10.1186/ s13568-019-0789-2.
- Optimization of protective agents for the freeze-drying of Paenibacillus polymyxa Kp10 as a potential biofungicide / H.S. Nasran [et al.] // Molecules. 2020. № Vol. 25. № 11. DOI: 10.3390/molecules25112618.
- Файбич М.М. Стабилизация вакцинных препаратов в процессе высушивания и хранения // Журнал микробиологии, эпидемиологии и иммунологии. 1968. № 2. С. 59–66.
- Стандартная операционная процедура по лиофилизации культур ВКМ с использованием разных режимов первичной и вторичной сушки / сост. С.М. Озерская, Е.О. Пучков, Н.Е. Иванушкина. Пущино, 2011.
- Охапкина В.Ю. Методы поддержания микробных культур. Ч. 2. Лиофилизация // Теоретическая и прикладная экология. 2009. № 4. С. 21–32.


