Визуальная диагностика некоторых видов рептилий
Автор: Маркова М.В., Копылович М.В., Мелоненко М.В.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринарные науки
Статья в выпуске: 3 (31), 2018 года.
Бесплатный доступ
Представлены результаты исследования авторов по выявлению особенностей проведения методов визуальной диагностики некоторых видов рептилий, а именно красноухой черепахи, змей и ящериц. При ее проведении используются специфические методы фиксации рептилий c определенным алгоритмом и анализом полученных исследований. Методом рентгенографии у рептилий диагностируют патологии скелета, паренхиматозных органов, крупных сосудов и органов репродуктивной системы самок. Для выявления патологии печени и почек змей показано ультразвуковое исследование. Информативен этот метод и для изучения органов репродуктивной системы самок рептилий, как для наблюдения за активностью яичников и созревания яиц, так и для диагностики патологических состояний. Ультразвуковое исследование черепах имеет особенности, обусловленные выбором точек для установки датчиков сканера и ограничения по размерам животного. Плотные чешуйки рептилий могут помешать ультразвуковой диагностике, авторами описан способ подготовки рептилий к проведению этой процедуры, позволяющий минимизировать помехи от плотных структур наружного покрова...
Рептилии, ультразвуковая диагностика, рентгенография, магнитно-резонансная и компьютерная томография
Короткий адрес: https://sciup.org/142216231
IDR: 142216231 | УДК: 619:616-071:598.1
Текст научной статьи Визуальная диагностика некоторых видов рептилий
сурс]. – URL:
Рептилии - редкие пациенты в практике ветеринарных клиник, их болезни трудно диагностировать даже опытному ветеринарному врачу [1; 2; 3]. У них могут наблюдаться неспецифические симптомы или даже их отсутствие, обусловленные их анатомо-физиологическими особенностями. При их осмотре не всегда удается поставить точный диагноз. Благодаря визуальной диагностике врач имеет возможность точно и объективно оценить состояние органов сердечно-сосудистой, опорно-двигательной, дыхательной и других систем [4; 5].
В отечественной литературе сегодня немногочисленные и фрагментарные сведения, касающиеся проведения и интерпретации методов визуальной диагностики этих видов животных [2; 4]. Описания по проведению и интерпретации исследований некоторых видов рептилий встречаются в иностранных источниках [6; 7; 8; 9; 11; 12].
В связи с этим была определена цель исследования: выявить особенности проведения методов визуальной диагностики некоторых видов рептилий (красноухая черепаха, змеи, ящерицы).
Задачи исследования:
-
1. Выявить особенности подготовки, проведения и возможности визуальной диагностики некоторых видов рептилий (красноухая черепаха, змеи, ящерицы)
-
2. Оценить преимущества и недостатки различных методов визуальной диагностики рептилий, используя литературные данные и материалы собственных исследований.
Материалы и методы
Работа выполнена на базе ветеринарной клиники «24 часа, Крымский ветеринарный центр», г. Симферополь, Республика Крым и университетской ветеринарной клиники ФГБОУ ВО Омский ГАУ, г. Омск. Материалом для исследований служили пациенты клиник: красноухие черепахи (n = 10); змеи - питон (n = 2), удав (n = 1); ящерицы -агама (n = 2). Использованы цифровой и аналоговый рентгеновские аппараты «Examion Static Classic», «РУМ-20»», ультразвуковые сканеры «Раскан» и «Honda Electronics» с линейным и микроконвексными датчиками, компьютерный томограф «Siemens».
Результаты и их обсуждение
Рентгенография рептилий. В зависимости от цели исследования змеи могут быть уложены разными способами. Для детальной рентгенографии их укладывали в длинную акриловую трубку и располагали на панели аппарата. Снимки проводили последовательно по всей длине тела. Если задача состояла в подтверждении наличия инородных тел, змею укладывали в ее естественном положении.
По данным авторов, из патологий органов сердечно-сосудистой и дыхательной систем у змей при помощи рентгенографии возможно также выявление минерализации крупных сосудов вблизи сердца, пневмонии, новообразований легких. Яйца яйцекладущих змей (питонов) из-за низкой кальцификации скорлупы просматриваются нечетко, а у яйцеживородящих (удавов) возможна визуализация минерализующихся скелетов плодов внутри яйца к концу беременности [9].
Ящериц при рентгенографии помещали в закрытый пластиковый пакет с отверстием для вентиляции. У мелких рептилий диагностировали патологии скелета, такие как переломы, вывихи пальцев и ребер, истончение кортикального слоя костей при вторичном гиперпаратиреозе. Оценка органов пищеварительной системы была затруднена из-за растяжения кишки значительным количеством газа, однако хорошо определялись рентгеноконтрастные инородные тела.
Также рентгенография использовалась для диагностики постовуляторной дистоции и фолликулярного стаза ящериц. В норме яйца примерно равны по величине, округлые с очень тонкой оболочкой, при дистоции - неодинакового размера, оболочка значительно утолщена. При фолликулярном стазе скопления фолликулов имеют гроздевидную форму, неоднородные с рентгенонегативными включениями.
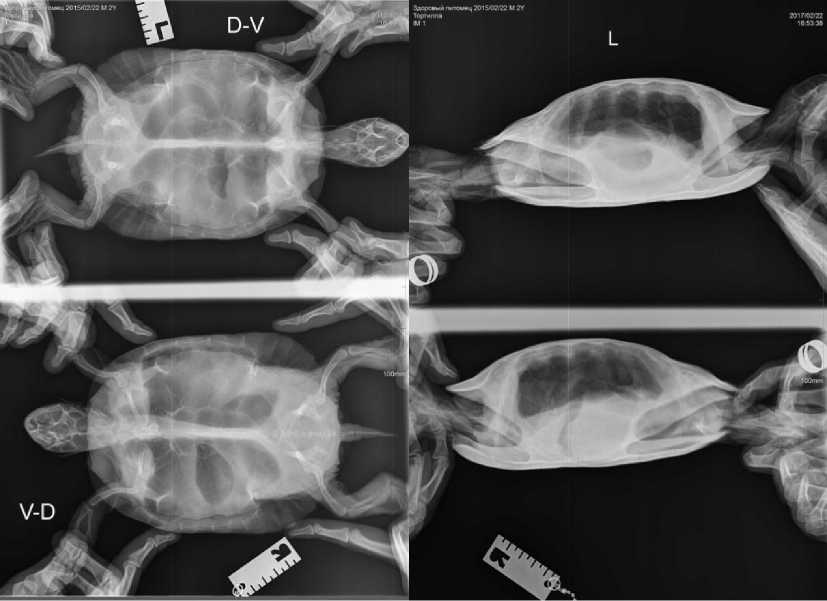
Черепах при рентгенологическом исследовании прикрепляли лентой или укладывали на небольшую коробку, чтобы они не могли касаться конечностями панели аппарата. Голову вытаскивали из-под панциря и фиксировали при помощи большого и указательного пальцев левой руки, которые вводили глубоко между передними лапами. Обычно черепахи используют передние конечности, чтобы плотно прикрыть снаружи втянутую голову. В этом случае каждую лапу вытягивали из-под панциря и фиксировали средними пальцами обеих рук к костному соединению между карапаксом и пластроном с каждой стороны. Данная техника позволяла получить высококачественный рентгенологический снимок головы. Лучшей проекцией является дорсовентральное положение, кроме того, при исследовании проводили горизонтальный снимок (как боковой, так и краниокаудальный) (рис. 1). Рептилию укладывали на панель аппарата и зажимали между двумя пенопластовыми блоками. Наиболее часто у красноухих черепах регистрировали пневмонию: очаговое или диффузое одно- или двустороннее повышение рентгеноплотности легких. Из патологий пищеварительной системы чаще всего диагностировали избыточное скопление газа в кишечнике - тимпанию, на рентгенограммах она проявлялась значительным увеличением объема кишечника, печень на снимках не визуализировалась.
Ультразвуковое исследование рептилий проводили при мануальной фиксации. Рептилий визуализировали как в дорсальном, так и стернальном положении. При стернальном змей укладывали на платформу с прорезью, чтобы интересующая область тела находилась над прорезью. У рептилий плотные чешуйки могут мешать визуальной диагностике, в основном самые толстые из них расположены вентрально, поэтому датчик располагали латерально. Также затрудняли ультразвуковую диагностику скелетные структуры, в частности, ребра, воздух в легких, газ в кишечнике.
А Б
Рис. 1. Рентгеновские снимки, отражающие состояние скелета и внутренних органов красноухой черепахи в норме: А - прямая проекция; Б - боковая проекция
У черепах для ультразвукового исследования использовали ультразвуковые окна -шейно-плечевые, подмышечные и паховые впадины. При этом возникало ограничение по размерам животного, а именно - представлялось возможным провести ультразвуковое исследование черепах, только если рабочая поверхность датчика помещалась в названные участки.
Рептилий небольших размеров исследовали датчиками с частотой 7,5 или 10 МГц. Для крупных рептилий - датчик с частотой 5 МГц. Для удаления воздуха между поверхностью тела рептилий и датчиком использовали акустический гель. При исследовании ящериц и змей использовали акустический гель низкой вязкости, далее выдерживали 2–3 мин до начала процедуры. Это позволяло устранить воздух, находящийся между чешуйками и мешающий исследованию.
В норме печень змей визуализировали каудально от сердца в срединной плоскости как гипоэхогенную однородную структуру с содержащимися в ней анэхогенными сосудами и анэхогенной округлой каудально смещенной относительно края печени структурой - желчным пузырем. Увеличение печени диагностировали по закруглению ее краев и смещению каудального контура. Печень черепах и ящериц также определялась вблизи сердца. Жировые тела отличали от печени по более низкой эхогенности и грубозернистой эхоструктуре. Наиболее частая патология печени изученных животных, по данным ультразвукового исследования, - липидоз, паренхима печени имела повы- шенную эхогенность и сглаженную эхоструктуру. Визуализировали селезенку змей в виде образования округлой формы вблизи желчного пузыря, по эхогенности она превышала паренхиму печени. Почки черепах и ящериц были труднодоступны для исследования. Правая почка змей визуализировалась краниально от левой. Почки змей имели вид гипоэхогенных зернистых образований вытянутой формы, дифференциация корковой и мозговой зон не прослеживалась.
Особенно информативно ультразвуковое исследование для изучения репродуктивной системы самок рептилий. Возможен мониторинг активности яичников, а также определение присутствия яиц внутри репродуктивного тракта (рис. 2). При подозрении на желточный целомит проводили ультразвуковое исследование с целью обнаружения свободной жидкости в целоме.
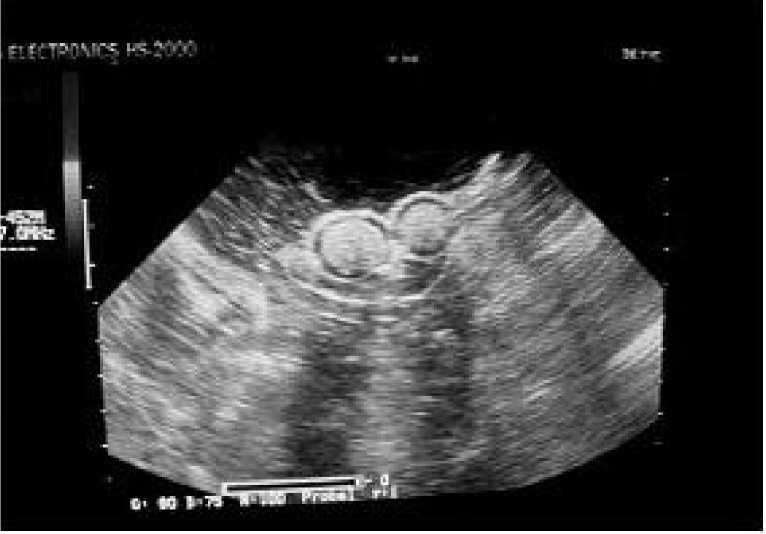
Рис. 2 . Ультразвуковое исследование репродуктивной системы красноухой черепахи.
Визуализируются яйца в дистальном отделе яйцепровода в виде гиперэхогенных округлых образований с двойным ободком, дистально от них видны артефакты эхоакустической тени
Компьютерная и магнитно-резонансная томография рептилий. При этих методах исследования хорошо визуализируются внутренние органы рептилий без помех от чешуек. Компьютерная томография используется для визуализации скелетных структур и дыхательных путей, а при магнитно-резонансной хорошо детализируются мягкие ткани и внутреннее строение. В отличие от больших площадей визуализации при рентгенографии, компьютерная и магнитно-резонансная томография обеспечивают тонкие срезы, по ним удобнее оценивать органы или нарушения [11; 12]. Однако интерпретация результатов при компьютерной и магнитно-резонансной томографии у рептилий затруднена из-за отсутствия детальных описаний изображений.
Компьютерную томографию использовали для уточнения диагноза при подозрении на заболевания легких у змей, так как рентгенография иногда не позволяет выявлять пневмонию на ранней стадии.
При проведении компьютерной и магнитно-резонансной томографии важно, чтобы рептилия была неподвижна достаточно долго, поэтому необходимы обездвиживающие приспособления или седативные препараты. Основной сложностью для анестезии является относительно медленный обмен веществ рептилий в сравнении с млекопитающими. Увеличивается период индукции препаратов при любом способе введения значительно, бывает до нескольких суток, удлиняется время остаточного действия. Дозы, необходимые для достижения надежной седации, близки к токсическим. По литературным данным, доза кетамина, необходимая для надежного хирургического наркоза черепахи, – 100 мг/кг, а эта доза уже вызывает необратимую остановку дыхания [8; 9]. Особенностью рептилий является и то, что с увеличением размера доза действующего вещества на килограмм живой массы не уменьшается, а несколько возрастает. Из диссоциативных препаратов наиболее популярен кетамин, применяемый для вводного и базисного мононаркоза или в комбинации с ксилазином и медетомидином. Дозы кетамина для змей – 30–60 мг/кг, для ящериц – 40–60 мг/кг, для крокодилов – 10–70 мг/кг, для черепах – 50–100 мг/кг, для осмотра и диагностической визуализации бывает достаточно введения 35 мг/кг. Кетамин обеспечивает миорелаксацию, в отличие от теплокровных животных, у рептилий отсутствует анальгетический эффект [8; 9].
В последнее время для наркоза рептилий используется пропофол (Diprivan, Rapidovet), вводимый внутривенно или внутрикостно [12]. Короткий латентный период, легкая управляемость и быстрый выход из наркоза – привлекательные стороны этого препарата при диагностической визуализации рептилий.
При проведении компьютерной томографии для анестезии нами был использован золетил (10 мг/кг внутримышечно) и пропофол (5 мг/кг внутривенно). Расчет дозы препаратов осуществлялся строго с учетом веса и размера животного. Перед инъекциями кожу спиртовым раствором не обрабатывали, так как это может вызвать ожог. Если кожа была загрязнена, ее промывали водой. После введения препарата сухим ватным тампоном надавливали на место инъекции и осуществляли массирующие движения (длительность – около одной минуты). Важно контролировать выход из наркоза и регулировать обмен веществ. Это возможно осуществить, поддерживая температуру террариума или любого другого помещения на уровне 28, 30С° в течение 2–3 сут.
Заключение
При проведении визуальной диагностики рептилий для каждого метода используются специфические способы фиксации, определенный алгоритм и анализ полученных исследований. У каждого из методов свои диагностические возможности.
Рентгенография рептилий позволяет диагностировать патологии скелета, паренхиматозных органов, крупных сосудов и органов репродуктивной системы. У мелких рептилий рентгенография затруднена из-за небольших размеров структур и малой контрастности внутренних органов, обусловленной их анатомическими особенностями.
Ультразвуковая диагностика применима для выявления патологий печени и почек змей. Особенно информативен этот метод для изучения органов репродуктивной системы самок рептилий. Возможен как мониторинг активности яичников и определение присутствия яиц внутри репродуктивного тракта, так и диагностика патологических состояний. Однако у этотого вида исследования свои особенности точек установки датчиков и ограничения по размерам животного, в первую очередь это касается черепах. Осложняют проведение ультразвуковой диагностики рептилий плотные чешуйки наружного покрова, газосодержащие и скелетные структуры.
При компьютерной и магнитно-резонансной томографии получают тонкие срезы, позволяющие детальную оценку состояния органов, без помех от плотных образований наружного покрова рептилий. В то же время, отметим, что интерпретация результатов при компьютерной и магнитно-резонансной томографии этих животных затруднена из-за отсутствия детальных описаний изображений. Недостатком также является обязательная седация животного; дозы, необходимые для достижения надежной седации рептилий, близки к токсическим.
M.V. Markova, M.V. Kopylovich, M.V. Melonenko
Omsk State Agrarian University named after P.A. Stolypin, Omsk
Diagnostic imaging in Reptiles
Список литературы Визуальная диагностика некоторых видов рептилий
- Дитмар Я. Рептилии. Болезни и лечение/Я. Дитмар, Ю. Ланде; пер. И. Кравец. -М.: Аквариум-Принт, 2015. -240 с.
- Чегодаев А.Е. Аквариумные и террариумные черепахи. Обзор видов. Содержание. Разведение. Болезни и лечение/А.Е. Чегодаев. -М.: Аквариум-Принт, 2012. -208 с.
- Райнер П. Красноухие черепахи. Содержание и уход/П. Райнер. -М.: Аквариум-Принт, 2012. -240 с.
- Справочник по болезням домашних и экзотических животных/С.С. Липницкий . -3-е изд., перераб. и доп. -Ростов н/Д: Феникс, 2002. -448 с.
- Бонагура Дж.Д. Современный курс ветеринарной медицины/Дж.Д. Бонагура, Р.У. Кирк; пер. с англ. Л.И. Евелева, Е.И. Логинова, Е.Б. Махиянова. -М.: Аквариум-Принт, 2014. -1384 с.
- Sainsbury A.W. Ultrasonographic anatomy and scanning technique of the coelomic organs of the Bosc Monitor (Varanus exanthematicus)/A.W. Sainsbury, C. Gili//J Zoo Wildl Med. 1991; 22: 421-433.
- Schildge B.J. Ultraschalluntersuchung bei Reptilien (Ultrasonography in reptiles)/B.J. Schildge, H. Tenhu, M. Kramer//Berl Muench Tierarztl Wochenschr. -1996. -Р. 136-141.
- Hernandez-Divers S. Hernandez-Divers S.H. Diagnostic imaging of reptiles. In Practice, July/August 2001. -Р. 370-390.
- Silverman S. Diagnostic imaging in Reptile/S. Silverman, D.R. Mader//Medicine and Surgery, 2nd Edition. Saunders Elsevier, St Louis (MI) 2006. -Р. 471-489.
- Юдина Н.А. Бородатая агама/Н.А. Юдина. -Екатеринбург: Биопрактика, 2010. -142 с.
- A review of diagnostic imaging of snakes and lizards/T. Banzato //Veterinary Record. -2013. -173 -P. 43-49.
- Wyneken J. Computed tomography and magnetic resonance imaging anatomy of reptiles/J. Wyneken//In: Douglas R. Mader. Reptile Medicine and Surgery, 2006. -Elsevier Inc. -Р. 1088-1096.


