Влияние бета-лактамных антибиотиков на патологию митоза в Allium тесте
Автор: Концевая Ирина Ильинична, Минина Анастасия Викторовна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 3 т.8, 2022 года.
Бесплатный доступ
Исследуется влияние бета-лактамных антибиотиков (цефотаксима и аугментина) на патологию митоза в Allium тесте в первой метафазе после обработки и после завершения восстановительного периода. Методы исследования: Allium тест, цитогенетический анализ, статистический анализ. Опыт был выполнен на партии лука обыкновенного (сорт Штуттгартен), который характеризовался как генетически нестабильный по итогам микроядерного теста. Результаты тестирования на генотоксичность показали отсутствие существенного негативного влияния цефотаксима (концентрация 500,0 мг/л) независимо от времени его действия (на протяжении 1-го или 2-3 клеточных циклов) на значение показателя «патология митоза» (ПМ) по сравнению с контролем. Повышение роста патологических процессов отмечали при тестировании аугментина в концентрации 800,0 мг/л. При действии аугментина доля клеток с микроядрами увеличилась с 0,3% (в контроле) до 2,3% (в опыте), также по сравнению с контролем увеличилось значение патологии митоза с 6,1% в контроле до 10,1-16,0% в опыте, существенно возросло число клеток с мостами и к-митозом. Колхициновый митоз отмечали в вариантах «период восстановления» после аугментина (концентрация 800,0 мг/л, экспозиция - 48 ч) и после цефотаксима (концентрация 500,0 мг/л, эспозиция - 48 ч), в первом случае как типичный к-митоз у 20% клеток с ПМ, во втором случае - как рассеивание хромосом в метафазе и анафазе у 30% клеток с ПМ. В варианте применения аугментина в первой метафазе клеточного цикла после обработки выявлено слипание хромосом (12%) и мосты хромосомные и хроматидные (35%). Полученные данные свидетельствуют, что аугментин в концентрации 800,0 мг/л (экспозиция 48 ч) проявляет по сравнению с контролем генотоксичность и способен изменять скорость вступления клеток лука обыкновенного в митоз и нормальное протекание процессов деления. Восстановительный период для данного антибиотика не снижает количество клеток с патологией митоза, но изменяет их состав и спектр.
Allium тест, бета-лактамные антибиотики, патология митоза
Короткий адрес: https://sciup.org/14123425
IDR: 14123425 | УДК: 577.18-049.8:575.224
Текст научной статьи Влияние бета-лактамных антибиотиков на патологию митоза в Allium тесте
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.18-049.8:575.224
Хотя антибиотики и характеризуются высокой избирательностью действия, тем не менее, они оказывают целый ряд неблагоприятных влияний на макроорганизм. По каждому антибиотику указано их неблагоприятное влияние на органы и системы органов, в частности, человека [1]. Одной из самой многочисленной групп среди антимикробных средств, занимающей ведущее место в лечении большинства инфекционных заболеваний [2, 3], являются β-лактамные антибиотики.
Механизм антибиотической активности бета-лактамов связан с теми ферментами-мишенями, которые не имеют аналогов в эукариотической клетке. В ней нет ни жесткой клеточной стенки, ни пептидогликана, ни, соответственно, ферментов его синтеза [4]. Таким образом, поскольку пептидогликана нет в стенках эукариотических организмов, то антибиотики данной группы обладают очень низкой токсичностью для макроорганизма, и их можно применять в высоких дозах (мегатерапия) [5].
Цель работы : изучить генотоксичность бета-лактамных антибиотиков (цефотаксима и аугментина) в клетках образовательной ткани корней Allium cepa L. в первой метафазе после обработки и после завершения восстановительного периода [6].
Материал и методы исследований
Исследование ответных реакций растений лука обыкновенного в условиях действия водных растворов антибиотиков выполняли с помощью Allium теста [7] на сорте Штуттгартен. В качестве негативного контроля использовали дистиллированную воду.
Тестировали следующие антибиотики: цефотаксим (РУП «Борисовский завод медицинских препаратов», Беларусь) в концентрации 500,0 мг/л; аугментин («СмитКляйн Бичем Фармасьютикалз», Великобритания) — 800,0 мг/л. Время обработки антибиотиками составило 24 и 48 часов. Клеточный цикл в меристематических клетках корешков лука обыкновенного составляет, по разным данным, примерно 14–20 часов [8, 9]. С одной стороны, известно, что наибольшей чувствительностью к действию большинства химических веществ обладает интерфаза [6]; с другой стороны, для образовательной ткани характерна асинхронность клеточного цикла. По этой причине в эксперименте дополнительно выдерживали период восстановления [6] длительностью 24 часа, в течение которого тестируемое вещество не воздействует (вариант последействия (=восстановительный период)), и только затем выполняли фиксацию корешков. Во всех вариантах опыта фиксация производилась с 6.00 до 7.00 утра.
Давленые препараты для цитогенетического анализа, окрашенные ацетогематоксилином, изготавливали по общепринятой методике [10]. Просмотр препаратов осуществляли на компьютеризированной кариологической станции, оснащенной микроскопом Leica DMR при увеличении 40×10×1,5. Цитогенетический анализ выполняли по [10, 11].
Статистическую обработку результатов исследований проводили с помощью пакета прикладного программного обеспечения Microsoft Excel и Statsoft (USA) Statistica v.7.0. Для данных, подчиняющихся нормальному закону распределения, использовали t-критерий Стьюдента. Нулевую гипотезу отклоняли при уровне статистической значимости p<0,05 [12].
Результаты исследований
Следует отметить, что, согласно микроядерному тесту, тестируемая партия лука обыкновенного характеризуется генетической нестабильностью. При анализе данных, полученных в результате микроядерного теста (Рисунок 1, 2), наблюдали наличие микроядер в контрольном варианте, число клеток с микроядрами достигало 0,3%. При этом из наблюдений следует, что основным механизмом формирования микроядер являются протрузии и ядерные почки интерфазных ядер (Рисунок 1а, 1б).
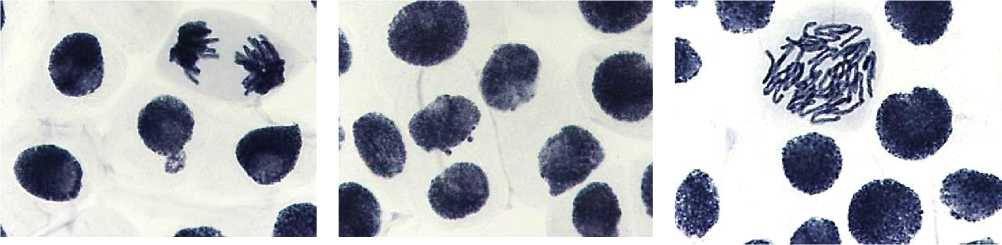
а б в
Рисунок 1. Типы патологий митоза в негативном контроле (увеличение микроскопа 400×): а, б — интерфазное ядро с ядерными почками; в — рассеивание хромосом
2,50
2,00
1,50
1,00
0,50
0,00
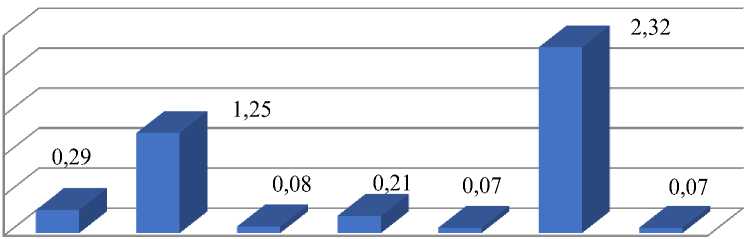
варианты опыта
Рисунок 2. Влияние бета-лактамных антибиотиков на процент клеток с микроядрами. Варианты опыта: 2 — вода дистиллированная; 2 — цефотаксим; 500,0 мг/л — 24 часа; 3 — восстановительный период варианта 2, 4 — цефотаксим, 500,0 мг/л — 48 ч; 5 — восстановительный период варианта 4, 6 — аугментин, 800,0 мг/л — 48; 7 — восстановительный период варианта 6
В 4 раза увеличилось число клеток с микроядрами в варианте применения цефотаксима, 500,0 мг/л (экспозиция 24 час) и в 7 раз — в варианте применения аугментина, 800,0 мг/л в течение 48 час. Однако следует подчеркнуть, что после восстановительного периода у вышеуказанных вариантах применения антибиотиков число микроядер существенно уменьшается до 0,07–0,08%. В остальных вариантах были отмечены единичные клетки с микроядрами. Необходимо подчеркнуть, что микроядра имели очень маленький размер.
Наблюдали при действии бета-лактамных антибиотиков существенное возрастание значений патологии митоза (ПМ), с 6,1% — в контроле до 9,2 и 15,1%, соответственно, при использовании аугментина в концентрации 800,0 мг/л на протяжении 48 часов и в восстановительном его периоде (Рисунок 3, вариант 6 и 7).
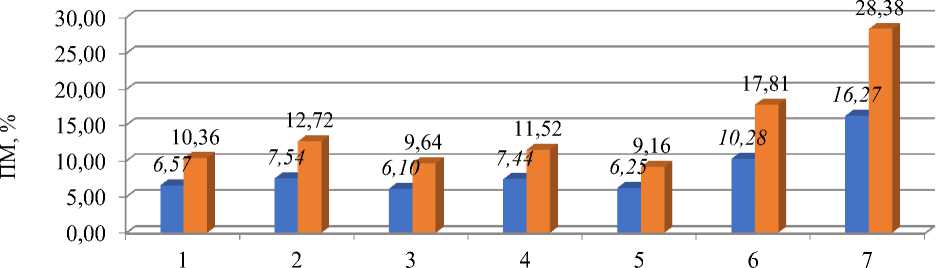
варианты опыта
■ ПМ с учетом профазы ■ ПМ без учета профазы
Рисунок 3. Влияние бета-лактамных антибиотиков на патологию митоза. Обозначения вариантов – те же, что для Рисунка 2
В остальных опытных вариантах изменения значений патологии митоза несущественны по отношению к контролю. В контрольном варианте среди типов патологии митоза преобладают забегание/отставание хромосом и асинхронное веретено деления (Рисунок 4). Необходимо подчеркнуть, что данные типы патологий типичны для физиологических условий.
Не отмечали существенных изменений по составу и спектру патологий митоза в вариантах действия цефотаксима в концентрации 500,0 мг/л в течение 24 час и 48 час, а также в варианте его последействия при меньшей экспозиции. В варианте 5 (последействие цефотаксима в течение 48 час) наблюдали увеличение в 4–8 раз клеток с такими патологиями как выбросы хромосом за веретено деления до 9,1%, рассеивание хромосом до 28,3 % по сравнению с вариантом 4 (Рисунок 4).
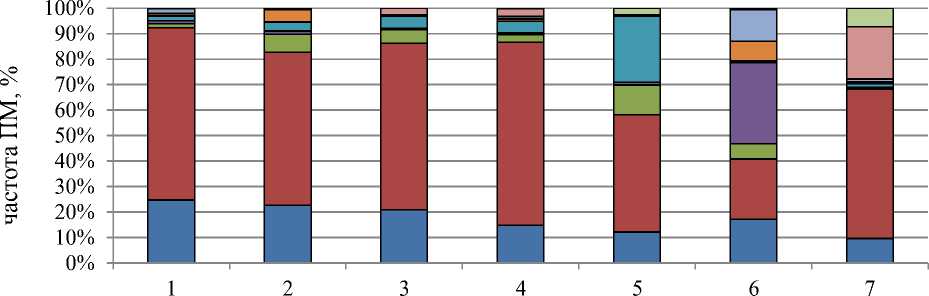
варианты опыта
-
□ Ас Вер
-
□ з/отст хр □ выбр хр □ мосты
-
□ рассеив
-
□ фрагмент о слипание □ к-митоз
-
□ разное
Рисунок 4. Влияние
бета-лактамных
антибиотиков
на состав и спектр патологии митоза.
Обозначения вариантов те же, что для Рисунка 2
Также существенные изменения по типам патологий митоза и их количественному участию выявлены в вариантах применения аугментина. При действии данного антибиотика отмечены ранее не встречаемые в других опытных вариантах патологии митоза: мосты (как одиночные, так и множественные) в 30,3%, фрагменты — в 3,1%, слипание хромосом — в 13,0%. Согласно Алову [11], набухание и склеивание хромосом относится как к группе «патологии митоза, связанные с повреждением хромосом», так и к группе «патологии митоза, связанные с повреждением митотического аппарата». В первом случае исходом является часто гибель клеток. Во втором случае исход шире: помимо гибели клеток, возможно формирование немногочисленных микроядер в клетке, возможно восстановление митотического аппарата и нормальное завершение митоза, также могут образовываться полиплоидные ядра. В нашем опыте косвенно о последнем исходе свидетельствует наличие одиночных ядер большого размера и напрямую указывает наличие полиплоидных метафазных клеток в варианте последействия. В варианте последействия аугментина (вариант 7) по сравнению с вариантом его действия (вариант 6) наблюдали к-митоз в 21,3% случаев, а также отмечали в 3,2% случаев полиплоидные клетки.
Наиболее часто встречаемые типы патологий митоза при действии бета-лактамных антибиотиков показаны на Рисунке 5. На слайдах с патологией наблюдали рассеивание хромосом в метафазе и более часто — в анафазе, мосты одиночные и двойные, асинхронное веретено деления. Рассеивание хромосом в метафазе и анафазе косвенно свидетельствует о возможной полиплоидизации ядер. Наблюдали напрямую полиплоидные клетки (в варианте
«цефотаксим, 500,0 мг/л» — при экспозиции 24 часа» (Рисунок 5, 1б) и 48 часов (Рисунок 5, 2а).
Регистрировали маленького размера микроядра, которые формировались в результате отпочковывания ядерных почек у интерфазных клеток (Рисунок 5, 1а, 2б, 4в).
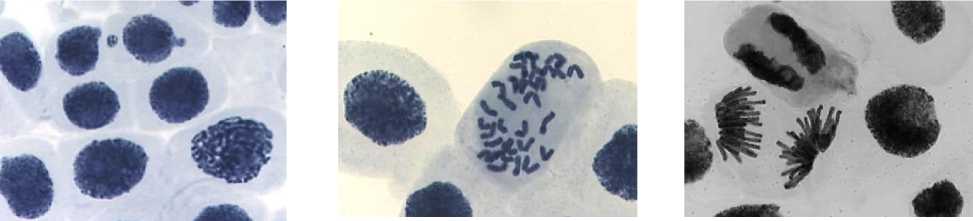
а б в
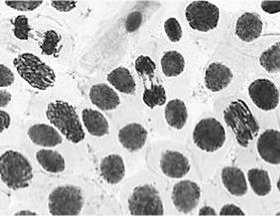
1) цефотаксим, 500,0 мг/л, 24 ч: а – ядерные почки и микроядра; б – к-метафаза, полиплоид; в –
асинхронное веретено деления, пикноз клетки
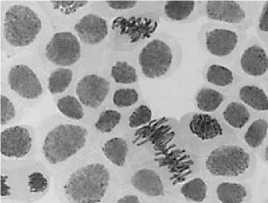
а
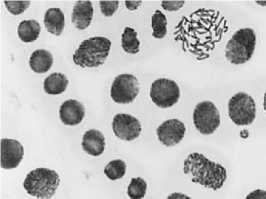
б
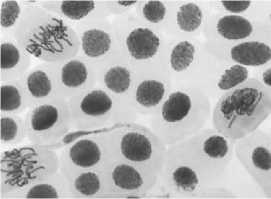
в
-
2) цефотаксим, 500,0 мг/л — 48 ч: а — полиплоидная клетка; б — к-анафаза, микроядра; в — выброс хромосом за веретено деления
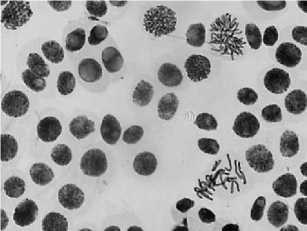
а
б
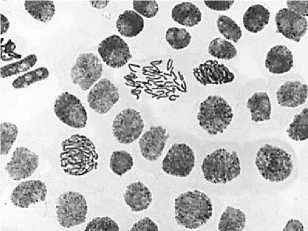
-
3) последействие цефотаксим, 500,0 мг/л, 48 ч: а — выброс хромосом за веретено деления; б — к-анафаза
а
б
в
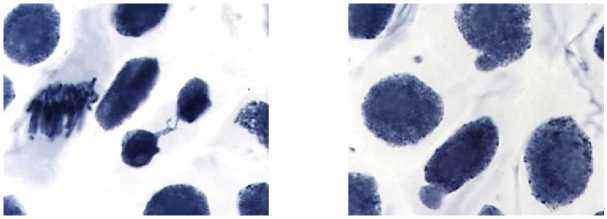
-
4) аугментин, 800,0 мг/л, 48 ч: а — мосты; б — ядерный мост; в — ядерные почки
Рисунок 5. Типы патологий митоза при действии бета-лактамных антибиотиков (увеличение микроскопа 400х, 100х)
Заключение
Таким образом, опыт был выполнен на партии лука обыкновенного сорта Штуттгартен, который характеризовался как генетически нестабильный по итогам микроядерного теста. Результаты тестирования на генотоксичность показали отсутствие существенного негативного влияния цефотаксима (концентрация 500,0 мг/л) независимо от времени его действия (на протяжении 1 или 2–3-х клеточных циклов) на значение показателя «патология митоза» по сравнению с контролем.
Повышение роста патологических процессов отмечали при тестировании аугментина в концентрации 800,0 мг/л. При действии аугментина процент клеток с микроядрами увеличился с 0,3% (в контроле) до 2,3% (в опыте), также по сравнению с контролем увеличилось значение патологии митоза с 6,1% в контроле до 10,1–16,0% в опыте, существенно возросло число клеток с мостами и к-митозом.
Колхициновый митоз отмечали в вариантах «период восстановления» после аугментина (концентрация 800,0 мг/л, экспозиция — 48 часов) и после цефотаксима (концентрация 500,0 мг/л, экспозиция — 48 часов), в первом случае как типичный к-митоз у 20% клеток с ПМ, во втором случае — как рассеивание хромосом в метафазе и анафазе у 30% клеток с ПМ. В варианте применения аугментина в первой метафазе клеточного цикла после обработки выявлено слипание хромосом (12%) и мосты хромосомные и хроматидные (35%).
Исход к-митоза зависит от дозы и времени воздействия статмокинетического яда на делящуюся клетку. Присутствие к-метафаз в клетках образовательной ткани приводит к ингибированию прогрессии клеточного цикла, во-первых, в результате потери времени на восстановление митотического аппарата, во-вторых, по причине изменения плоидности клеток (мозаичности образовательной ткани) и, в-третьих, из-за индукции микроядер.
Полученные данные свидетельствуют, что аугментин в концентрации 800,0 мг/л (экспозиция 48 час) проявляет по сравнению с контролем генотоксичность и способен изменять скорость вступления клеток лука обыкновенного в митоз и нормальное протекание процессов деления. Восстановительный период для данного антибиотика не снижает количество клеток с патологией митоза, но изменяет их состав и спектр.


