Влияние бронхолегочной патологии на общую выживаемость пациентов с множественной миеломой
Автор: Михайлов Е. С., Осипов Ю. С., Салогуб Г. Н., Чечеткин А. В., Бессмельцев С. С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.15, 2019 года.
Бесплатный доступ
Предполагается, что риск развития инфекционных осложнений у пациентов смножественной миеломой (ММ) в сочетании с бронхолегочной патологией (БЛП) повышен, но результаты лечения в этой группе изучены недостаточно. Для оценки влияния БЛП на исход у больных ММ проанализированы данные 156 пациентов с впервые выявленным заболеванием. Все пациенты были разделены на 2 группы в зависимости от наличия/отсутствия БЛП. Клинически значимыми считались заболевания дыхательной системы, требующие медикаментозной терапии или амбулаторного наблюдения. Медиана общей выживаемости (ОВ) составила 43 месяца у пациентов с сочетанной патологией по сравнению с 86 месяцами у пациентов контрольной группы. Частота бактериальных осложнений в первой группе была в 3,9 раз больше, а основной причиной смерти в ней являлись инфекционные осложнения. Таким образом, показано, что наличие БЛП отражается на результатах терапии пациентов с ММ, прежде всего, за счёт увеличения риска вторичных бактериальных инфекций. Требуются дополнительные исследования для разработки улучшенной стратегии противомикробной профилактики в данной группе.
Множественная миелома, коморбидность, хобл, общая выживаемость, инфекционные осложнения
Короткий адрес: https://sciup.org/170172528
IDR: 170172528
Текст научной статьи Влияние бронхолегочной патологии на общую выживаемость пациентов с множественной миеломой
Введение. Множественная миелома (ММ) является вторым по частоте встречаемости онкогематологическим заболеванием. Подавляющее число пациентов имеют средний возраст 69 лет [1, 7]. Основным методом лечения является полихимиотерапия с использованием современных таргетных препаратов.
Не вызывает сомнений, что ММ сопровождается иммунопарезом, характеризующимся патологией гуморального иммунитета и ассоциирующимся с повышенным риском инфекционных осложнений [3, 4, 12]. Проведение современной специфической терапии ММ за счёт дополнительной иммуносупрессии также приводит к увеличению риска инфекций (нейтропения, лимфопения со снижением CD4+ клеток) [8]. Это тем более важно учитывать для пациентов старшего возраста в условиях гематологического стационара в связи с высокой частотой внутрибольнич- ной инфекции, ассоциированной с полире-зистентными штаммами микроорганизмов. В этих условиях заболевания нижних дыхательных путей становятся клинически значимым фоном и могут играть роль в развитии тяжёлых бактериальных инфекций.
С целью изучения влияния сопутствующей бронхолегочной патологии (БЛП) на результаты терапии ММ нами проведена оценка общей выживаемости,а также частоты и характера инфекционных осложнений у пациентов с ММ в период индукции ремиссии.
Материалы и методы. В данное ретроспективное исследование были включены 156 пациентов с впервые выявленной множественной миеломой.
Медиана возраста составила 62 года (38–83), мужчины представляли 38,5 %. Основные демографические и лабораторные данные представлены в таблице 1.
Таблица 1
Демографические данные и характеристика основного заболевания
|
Параметр |
Всего пациентов ( % от всех) |
|
Всего пациентов |
156 |
|
Мужчины |
60 (38,5 %) |
|
Женщины |
96 (61,5 %) |
|
Медиана возраста |
62 (38–83) |
|
Стадия Durie-Salmon |
|
|
1А |
4 (2,6 %) |
|
2А |
36 (23,1 %) |
|
2В |
3 (1,9 %) |
|
3А |
90 (57,7 %) |
|
3В |
23 (14,7 %) |
|
Стадия ISS |
|
|
1 |
17 (10,9 %) |
|
2 |
20 (12,8 %) |
|
3 |
34 (21,8 %) |
|
Нет данных |
85 (54,5 %) |
|
Вид иммуноглобулина |
|
|
A kappa |
15 (9,6 %) |
|
A lambda |
18 (11,5 %) |
|
Kappa |
20 (12,8 %) |
|
Lambda |
12 (7,7 %) |
|
G kappa |
57 (36,5 %) |
|
G lambda |
25 (16,0 %) |
|
Низкосекретирующая |
9 (5,8 %) |
125 пациентов (84,0 %) в первой линии получили бортезомиб-содержащие режимы, остальным была проведена терапия VAD и P (16,0 % больных), 57 пациентам (36,5 %) в первой линии была выполнена аутологич- ная трансплантация гемопоэтических стволовых клеток (рисунок 1). Анализ результатов лечения в зависимости от выбранной терапии не проводился.
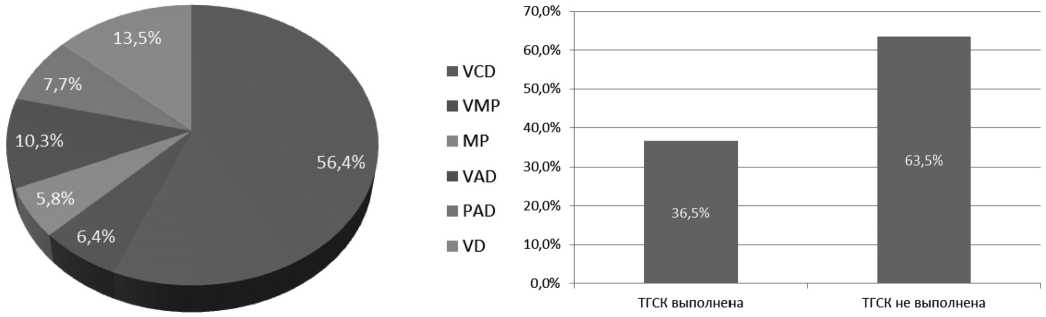
Рисунок 1. Использованные режимы химиотерапии 1-й линии.
Примечание. VCD — бортезомиб, циклофосфамид, дексаметазон. V P — бортезомиб, мел-фалан, преднизолон. PAD — бортезомиб, доксорубицин, дексаметазон. VD — бортезомиб, дексаметазон. P — мелфалан, преднизолон. VAD — винкристин, доксорубицин, дексаметазон. ТГСК — трансплантация гемопоэтических стволовых клеток.
Все пациенты были разделены на 2 группы в зависимости от наличия (группа 1) или отсутствия (группа 2/контрольная) БЛП. Клинически значимыми считались заболевания дыхательной системы, требующие медикаментозной терапии или амбулаторного наблюдения. Всем больным первой группы проводилось обследование БЛП, включающее спирографию, компьютерную томографию или рентгенографию органов грудной клет-ки,при необходимости бронхоскопия с исследованием бронхоальвеолярного лаважа.
Медиана времени наблюдения составила 42,0 месяца (от 1 до 120 месяцев). В ходе настоящего исследования не оценивалась выживаемость в зависимости от факторов, связанных с болезнью (стадия, вид иммуноглобулина, вовлечение органов-мишеней), также не проводился анализ беспрогрессив-ной выживаемости.
В структуре летальности причиной смерти было принято считать заболевание,непо-средственно приведшее к летальному исходу. Анализ дожития проводился в программе IB SPSS Statistics 21 версия на основании построения кривых Каплана-Мейера. Проверка нулевой гипотезы осуществлялась тестом log rank ( antell-Cox).
Результаты. Респираторная патология любой степени была зарегистрирована у 31
(19,9 %) из 156 пациентов, включённых в исследование. Клинически значимая сопутствующая патология дыхательной системы выявлена у 19 (12,2 %) пациентов и была представлена неконтролируемой бронхиальной астмой у 4 (2,6 %) больных, хронической обструктивной болезнью лёгких (ХОБЛ) у 11 (7,1 %), рецидивирующей ТЭЛА с формированием хронического лёгочного сердца у 2 (1,3 %), туберкулёзом в неактивной форме у 1 (0,6 %) и сочетанием бронхиальной астмы и ХОБЛ у 1 (0,6 %).
Во время проведения индукционной терапии инфекционные осложнения второй и более степени (по шкале Common Terminology Criteria for Adverse Events v4.03) зарегистрированы у 13 (68,4 %) и 24 (17,5 %) человек в исследуемой и контрольной группе, соответственно.
В исследуемой группе (группа 1) преобладали инфекции респираторного тракта: одинаково часто встречались как пневмонии, так и другие инфекции нижних дыхательных путей (тяжёлое обострение ХОБЛ, гнойный эндобронхит) — по 6 человек (31,6 %). В контрольной группе респираторные инфекции встречались достоверно реже. Частота пневмоний составила 2,9 %, инфекций нижних дыхательных путей — 5,8 % (таблица 2) .
Таблица 2
|
Группа 1 |
Группа 2 |
|
|
Пневмония |
6 (31,6 %) |
4 (2,9 %) |
|
Инфекция нижних дыхательных путей (кроме пневмонии) |
6 (31,6 %) |
8 (5,8 %) |
|
Сепсис |
1 (5,3 %) |
3(2,2 %) |
|
Инфекция мягких тканей |
0 |
1(0,7 %) |
|
Инфекция придаточных пазух носа |
0 |
1(0,7 %) |
|
Инфекция мочевыводящих путей |
0 |
7(5,1 %) |
|
Всего |
13/19 (68,4 %) |
24/137 (17,5 %) |
Количество инфекционных осложнений в ходе 1-й линии терапии
В группе 1 чаще встречались респираторные инфекции нижних дыхательных путей (31,6 % против 5,8 %) и пневмонии (31,6 против 2,9 %) и не отмечено случаев инфекции мягких тканей,придаточных пазух носа и инфекций мочевыводящих путей. Отдельная характеристика пациентов из группы 1 представлена в таблице 3.
Таблица 3
Характеристика пациентов, имевших клинически значимую респираторную патологию
|
№ |
Респираторная патология |
Инфекционные осложнения |
Причина смерти |
Продолжительность заболевания, мес. |
|
1 |
БА |
Нет |
Прогрессия |
96 |
|
2 |
ХОБЛ |
Пневмония |
Прогрессия |
4 |
|
3 |
ХОБЛ |
Нет |
120 |
|
|
4 |
ТЭЛА и ХЛС |
Пневмония |
53 |
|
|
5 |
ХОБЛ |
Инфекция НДП |
Инфекция |
59 |
|
6 |
Туберкулёз |
Нет |
57 |
|
|
7 |
БА/ХОБЛ |
Пневмония |
Инфекция |
1 |
|
8 |
ХОБЛ |
Сепсис |
Инфекция |
7 |
|
9 |
ХОБЛ |
Пневмония |
Инфекция |
2 |
|
10 |
БА |
Инфекция НДП |
Прогрессия |
36 |
|
11 |
ХОБЛ |
Нет |
73 |
|
|
12 |
ТЭЛА и ХЛС |
Пневмония |
Инфекция |
5 |
|
13 |
ХОБЛ |
Пневмония |
Прогрессия |
43 |
|
14 |
ХОБЛ |
Нет |
ССО |
17 |
|
15 |
ХОБЛ |
Инфекция НДП |
Инфекция |
26 |
|
16 |
ХОБЛ |
Инфекция НДП |
33 |
|
|
17 |
БА |
Нет |
15 |
|
|
18 |
БА |
Инфекция НДП |
9 |
|
|
19 |
ХОБЛ |
Инфекция НДП |
29 |
Примечание. БА — бронхиальная астма. ХОБЛ — хроническая обструктивная болезнь лёгких. ХЛС — хроническое лёгочное сердце. НДП — нижние дыхательные пути.
Смертность в исследуемой группе была обусловлена, главным образом, развитием тяжёлых инфекционных осложнений (54,5 %), а не прогрессированием основного заболевания (36,4 %). Причинами смерти пациентов с крайне низкой общей выживаемостью
( таблица 3 , № 7 и № 9) являлись двусторонние пневмонии,резистентные к проводимой антимикробной терапии.
Медиана ОВ в исследуемой и контрольной группе составила 43 и 86 месяцев, соответственно (p 0,05) (рисунок 2) .
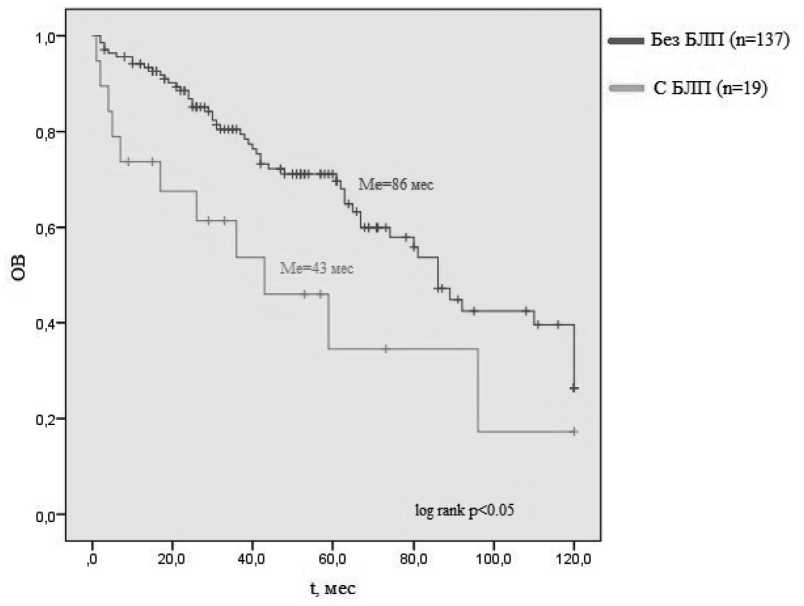
Рисунок 2. Графики Каплан-Мейер ОВ в зависимости от наличия/отсутствия сопутствующей БЛП.
Обсуждение. На общую выживаемость пациентов с ММ влияет множество факторов, одним из которых является сопутствующая патология [7, 10]. По данным Датского популяционного исследования, инфекционные осложнения любой степени тяжести встречаются у 45 % пациентов в течение первых 6 месяцев лечения множественной миеломы, что диктует необходимость профилактического использования антибактериальных, антипневмоцистных и противовирусных препаратов.
Kleber et al. [10] в 2011 году показали, что наличие респираторной патологии ассоциировано с неблагоприятным прогнозом при ММ. Основываясь на полученных результатах, авторами был создан новый индекс ко-морбидности (Freiburg comorbidity index), с обязательным включением лёгочной патологии как фактора риска аддитивной летальности.
В ходе настоящего исследования было по-казано,что общая частота инфекционных осложнений 2 и более степени составила 23,7 %, в то время как в группе пациентов с сопутствующей бронхолегочной патологией этот показатель был значительно выше и соста- вил 68,4 % (13 из 19 пациентов). В 92,3 % случаев они были представлены респираторными инфекциями без увеличения частоты инфекций других локализаций.
В группе ММ в сочетании с хронической БЛП результаты исследования показали достоверно меньшие показатели общей выживаемости по сравнению с контрольной груп-пой(43 и 86месяцевсоответственно,р 0,05). Основной причиной смерти у этих пациентов явились внутрибольничные бактериальные инфекции,резистентные к проводимой антибактериальной терапии.
Полученные данные свидетельствуют о необходимости рассматривать пациентов с ММ и сопутствующей БЛП как особую группу риска развития тяжёлых бактериальных инфекций нижних дыхательных путей. Уже на этапе верификации диагноза ММ требуется дополнительное обследование бронхолегочной системы, включающее проведение спирографии, компьютерной томографии или рентгенографии органов грудной клетки. При необходимости, требуется проведение бодиплетизмографии, бронхоскопии с исследованием бронхоальвеолярного лаважа. Необходимо обращать внимание на обя- зательное проведение профилактической антибактериальной терапии, направленной на снижение риска инфекций НДП c включением респираторных фторхинолонов [9, 13], т. к. было показано, что применение левофлоксацина в качестве стандартной противо-микробной профилактики значимо уменьшает частоту инфекционных осложнений во время проведения лечения.
Заключение. Бронхолегочная патология является дополнительным фактором риска смерти пациентов с множественной миеломой. Сочетание БЛП и ММ значительно увеличивает риски инфекционных осложнений.
До начала программного лечения целесообразна комплексная оценка состояния дыхательной системы (МСКТ органов грудной клетки,исследование функции внешнего дыхания, при необходимости — бодиплетизмо-графия)для раннего выявления неблагоприятного коморбидного фона.
Необходимы дополнительные исследования для решения вопроса о модификации стандартной противомикробной профилактики у пациентов с сочетанием ММ и заболеваний дыхательной системы.
Список литературы Влияние бронхолегочной патологии на общую выживаемость пациентов с множественной миеломой
- Бессмельцев С. С. Множественная миелома. Руководство для врачей/ Бессмельцев С. С. Абдулкады-ров К. М.— М.: МК, 2016-504 с.
- Войцеховский В. В., Ландышев Ю. С., Григоренко А. А. Особенности диагностики и лечения пневмонии у больных множественной миеломой // Бюллетень физиологии и патологии дыхания.— 2013 —Т. 50 С. 23-29
- НовиковаА.А., КлясоваГ. А., ГрибановаЕ.О.Инфекционные осложнения у больных множественной миеломой в период первого курса химиотерапии // Онкогематология — 2018.— Т. 13, №3 — С. 63-75
- Салогуб Г. Н. Осложнения множественной миеломы и методы их коррекции (Лекция) // Вестник гематологии — 2014.—Т. 10, № 3 — С. 39-50
- AlemuA., Richards J., Oaks M. Vaccination in Multiple Myeloma: Review of Current Literature // Clin Lymphoma Myeloma Leuk — 2016.—Vol. 16 №9 — P. 495-502
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. 2018 [internet publication]
- Gregersen H., Vangsted A. J., Abildgaard N. The impact of comorbidity on mortality in multiple myeloma: a Danish nationwide population-based study // Cancer Med — 2017 — Vol. 6, №7 — P. 1807-1816
- Hassan Z., Khan A. A., Aggarwal S. Efficacy and tolerability of bortezomib and dexamethasone in newly diagnosed multiple myeloma // South Asian J Cancer — 2018.— Vol.7, №1 — P. 58-60
- JungS. H., KangS. J., Jang H. C. Effect of levofloxacin prophylaxis for prevention of severe infections in multiple myeloma patients receiving bortezomib-containing regimens // Int J Hematol — 2014.—Vol.100, № 5 — P. 473-477
- Kleber M., Ihorst G., Terhorst M. Comorbidity as a prognostic variable in multiple myeloma: comparative evaluation of common comorbidity scores and use of a novel MM-comorbidity score // Blood Cancer J — 2011.—Vol.1, №9 —e35
- Pei Hsu, Ting-Wei Lin, Jyh-Pyng Gau. Risk of Early Mortality in Patients With Newly Diagnosed Multiple Myeloma // Medicine (Baltimore) — 2015.—Vol.94, № 50 — e2305.
- S0rrigR., KlausenT. W., Salomo M. Risk factors for infections in newly diagnosed Multiple Myeloma patients: A Danish retrospectivenationwide cohort study // Eur J Haematol — 2019 — Vol.102, №2 — P. 182-190
- Stella Bowcock, Planche T., Iqbal G. Levofloxacin prophylaxis in newly diagnosed myeloma reduces febrile episodes and death without increasing healthcare associated infections: results from the teamm trial // EHA Learning Center — 2018
- ValkovicT., GacicV., Ivandic J. Infections in Hospitalised Patients with Multiple Myeloma: Main Characteristics and Risk Factors // Turk J Haematol — 2015.—Vol. 32, №3 -P.234-42
- Westerik J. A., MettingE. I., van Boven J. F. Associations between chronic comorbidity and exacerbation risk in primary care patients with COPD // Respir Res — 2017.—Vol.18, №31 — P. 1-17


