Влияние димеров HLA-DQ на развитие несостоятельности трансплантата при трансплантациях гаплоидентичных гемопоэтических стволовых клеток крови
Автор: Хамаганова Е.Г., Хижинский С.П., Дроков М.Ю.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.20, 2024 года.
Бесплатный доступ
Молекулы HLA-DQ являются димерами полиморфных αи β-цепей. Все молекулы HLA-DQ делятся на две группы G1 и G2, димеризация возможна только между αи β-цепями одной группы. У человека может быть одна, две или четыре уникальных молекулы (димера) HLA-DQ. Цель исследования – изучить влияние числа уникальных молекул HLADQ различных G-групп реципиента на развитие несостоятельности трансплантата после гапло-ТГСК у больных острыми лейкозами. Исследование включало 134 больных с острыми лейкозами, которым была выполнена трансплантация гемопоэтических стволовых клеток от родственного гаплоидентичного донора. Установлено, что у больных с четырьмя уникальными молекулами HLA-DQG1 имеется тенденция к повышению риска развития несостоятельности трансплантата, напротив, у больных-носителей четырех уникальных молекул HLA-DQG2 риск развития несостоятельности трансплантата понижен.
HLA-DQ, гаплоидентичная трансплантация гемопоэтических стволовых клеток
Короткий адрес: https://sciup.org/170204382
IDR: 170204382
Текст научной статьи Влияние димеров HLA-DQ на развитие несостоятельности трансплантата при трансплантациях гаплоидентичных гемопоэтических стволовых клеток крови
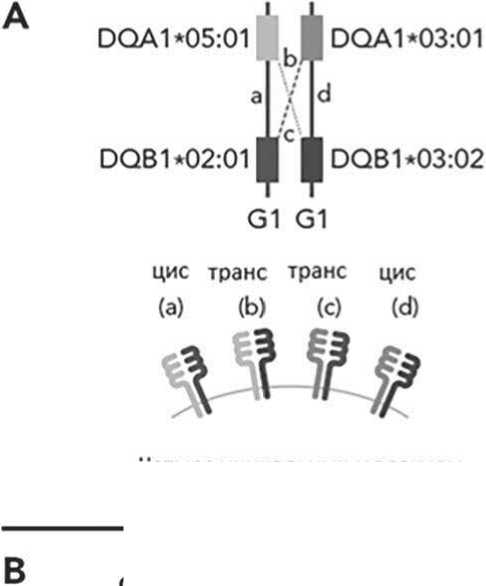
Введение. HLA-молекулы класса II – гетеродимеры, образующиеся при димеризации α-цепи, кодируемой генами HLA-DRA, -DQA1 или -DPA1, с соответствующей β-цепью. Полиморфизм молекул HLA-DR и –DP определяется в основном β-цепью, полиморфизм у HLA-DQ характерен для обеих цепей [1]. Дополнительное разнообразие HLA-DQ обеспечивается возможной транс-димеризацией α-цепи одного родителя с β-цепью другого. Человек может иметь 1, 2 или 4 уникальных молекулы (димера) HLA-DQ. На рис. А представлен пример носительства 4-х уникальных молекул HLA-DQ, две из которых образовались в результате цис-димеризации, когда обе цепи наследуются от одного родителя (на рис. это димеры, образованные DQA1*05:01-DQB1*02:01 и DQA1*03:01-DQB1*03:02), а две других – в результате транс-димеризации, когда α- и β-цепи наследуются от разных родителей (на рис. А это димеры, образованные DQA1*05:01-DQB1*03:02
и DQA1*03:01-DQB1*02:01). На успешную димеризацию влияет стабильность димера; α-цепи аллелей DQA1*02, 03, 04, 05 и 06 образуют устойчивые димеры с β-цепями аллелей DQB1*02, 03 и 04 (молекулы группы G1), а α-цепи DQA1*01 – с β-цепями аллелей DQB1*05 и 06 (молекулы группы G2). Имеются структурные ограничения, препятствующие трансдимеризации α-цепей G1 с β-цепями G2 и α-цепей G2 с β-цепями G1 [2-3]. Трансдимеры не могут быть различимы серологическими или молекулярными методами, однако легко определяются по результатам HLA-типирования [2, 4]. При гаплоидентичной трансплантации гемопоэтических стволовых клеток (гапло-ТГСК) донор и реципиент могут иметь одно несовпадение, или совпадать по аллелям конкретного HLA-гена. В отличие от неродственной ТГСК нет консенсуса по влиянию несоответствий по HLA на результаты гапло-ТГСК. Есть исследования, не выявившие корреляции между числом несоот-
Четыре уникальных молекулы
Одна уникальная молекула
Две уникальных молекулы
G2: DQA1 * 01:02 - DQB 1*06:02
G2: DQA1 * 01:02 - DQB 1*06:02
G2: DQA1 * 01:02 - DQB1* 06:02
G2: DQA1*01:02 - DQB1*05:02
Две уникальных молекулы
G1: DQA1* 03:01 - DQB 1*03:02
G2: DQA1* 01:02 - DQB 1*06:02
Четыре уникальных молекулы
G1: DQA1*05:01 -DQB1*02:01
G1: DQA1 *03:02 - DQB1 *03:03
G1 G1

Рисунок А. Схема образования димеров молекул HLA-DQ (адаптировано из E. Petersdorf et al., 2022 [3]) A – цис-димеризация (a и d) между аллелями DQA1 и DQB1, наследуемых из одного родительского HLA-гаплотипа; транс-димеризация (b и c) между аллелями DQA1 и DQB1, наследуемых из разных родительских HLA-гаплотипов
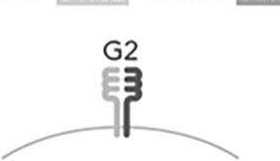
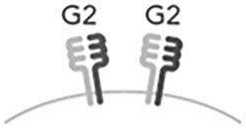
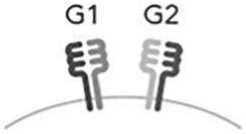
B – варианты числа уникальных HLA-DQ молекул у индивида (1, 2 или 4 уникальных молекулы)
ветствий по HLA-A, -B, -C, -DRB1 генам и рецидивом, реакцией трансплантат против хозяина (РТПХ) и смертностью при гапло-ТГСК [5-7].
Другие отметили протективный эффект несовпадений по генам HLA-DRB1, -DQB1, -DPB1 на результаты гапло-ТГСК, вследствие снижения риска рецидива и повышения выживаемости [8-9]. Для оценки влияния локуса HLA-DQ на результаты аллогенных ТГСК недостаточно информации, основанной на соответствии/несоответствии экзона 2 гена HLA-DQB1 у донора и реципиента, как при ти-пировании с высоким разрешением гена HLA-DRB1, так как молекула HLA-DQ является димером двух полиморфных цепей. При неродственной совместимой по генам HLA-A, -B, -C, -DRB1 ТГСК носительство молекул группы HLA-DQG2 снижает безрецидивную выживаемость и повышает риск рецидива по сравнению с больными-гомозиготами по группе молекул HLA-DQG1 [3]. Внедрение новых методов обработки трансплантата и РТПХ снизило риск развития тяжелых осложнений при гапло-ТГСК, однако нарушение функции трансплантата остаётся серьёзной проблемой, ухудшающей общую выживаемость [10-12]. Несостоятельность трансплантата (НТ) – группа осложнений, которую характеризует двух-или трёхростковая цитопения в сочетании с гипо/ аплазией костного мозга. Первичная НТ – отсутствие приживления трансплантата к +28 дню после алло-ТГСК (неприживление трансплантата) [10, 13]. Возврат цитопении с потерей донорского кроветворения в отсутствии рецидива заболевания после приживления трансплантата с полным донорским химеризмом, – вторичная НТ. Также к НТ относят ги-пофунцию трансплантата, которая характеризуется двух- или трёхростковой цитопенией, продолжающейся более 14 дней при наличии полного донорского химеризма [10]. Факторы риска развития НТ многочисленны (низкая доза CD34+ клеток в трансплантате, наличие у реципиента донор-специфиче-ских анти-HLA антител – ДСА, высокий уровень несоответствий по системе HLA и др.) [14-17].
Цель исследования – изучить влияние числа уникальных молекул (димеров) HLA-DQ различных
G-групп реципиента на развитие несостоятельности трансплантата после гапло-ТГСК у больных острыми лейкозами.
Материалы и методы. В исследование вошли 134 больных острыми лейкозами (ОЛ), которым в ФГБУ «НМИЦ гематологии» Минздрава России была выполнена ТГСК от гаплоидентичного родственного доноров. HLA-типирование выполнялось по генам A, -B, -C, -DRB1, -DRB3/4/5, -DQA1, -DQB1, -DPA1, -DPB1 с высоким разрешением методом секвенирования следующего поколения (NGS – next-generation sequencing) с использованием секвенатора MiSeq (Illumina, США) в соответствии с рекомендациями производителей наборов для HLA-типирования (One Lambda, США или Scisco, США). У всех больных с помощью виртуального кросс-матча было подтверждено отсутствие ДСА (определение анти-HLA антител проводили с помощью наборов LIFECODES LifeScreen Deluxe (скрининг) и затем при наличии антител с помощью наборов LIFECODES LSA Class I и/или LIFECODES LSA Class II (Immucore, USA)). Больные цензурированы по состоянию на 1 января 2024 г. Описательная статистика включала число случаев и долю для дискретных факторов, медианы и диапазон – для непрерывных величин. Различия между анализируемыми группами оценивались с помощью критериев χ2, Краскела – Уоллиса и точного теста Фишера. Для оценки конкурирующих рисков применялась программа «R», конечной точкой анализа была оценка развития НТ в зависимости от числа уникальных молекул (димеров) HLA-DQ различных G-групп у реципиента. Оценка кумулятивной инцидентности НТ происходила с учетом конкурирующих рисков. Для оценки значимости различий между группами использовался тест Грея. Значения p<0,05 с поправкой на FDR (False Discovery Rate – средняя доля ложных отклонений гипотез – среди всех отклонений) считались статистически значимыми, значения p<0,01 принимались за тенденцию.
Результаты. Основные характеристики больных, доноров и проведенных гапло-ТГСК представлены в таблице 1.
Таблица 1
|
Характеристика |
Значение |
|
Пол больных, n (%) |
|
|
Мужчины (м) |
54 (40,3) |
|
Женщины (ж) |
80 (59,7) |
|
Возраст, медиана (МКР) |
33 (26 – 42) |
|
Диагноз, n (%) |
|
|
Острые миелоидные лейкозы (ОМЛ) |
84 (62,7) |
|
Острые лимфобластные лейкозы (ОЛЛ) |
50 (37,3) |
|
Статус заболевания, n (%) |
|
|
Первая полная ремиссия (ПР1) |
97 (72,4) |
|
Вторая и последующие полные ремиссия (ПР2+) |
37 (27,6) |
|
Режим предтрансплантационного кондиционирования, n (%) |
|
|
Миелоаблативный |
21 (15,7) |
|
Пониженной интенсивности |
113 (84,3) |
|
Число CD34+ клеток, медиана (МКР) |
6,00 (4,94 – 6,00) |
|
Профилактика острой РТПХ, n (%) |
|
|
АТГ |
1 (0,8) |
|
АТГ+ЦФ |
8 (6,0) |
|
TCRαβ/CD19 деплеция |
37 (27,6) |
|
ЦФ |
81 (60,4) |
|
другое |
7 (5,2) |
|
Несостоятельность трансплантата, n (%) |
|
|
Отсутствие НТ |
96 (71,6) |
|
НТ |
21 (15,7) |
|
Первичная несостоятельность трансплантата |
19 (14, 2) |
|
Вторичная несостоятельность трансплантата |
2 (1,5) |
|
Гипофункция |
17 (12,7) |
|
Первичная гипофункция трансплантата |
10 (7,5) |
|
Вторичная гипофункция трансплантата |
7 (5,2) |
|
Острая РТПХ 2-4 степени, n (%) |
40 (29,9) |
|
Хроническая РТПХ, n (%) |
38 (28,4) |
|
Рецидив после трансплантации, n (%) |
33 (24,6) |
Характеристики больных, доноров и проведения гапло-ТГСК (n=134)
У 96 больных (71,6%) НТ после гапло-ТГСК отсутствовала. НТ развилось у 21 больного (15,7%): у 19 больных (14,2%) – первичная, у двух больных (1,5%) – вторичная. У 17 больных (12,7%) констатирована гипофункция трансплантата: у 10 (7,5%) – первичная, у 7 (5,2%) – вторичная.
Для оценки влияния числа уникальных молекул (димеров) HLA-DQ разных G-групп реципиента на развитие НТ после гапло-ТГСК определяли их число и принадлежность к HLA-DQG-группе, исходя из результатов HLA-типирования. Принимали, что больной, гомозиготный по аллелям обоих генов локуса HLA-DQ, является носителем одной уникальной молекулы HLA-DQ. На рис. А – гомозиготный по DQA1*01:02 и DQB1*06:02 индивид является носителем одной молекулы HLA-DQ, относящейся к HLA-DQG2. Две уникальных молекулы HLA-DQ могут быть в двух случаях. Первый – гомозиготность по одному из двух генов локуса HLA-DQ, но с двумя разными аллелями второго гена локуса. На рис. А этот вариант представлен индивидом с одним аллелем DQA1*01:02, но с двумя разными аллелями гена DQB1 - DQB1*05:02 и DQB1*06:02, которые кодируют две разные β-цепи. Обе β-цепи димеризуются с одинаковой α-цепью. Во втором случае – индивид имеет аллели генов, которые кодируют молекулы разных групп HLA-DQ – G1 и G2, что дает возможность димеризации α- и β-цепей внутри своей группы, но исключает димеризацию между группами. Этот ва- риант на рис. А представлен индивидом с молекулами HLA-DQ, одна из которых относится к группе HLA-DQG1 и кодируется генами DQA1*03:01 (α-цепь) и DQB1*03:02 (β-цепь), а вторая – к группе HLA-DQG2 и кодируется генами -DQA1*01:02 (α-цепь) и -DQB1*06:02 (β-цепь). Четыре уникальных молекулы HLA-DQ присутствуют, когда индивид является носителем разных аллелей генов HLA-DQA1 и -DQB1, которые кодируют α- и β-цепи, относящиеся к одной группе – или G1, или G2. На рис. А это индивид с четырьмя разными молекулами HLA-DQ группы G1, α-цепи у которого кодируются аллелями DQA1*03:02 и DQA1*05:01, а β-цепи – аллелями DQB1*02:01 и DQB1*03:03.
Изучено влияние числа димеров HLA-DQG1 у больных на развитие НТ (первичной + вторичной) после гапло-ТГСК (табл. 2). Анализ не выявил статистически значимых отличий в частоте развития НТ в зависимости от числа димеров HLA-DQG1, однако показал тенденцию к увеличению угрозы риска (HR – Hazard Ratio) развития НТ с увеличением числа молекул HLA-DQG1, по сравнению с больными, их не имевшими (т.е., с генотипом G2G2).
Таблица 2Влияние числа димеров HLA-DQ G1 у больных на угрозу развития НТ после гапло-ТГСК
|
Число HLA- DQG1 |
Генотип |
Число больных |
HR (95% CI*) |
Значения P |
||
|
Всего n=134 (100%) |
Без НТ n=96 (100%) |
НТ n=38 (100%) |
||||
|
0 |
G2G2 |
26 (19,4) |
21 (21,9) |
5 (13,2) |
1 |
0,07 |
|
1-2 |
G1G1; G1G2 |
77 (57,5) |
54 (54,2) |
23 (60,5) |
4,25 (0,58-30,9) |
|
|
4 |
G1G1 |
31 (23,1) |
21 (21,9) |
10 (26,3) |
9,57 (1,18-77,8) |
|
*CI - confidence interval (доверительный интервал)
Изучении влияния числа димеров HLA-DQG2 у больных на развитие НТ (табл. 3) показало, что больные с 4 димерами HLA-DQG2 имеют выраженную тенденцию (р=0,06) к уменьшению риска развития
НТ по сравнению с больными, в генотипе которых присутствовало меньшее число молекул HLA-DQG2 или они отсутствовали.
Таблица 3Влияние числа димеров HLA-DQG2 у больных на угрозу развития НТ после гапло-ТГСК
|
Число HLA- DQG2 |
Генотип |
Число больных |
HR (95% CI*) |
Значения P |
||
|
Всего n=134 (100%) |
Без НТ n=96 (100%) |
НТ n=38 (100%) |
||||
|
0 |
G1G1 |
38 (28,4) |
27 (28,1) |
11 (28,9) |
1 |
0,06 |
|
1-2 |
G2G2; G1G2 |
81 (60,4) |
57 (59,3) |
24 (63,1) |
1,46 (0,22-17,4) |
|
|
4 |
G2G2 |
15 (11,2) |
12 (12,5) |
3 (7,9) |
0,03 (0,00-0,74) |
|
*CI - confidence interval (доверительный интервал)
Не установлено влияния на развитие НТ иммунологических показателей, представленных в таблице 4 (общее число молекул HLA-DQ у реципиента, со- впадение/расхождение донора и реципиента по аллелям генов локуса HLA-DQ, совпадение /расхождение донора и реципиента по группам HLA-DQG).
Таблица 4Влияние общего числа молекул HLA-DQ больных, совпадения донора и реципиента по аллелям генов HLA-DQ и по группам димеризации на развитие НТ после гапло-ТГСК
|
Иммунологический показатель |
Число больных |
Значения P |
||
|
Всего n=134 (100%) |
Без НТ n=96 (100%) |
НТ n=38 (100%) |
||
|
Общее число молекул HLA-DQ: 1 2 4 |
11 (8,2) 77 (57,5) 46 (34,3) |
10 (10,4) 53 (55,2) 33 (34,4) |
1 (2,6) 24 (63,2) 13 (34,2) |
0,47 |
|
Совпадение донора и реципиента по аллелям генов локуса HLA-DQ Расхождение донора и реципиента по аллелям генов локуса HLA-DQ |
25 (18,7) 109 (81,3) |
20 (21,8) 76 (79,2) |
5 (13,2) 33 (86,8) |
0,56 |
|
Совпадение донора и реципиента по группам HLA-DQG Расхождение донора и реципиента по группам HLA-DQG |
76 (56,7) 58 (43,3) |
56 (58,3) 40 (41,7) |
20 (52,6) 18 (47,4) |
|
Обсуждение . Известны ассоциации определенных молекул HLA-DQ с некоторыми аутоиммунными заболеваниями [18-21]. Роль HLA-DQ при алло-ТГСК менее известна. Гаплоидентичный родственный донор разделяет с больным один общий HLA-гаплотип и отличается переменным числом несовпадающих HLA-аллелей необщего (второго) HLA-гаплотипа. Антигены HLA-DQ относятся к низко экспрессирующимся, однако несоответствия по ним усиливают эффекты, связанные с несоответствиями по другим HLA-генам [22]. Для установления роли HLA-DQ при алло-ТГСК недостаточно информации, основанной на соответствии/ несоответствии экзона 2 гена HLA-DQB1 у донора и реципиента (как для гена HLA-DRB1), так как молекула HLA-DQ является гетеродимером двух полиморфных цепей – α и β. Роль HLA-DQA1 при алло-ТГСК не определена [9, 23-24], однако типирование обоих генов HLA-DQB1 и HLA-DQA1 включено в рекомендации по оптимальному HLA-типированию при алло-ТГСК [25-26].
Проведенное нами исследование, выполненное на относительно гомогенной группе больных ОЛ, которым проведена гапло-ТГСК, показало, что у больных-носителей четырех уникальных молекул HLA-DQG1 имеется тенденция к более высокому риску развития НТ по сравнению с больными-носителями меньшего числа HLA-DQG1. Напротив, у больных-носителей четырех уникальных молекул HLA-DQG2 риск развития НТ снижен. Таким образом, наши данные согласуются с предположением, что HLA-DQG1 и HLA-DQG2 являются качественно отличными антигенами [3]. Исследовании роли молекул HLA-DQ при неродственной совместимой алло-ТГСК установило значительно более высокий риск рецидива у больных-носителей HLA-DQG2 [3]. Риск рецидива возрастает с увеличением числа молекул HLA-DQG2, с противоположным эффектом от увеличения числа молекул HLA-DQG1. Чем обусловлено различие молекул HLA-DQ G1 и HLA-DQ G2 – неизвестно. Это может быть связано с любым этапом серии событий, которая начинается с образования α- и β-цепей и достигает кульминации в стабильной экспрессии молекул HLA-DQ на поверхности клетки. Возможные механизмы включают различную экспрессию; особенности сборки и транспортировки комплексов HLA-DQ; отличия в строении пептид-связывающих областей, которые меняют распознавание Т-клетками комплекса пептид – HLA-DQ; а также репертуар пептидов, презентируемых молекулой HLA-DQ [3, 27-28].
Общее число молекул HLA-DQ, совпадение донора и реципиента по аллелям генов HLA-DQ и группам димеризации не оказывают влияния на риск развития НТ после гапло-ТГСК.
Заключение
У больных-носителей четырех уникальных молекул HLA-DQG1 имеется тенденция к повышению риска развития несостоятельности трансплантата после трансплантации гаплоидентичных стволовых клеток крови. Напротив, у больных-носителей четырех уникальных молекул HLA-DQG2 риск развития несостоятельности трансплантата понижен. HLA-типирование генов HLA-DQA1 и HLA-DQB1 даёт возможность устанавливать число и вид молекул HLA-DQ, учет которых снижает возможные риски, связанные с трансплантацией аллогенных гемопоэтических стволовых клеток.
Список литературы Влияние димеров HLA-DQ на развитие несостоятельности трансплантата при трансплантациях гаплоидентичных гемопоэтических стволовых клеток крови
- The Immuno Polymorphism Database (IPD) – ImMunoGeneTics (IMGT)/HLA Database [Internet] Available from: https://www.ebi.ac.uk/ipd/imgt/hla/ (accessed 25.03.2024).
- Tollefsen S., Hotta K., Chen X., et al. Structural and functional studies of trans-encoded HLA-DQ2.3 (DQA1*03:01/DQB1*02:01) protein molecule // J Biol Chem. – 2012. – Vol. 287, №17. – P. 13611-13619.
- Petersdorf E., Bengtsson M., Horowitz M., et al. HLA-DQ heterodimers in hematopoietic cell transplantation // Blood. – 2022. – Vol. 139, №20. – P. 309-317.
- Kwok W.W., Nepom G.T. Structural and functional constraints on HLA class II dimers implicated in susceptibility to insulin dependent diabetes mellitus // Bailliere’s Clin Endocrinol Metab. – 1991. – Vol. 5. – P. 375-393.
- Kasamon Y., Luznik L., Leffell M., et al. Nonmyeloablative HLA-Haploidentical Bone Marrow Transplantation with High-Dose
- Posttransplantation Cyclophosphamide: Effect of HLA Disparity on Outcome // Biol Blood Marrow Transplant. – 2010. – Vol. 16. – P. 482-489.
- Lorentino F., Labopin M., Fleischhauer K., et al. The impact of HLA matching on outcomes of unmanipulated haploidentical HSCT is modulated by GVHD prophylaxis // Blood Adv. – 2017. – Vol.1, №11. – P. 669-680.
- Raiola A.M, Risitano A., Sacchi N., et al. Impact of HLA Disparity in Haploidentical Bone Marrow Transplantation Followed by High- Dose Cyclophosphamide // Biol Blood Marrow Transplant. – 2018. – Vol. 24. – P. 119–126.
- Solomon S.R., Aubrey M.T., Zhang X., et al. Class II HLA mismatch improves outcomes following haploidentical transplantation with posttransplant cyclophosphamide // Blood Adv. – 2020. – Vol.4, №20. – P. 5311-5321.
- Fuchs E.J., McCurdy S.R., Solomon S.R., et al. HLA informs risk predictions after haploidentical stem cell transplantation with posttransplantation cyclophosphamide // Blood. – 2022. – Vol. 139. – P. 1452-1468.
- Масликова У.В., Попова Н.Н., Дроков М.Ю., Хамаганова Е.Г. Несостоятельности трансплантата аллогенных гемопоэтических стволовых клеток: диагностика и лечение // Вестник медицинского института «РЕАВИЗ». – 2023. – Т. 13, №1. – С. 114-125.
- Kong Y. Poor graft function after allogeneic hematopoietic stem cell transplantation – an old complication with new insights // Semin Hematol. – 2019. – Vol. 56, №3. – P. 215-220.
- Ciurea S.O., Malki M.M., Kongtim P., et al. Treatment of allosensitized patients receiving allogeneic transplantation // Blood Adv. – 2021. – Vol. 5, №20. – P. 4031-4043.
- Kharfan-Dabaja M.A., Kumar A., Ayala E., et al. Standardizing Definitions of Hematopoietic Recovery, Graft Rejection, Graft Failure, Poor Graft Function, and Donor Chimerism in Allogeneic Hematopoietic Cell Transplantation: A Report on Behalf of the American Society for Transplantation and Cellular Therapy // Transplant Cell Ther. – 2021. – Vol. 27, №8. – P. 642-649,
- Рудакова Т.А., Кулагин А.Д., Климова О.У. и др. Тяжелая гипофункция трансплантата аллогенных гемопоэтических стволовых клеток у пациентов с онкогематологическими заболеваниями: частота, факторы риска, исходы // Клиническая онкогематология. – 2019. – Т. 12, №3. – С. 309–18.
- Tamari R., Ramnath S., Kuk D., et al. Poor Graft Function in Recipients of T Cell Depleted (TCD) Allogeneic Hematopoietic Stem Cell Transplants (HSCT) Is Mostly Related to Viral Infections and Anti-Viral Therapy // Blood. – 2012. – Vol. 120, №21. – P. 3147.
- Ciurea S.O., Cao K., Fernandez-Vina M., et al. The European Society for Blood and Marrow Transplantation (EBMT) Consensus Guidelines for the Detection and Treatment of Donor-specific Anti-HLA Antibodies (DSA) in Haploidentical Hematopoietic Cell Transplantation // Bone Marrow Transplant. – 2018. – Vol. 53. – P. 521–534.
- Sun Y.Q., Wang Y., Wang F.R., et al. Graft Failure in Patients With Hematological Malignancies: A Successful Salvage With a Second Transplantation From a Different Haploidentical Donor // Front Med (Lausanne). – 2021. –Vol. 8. – Article 604085.
- Бубнова Л.Н., Глазанова Т.В., Потин В.В., Симбирцев В.А. Генетические методы в диагностике и прогнозировании аутоиммунных эндокринных заболеваний // Медицинский академический журнал. – 2006 – №1. – С. 83-90.
- Erlich H., Valdes A.M., Noble J., et al. Type 1Diabetes Genetics Consortium. HLA DR-DQ haplotypes and genotypes and type 1 diabetes risk: analysis of the type 1 diabetes genetics consortium families // Diabetes. – 2008. – Vol. 57, №4. – P. 1084-1092.
- Sollid L.M. The roles of MHC class II genes and post-translational modification in celiac disease // Immunogenetics. – 2017. – Vol. 69, №8-9. – P. 605-616.
- Chabas D., Taheri S., Renier C., Mignot E. The genetics of narcolepsy // Annu Rev Genomics Hum Genet. – 2003. – Vol. 4, №1. – P. 459-483.
- Fernández-Viña M.A., Klein J.P., Haagenson M., et al. Multiple mismatches at the low expression HLA loci DP, DQ, and DRB3/4/5 associate with adverse outcomes in hematopoietic stem cell transplantation // Blood. – 2013. – Vol. 121, №22. – P. 4603-4610.
- Lee S.J., Klein J., Haagenson M., et al. High resolution donor-recipient HLA matching contributes to the success of unrelated donor marrow transplantation // Blood. – 2007. – Vol. 110, №13. – P. 4576-4583
- Little A.-M, Akbarzad-Yousefi A., Anand A., et al. BSHI guideline: HLA matching and donor selection for haematopoietic progenitor cell transplantation // Int. J. Immunogenet. – 2021. – Vol. 48, №2. – P. 75-109.
- Хамаганова Е.Г., Хижинский С.П., Кузьминова Е.П. и др. Оптимальное мультилокусное HLA-типирование у потенциальных доноров аллогенных гемопоэтических стволовых клеток // Клиническая онкогематология. – 2023. – Т. 16, №4. – С. 399–406.
- Yu N., Askar M., Wadsworth K., et al. Current HLA testing recommendations to support HCT // Human. Immunol. – 2022. – Vol. 83. – P. 665–673.
- Unanue E.R., Turk V., Neefjes J. Variations in MHC class II antigen processing and presentation in health and disease // Annu Rev Immunol. – 2016. – Vol. 34, №1. – P. 265-297.
- Zhou Z., Jensen P.E. Structural characteristics of HLA-DQ that may impact DM editing and susceptibility to type-1 diabetes // Front Immunol. – 2013. – Vol. 4. – Article 262.


