Влияние факторов роста тромбоцитов на пролиферацию сперматогенного эпителия после локального облучения электронами в нестерилизующей дозе
Автор: Демяшкин Г.А., Боровая Т.Г., Андреева Ю.Ю., Корякин С.Н., Вадюхин М.А., Щекин В.И., Лысанская Е.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина, патоморфология
Статья в выпуске: 4 т.21, 2021 года.
Бесплатный доступ
Нарушение мужской репродуктивной функции, вызванное облучением электронами, приводящим к снижению пролиферативной активности половых клеток, а также разработка способов её коррекции являются актуальными. Влияние факторов роста бедной лейкоцитамиплазмы, обогащенной тромбоцитами (LP-PRP), обладающих высокой регенеративной способностью для восстановления сперматогенеза остается малоизученным.Цель исследования: иммуногистохимическая оценка пролиферации сперматогенного эпителия после облучения электронами дозой 2 Гр и коррекции плазмой, обогащенной тромбоцитами. Материал и методы. Крысы породы Wistar (n=135) были поделены на 5 групп: I - контроль, II - 2IR, III - 2IR+LP-PRP+IGF-1, IV - 2IR+LP-PRP и V - LP-PRP. В I группе (n=10), крысамвводили физиологический раствор; крысы II, III, IV групп (n=95) получали однократное локальное облучение семенников электронами дозой 2 Гр. Крысам III-ей группы в течение11 недель вводили плазму, содержащую высокую концентрацию тромбоцитов и низкую концентрацию лейкоцитов - LP-PRP в комбинации с рекомбинантным человеческим IGF-1 (2IR+LP-PRP+IGF-1), крысам IV-ой группы (n=30) вводили только LP-PRP. Крысы V-ой группы (n=30) получали LP-PRP (без облучения). Животных всех групп выводили из эксперимента 1 раз в 2 недели на протяжении 12 недель. Семенники изучали гистологическим и иммуногистохимическим (ИГХ) методами, используя антитела к Ki-67, Bcl-2 и p53.Результаты. К окончанию эксперимента, при ИГХ-исследовании в семенных канальцах после облучения выявили смещение пролиферативно-апоптотического баланса в сторону апоптоза половых клеток: уменьшение уровней экспрессии Ki-67 (16,3±1,1%, P function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Сперматогенез, бесплодие, клеточный цикл, облучение, плазма, обогащенная тромбоцитами, факторы роста
Короткий адрес: https://sciup.org/149139215
IDR: 149139215
Текст научной статьи Влияние факторов роста тромбоцитов на пролиферацию сперматогенного эпителия после локального облучения электронами в нестерилизующей дозе
Демяшкин Григорий Александрович – к.м.н., заведующий отделом патоморфологии МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России, ведущий научный сотрудник Института трансляционной медицины и биотехнологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет) Минздрава России; ORCID:
Проблема мужского бесплодия затрагивает до 15% супружеских пар и связана с эндокринной, аутоимунной, инфекционной причинами или возникает идиопатически. При этом клинико-лабораторные проявления бесплодия (в первую очередь азооспермия) зависят от патоморфологических изменений сперматогенеза, к которым относятся снижение количества мужских половых клеток, подвижность сперматозоидов и др. [1, 2].
При изучении патогенетических механизмов мужского бесплодия применяют различные модели на лабораторных животных с последующей экстраполяцией результатов на человека. При моделировании, в качестве гонадотоксичных факторов используют лекарственные препараты из группы цитостатиков или ионизирующее излучение (β-, γ-, X-лучи и др.), приводящие к нарушению репликации ДНК и транскрипции РНК, подавляющему клеточный цикл мужских гамет [3].
В последнее время, активно проводят доклинические исследования различных препаратов и их аналогов, действие которых направлено на восстановление мужской репродуктивной функции [4, 5]. Одним из перспективных направлений можно считать использование бедной лейкоцитами плазмы, обогащенной тромбоцитами (LP-PRP), содержащей множество факторов роста (PDGF, TGF-β, VEGF, EGF и др.), которые участвуют в регуляции различных фаз жизненного цикла мужских половых клеток [6, 7]. Так, при ингибировании сперматогенеза цитостатиком на фоне введения PRP выявили увеличение количества сперматогенных стволовых клеток, подвижности сперматозоидов и уровня тестостерона [8]. В специализированной научной литературе данные об изучении влияния PRP на сперматогенез после облучения практически отсутствуют.
Размножение и гибель мужских половых клеток регулируются белками Ki-67, обеспечивающими пролиферацию, и каспазами, ответственными за апоптоз [9, 10].
Семенник обладает высокой чувствительностью к радиоактивному излучению, что проявляется снижением митотического деления и гибелью половых клеток, в особенности сперматогоний [11]. Активация апоптоза происходит по внешнему и внутреннему путям, а за терминальную фазу ответственна каспаза-3. Другими регуляторами клеточного цикла являются проапоптотический (р53) и антиапоптотический (Bcl-2) белки [9].
Дисбаланс между пролиферацией и апоптозом мужских половых клеток, в том числе вызванный облучением, сопровождающийся уменьшением клеточного пула, за счет модуляции GSK3-, ERK- и Ras/Raf/MEK-1 сигнальных путей, ведет к деактивации Bсl-2 и индукции p53 [12, 13].
Таким образом, в настоящее время снижение мужской репродуктивной функции, вызванное различными видами облучения и, в частности электронами, обусловленное повреждением различных стадий жизненного цикла гамет, остается актуальным. Не менее важной является разработка методов коррекции возникших патоморфологических изменений.
Цель исследования: иммуногистохимическая оценка пролиферации сперматогенного эпителия после облучения электронами дозой 2 Гр и коррекции плазмой, обогащенной тромбоцитами.
Для осуществления цели поставлены следующие задачи: изучение уровня экспрессии универсального фактора пролиферации ‒ Ki-67; маркеров антиапоптоза (Bcl-2) и проапоптоза (р53) в извитых семенных канальцах.
Материал и методы
Экспериментальное морфологическое исследование проводили на базах Медицинского радиологического научного центра имени А.Ф. Цыба и Сеченовского университета.
Животные для исследования in vivo. Крысы породы Wistar (n=135) были поделены на группы (условные названия): I – контрольная (n=10), которым вводили физиологический раствор; II, III, IV (n=95) – однократное локальное облучение семенников электронами дозой 2 Гр (2IR; мощность дозы 1 Гр/мин, энергия 10 МэВ и частота 9 Гц, размер поля – Ø 100 мм, линейный акселератор «NOVAC-11»); животным III-ей группы (n=30) в течение 11 недель вводили плазму, содержащую высокую концентрацию тромбоцитов и низкую концентрацию лейкоцитов – LP-PRP в комбинации с рекомбинантным IGF-1, а IV-ой группе (n=30) только LP-PRP; самцы V-ой группы (n=30) получали LP-PRP. Животных всех групп постепенно выводили из эксперимента 1 раз в 2 недели на протяжении 12 недель.
Все манипуляции осуществляли согласно Международным рекомендациям по проведению медико-биологических исследований с использованием животных (ЕЭС, Страсбург, 1985), Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ЕЭС, Страсбург, 1986), Руководствам по проведению медико-биологических исследований по уходу и использованию лабораторных животных (ILAR, DELS), Правилам лабораторной практики и приказу Минздрава России № 199н от 01.04.2016 «Об утверждении правил лабораторной практики». Исследование было одобрено локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), протокол № 043 от 11.08.2020 г.
Семенники после фиксации в растворе Буэна для иммуногистохимического исследования приготавливали по стандартному протоколу. Демаскировку антигенов проводили в цитратном буфере, рН 6,0. В качестве первичных антител использовали моноклональные антитела к Ki-67 (Clone MM1; 1:200), Bcl-2 (Clone bcl-2/100/D5; 1:50) и p53 (Clone DO-7; 1:200). Для определения вторичных антител использовались универсальная двухкомпонентная система детекции HiDef Detection™ HRP Polymer system, («Cell Marque», США), анти-IGG мыши/кролика, пероксидаза хрена (HRP) и субстрат DAB. Ядра клеток докрашивали гематоксилином Майера.
Подсчет количества иммунопозитивных клеток проводили в 10 случайно отобранных полях зрения при увеличении × 400 (в процентах).
Микроскопический анализ выполнялся с помощью системы видео-микроскопии (микроскоп Leica DM2000, Германия; камера Leica ICC50 HD).
Статистический анализ . Полученные данные обрабатывали с использованием компьютерной программы SPSS 12 for Windows statistical software package (IBM Analytics, США). Рассчитывали средние арифметические величины с предельными отклонениями и среднеквадратичную ошибку. Сравнение между группами проводили с использованием однофакторного дисперсионного анализа ANOVA со значимостью P < 0,05 .
Результаты исследования
Гистологическое исследование. В контрольной группе – физиологический сперматогенез. В семенниках крыс II-ой, III-ей и IV-ой групп через неделю после облучения наблюдали нарушение гистоархитектоники и признаки гипосперматогенеза, которые сохранялись в группе облученных животных без PRP-коррекции до окончания эксперимента (Рис. 1). На фоне введения LP-PRP+IGF-1 и LP-PRP наблюдали постепенное увеличение количества половых клеток, начиная с 14 суток эксперимента: на 42 сутки сперматогоний – в 2,0 раза, сперматоцитов – в 4,0 раза и сперматид – в 3,0 раза в сравнении с самцами II-ой группы. К окончанию исследования количество половых клеток увеличивалось до значений, близких к показателям контрольной группы, а в просвете семенных канальцев присутствовали сперматозоиды (на 12 неделе) (Рис. 1). Животные V-ой группы после введения LP-PRP на протяжении эксперимента не показали достоверных отличий по всем изученным параметрам по сравнению с контрольной группой (Рис. 1).
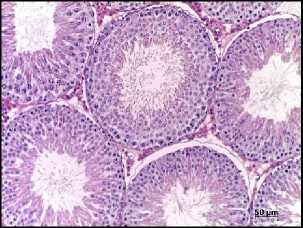
Контроль
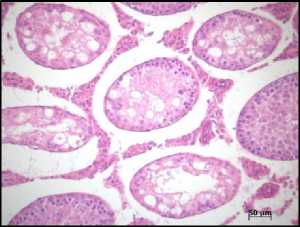
2IR (2 Гр)
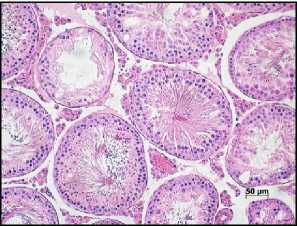
2IR+PRP+IGF
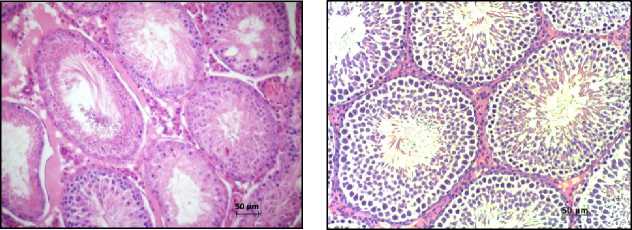
2IR+PRP
PRP
Рис. 1. Морфологическая картина семенников крыс на 12 неделе эксперимента в группах контроля, облучения (2IR), облучение+PRP+IGF-1 (2IR+PRP+IGF-1), облучение+PRP (2IR+PRP) и PRP. Окраска – гематоксилином и эозином, увелич. ×200.
Иммуногистохимическое (ИГХ) исследование. При анализе распределения Ki-67 после облучения (II-ая группа) отмечали уменьшение экспрессии исследуемого маркера в 4,6 раз (16,3±1,1%, P < 0,05 ) к окончанию эксперимента по сравнению с контрольными значениями (76,0±1,4%, P < 0,05 ). На фоне введения PRP самцам III-ей и IV-ой групп отмечали постепенное увеличение Ki-67-позитивных половых клеток по сравнению со II-ой группой: к окончанию эксперимента оно было выше в 3,5 раза (в комбинации с IGF-1) и 2,8 раза – 56,7±1,2% и 46,4±1,2%, соответственно, при P < 0,05 . В V-ой группе достоверных различий по сравнению с контрольными образцами не было обнаружено (Табл. 1, Рис. 2).
Практически аналогичную иммуногистохимическую картину демонстрировал антиапоптотический белок Bcl-2: через неделю после облучения отмечали снижение позитивно окрашенных половых клеток в 1,8 раз (29,3±1,1%, P < 0,05 ) по сравнению с контрольной группой (53,4±1,2%, P < 0,05 ). После введения PRP в комбинации с IGF-1, начиная со 2-ой недели после облучения, обнаружили постепенное увеличение количества Bcl-2-позитивных половых клеток, которое к 12-ой неделе было в 3,7 раз больше (33,9±1,2%, P < 0,05 ), чем у самцов II-ой группы (9,1±1,1%, P < 0,05 ), а в семенных канальцах животных IV-ой группы – в 2,5 раза (23,5±1,2%, P < 0,05 ). Показатели Bcl-2 в семенниках V-ой группы были близки к контрольным значениям (Табл. 1, Рис. 2).
Количество р53-окрашенных половых клеток варьировало на разных стадиях эксперимента (Табл. 1). Так, через неделю после облучения электронами в дозе 2 Гр наблюдалось увеличение количества p53-позитивных гамет в 1,3 раз (57,1±1,1%, P < 0,05 ), преимущественно сперматогоний, по сравнению с контрольной группой (54,3±1,2%, P < 0,05 ), в которой преобладали p53-окрашенные сперматиды и сперматозоиды. После введения комбинации PRP и IGF-1 крысам III-ей группы и PRP животным IV-ой группы отмечали постепенное уменьшение доли позитивных половых клеток в 1,8 (40,3±1,1%, P < 0,05 ) и в 1,6 (44,1±1,1%, P < 0,05 ) раз, соответственно, к 12-ой неделе по сравнению со II-ой группой. В V-ой группе на всем протяжении эксперимента не было выявлено статистически значимых различий в количестве p53-позитивных гамет по сравнению с контрольной группой (Табл. 1, Рис. 2).
Таким образом, на основании полученных результатов иммуногистохимического исследования четко прослеживается увеличение пролиферативной активности половых клеток, особенно сперматогоний, после введения PRP в комбинации с IGF-1 с опережением на 2 недели по сравнению с группой, которой вводили только PRP.
Таблица 1. Доля ИГХ-позитивных клеток в извитых семенных канальцах контрольной и опытных групп, %
|
Группы |
Ki-67 M±STD |
Bcl-2 M±STD |
p53 M±STD |
|
Контроль |
76,0±1,4 |
53,4±1,2 |
54,3±1,2 |
|
2IR 7 сутки |
53,7±1,2a |
29,3±1,1a |
57,1±1,1a |
|
2IR 14 сутки |
34,2±1,3a |
15,2±1,1a |
65,4±1,1a |
|
2IR 56 сутки |
21,4±1,0a |
12,5±1,1a |
69,9±1,2a |
|
2IR 84 сутки |
16,3±1,1a |
9,1±1,1a |
74,8±1,2a |
|
2IR+PRP+IGF 14 сутки |
42,5±1,3b |
23,7±1,1b |
60,3±1,2b |
|
2IR+PRP+IGF 56 сутки |
47,1±1,2b |
26,5±1,2b |
51,6±1,1b |
|
2IR+PRP+IGF 84 сутки |
56,7±1,2b |
33,9±1,2b |
40,3±1,1b |
|
2IR+PRP 14 сутки |
39,4±1,1c |
17,8±1,1c |
62,9±1,2c |
|
2IR+PRP 56 сутки |
43,2±1,3c |
20,3±1,1c |
57,6±1,2c |
А
Б
В
Г
Ki-67
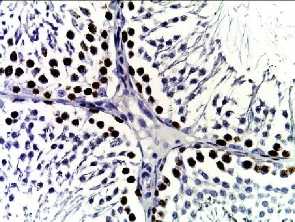
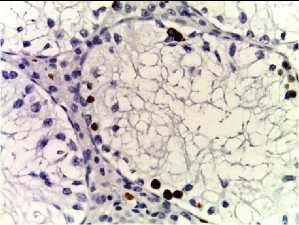
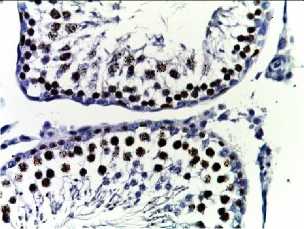
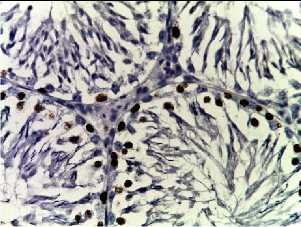
Bcl-2
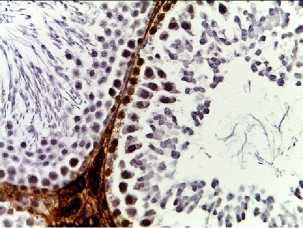
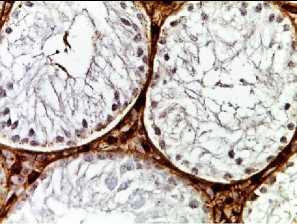
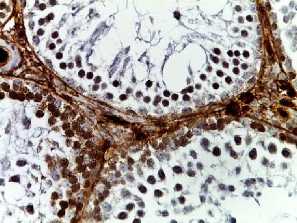
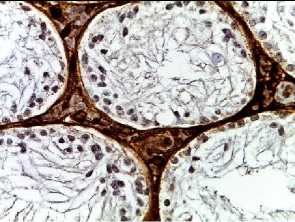
p53
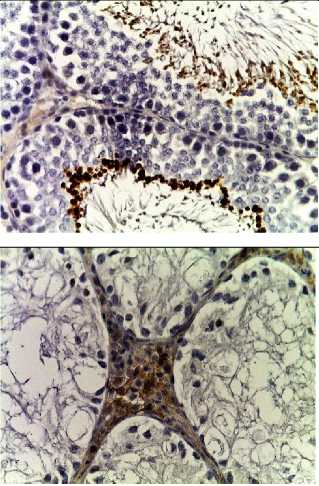
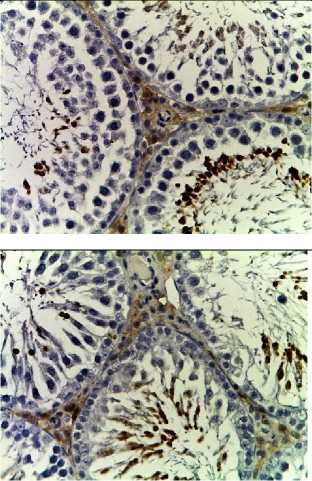
Д
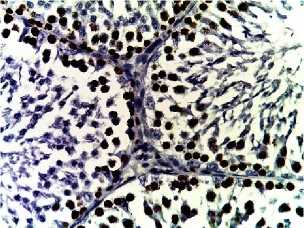
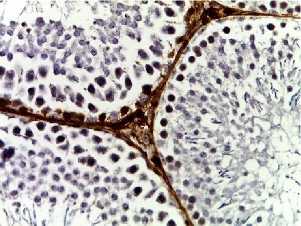
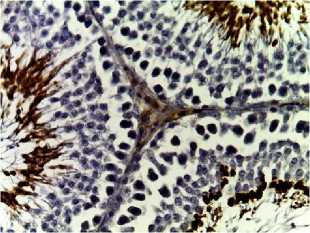
Рис. 2. Семенные извитые канальцы на 12 неделе эксперимента. Иммуногистохимические реакции с антителами к Ki-67, Bcl-2, p53; доокрашивание ядер – гематоксилином, увелич. ×400. А – контроль; Б – после облучения электронами дозой 2 Гр (2IR); В – после облучения электронами дозой 2 Гр и введения плазмы, обогащенной тромбоцитами с инсулиноподобным фактором роста-1 (2IR+LP-PRP+IGF-1); Г – после облучения электронами дозой 2 Гр и введения плазмы, обогащенной тромбоцитами (2IR+LP-PRP); Д – после введения плазмы, обогащенной тромбоцитами (LP-PRP).
Обсуждение результатов
Данное исследование посвящено изучению нарушения пролиферации половых клеток, возникшего после воздействия ионизирующего излучения на сперматогенез, и модулируемое факторами роста плазмы, обогащенной тромбоцитами.
После локального облучения электронами дозой 2 Гр в экспериментальных группах наблюдали выраженное снижение количества Ki-67-позитивных половых клеток, которое связано с прямым токсическим действием β-излучения на активно пролиферирующие гаметы, прежде всего сперматогоний, в которых происходят повреждения и нарушения и повреждения клеточных мембран и структуры макромолекул (ДНК, РНК, белков, липидов и др.), MAPK-, PI3K-и NFκB-сигнальных путей, белков семейства ErbB и клеточного дыхания на уровне цепи переноса электронов в митохондриях, что приводит к дисбалансу антиоксидантной и прооксидантной систем [14]. Кроме того, обнаруженное угнетение дифференцировки половых клеток связано с повреждением таких сигнальных путей как PI3-киназы/Akt и Ras/Raf/MEK-1, а также гликоген синтазы киназы-3 (GSK-3) и киназы, регулируемой внеклеточными сигналами (ERK) [12].
Модулирование активности вышеперечисленных каскадов также приводит к хромосомным мутациям, что подтверждено увеличением доли p53-позитивных половых клеток. Следует отметить, что после облучения наблюдали снижение количества митотически делящихся генераций, в то время как при нормальном сперматогенезе преимущественно уменьшается пул мейотически делящихся гамет вследствие их активной селекции при кроссинговере [15].
Индуцированное облучением электронами уменьшение количества Bcl-2-позитивных клеток связано с ингибированием трансляции мРНК Mcl-1 (белок, родственный Bcl-2) и его быстрым разрушением за счет протеасомной деградации, опосредованной фосфодегроном при участии GSK-3-сигнального пути, что приводит к смещению пролиферативно-апоптотического баланса в сторону апоптоза [13].
Известно, что действие ионизирующего излучения приводит к снижению экспрессии ключевых факторов роста, оказывающих прямое положительное влияние на пролиферацию и дифференцировку половых клеток. В связи с этим, было целесообразным применение плазмы, обогащенной тромбоцитами, α-гранулы которых содержат высокую концентрацию факторов роста, что, в итоге, приводит к усилению регенеративной активности гамет [16].
Входящие в состав PRP биологически-активные вещества, в первую очередь трансформирующий фактор роста-β, эпидермальный фактор роста и инсулиноподобный фактор роста-1, индуцируют митотическую активность неповрежденных сперматогониальных стволовых клеток и, тем самым, восстанавливают пролиферативно-апоптотический баланс [17].
Для усиления положительных эффектов PRP был выбран рекомбинантный IGF-1, который, проходя через гематотестикулярный барьер и плазмолемму половых клеток, стимулировал их пролиферацию, дифференцировку и регенеративную активность, что было подтверждено увеличением Ki-67- и Bcl-2-позитивных клеток в III-ей группе.
Заключение
Факторы роста α-гранул активированных тромбоцитов PRP, являющиеся ключевыми регуляторами жизненного цикла половых клеток, после облучения стимулируют восстановление пролиферативно-апоптотического баланса, усиленное дополнительным введением IGF-1 и подтвержденное на уровне экспрессии Ki-67, Bcl-2 и p53.
Список литературы Влияние факторов роста тромбоцитов на пролиферацию сперматогенного эпителия после локального облучения электронами в нестерилизующей дозе
- Vander Borght M., Wyns C. Fertility and infertility: Definition and epidemiology. Clin Biochem. 2018. V. 62. P. 2-10. DOI: doi: 10.1016/j.clinbiochem.2018.03.012.
- Jafari H., Mirzaiinajmabadi K., Roudsari R.L., Rakhshkhorshid M. The factors affecting male infertility: A systematic review. Int J Reprod Biomed. 2021. V. 19. No. 8. P. 681-688. DOI: 10.18502/ijrm.v19i8.9615.
- Qu N., Itoh M., Sakabe K. Effects of Chemotherapy and Radiotherapy on Spermatogenesis: The Role of Testicular Immunology. Int J Mol Sci. 2019. V. 20. No. 4. Article ID 957. DOI: 10.3390/ijms20040957.
- Abd El Tawab A.M., Shahin N.N., AbdelMohsen M.M. Protective effect of Satureja montana extract on cyclophosphamide-induced testicular injury in rats. Chem Biol Interact. 2014. V. 224. P. 196-205. DOI: 10.1016/j.cbi.2014.11.001.
- Alp B.F., Kesik V., Malkoç E., et al. The effect of melatonin on procarbazine induced testicular toxicity on rats. Syst Biol Reprod Med. 2014. V. 60. No. 6. P. 323-328. DOI: 10.3109/19396368.2014.930212.
- Everts P., Onishi K., Jayaram P., et al. Platelet-Rich Plasma: New Performance Understandings and Therapeutic Considerations in 2020. Int J Mol Sci. 2020. V. 21. No. 20. P. 77-94. DOI: 10.3390/ijms21207794.
- Garcia A., Su T.T. Cell cycle regulation. Fly (Austin). 2008. V. 2. No. 3. P. 133-137. DOI: 10.4161/fly.6333.
- Dehghani F., Sotoude N., Bordbar H., et al. The use of platelet-rich plasma (PRP) to improve structural impairment of rat testis induced by busulfan. Platelets. 2019. V. 30. No. 4. P. 513-520. DOI: 10.1080/09537104.2018.1478400.
- Guo M., Hay B.A. Cell proliferation and apoptosis. Curr Opin Cell Biol. 1999. V. 11. No. 6. P. 745-752. DOI: 10.1016/s0955-0674(99)00046-0.
- Zhao W.P., Wang H.W., Liu J., et al. Positive PCNA and Ki-67 Expression in the Testis Correlates with Spermatogenesis Dysfunction in Fluoride-Treated Rats. Biol Trace Elem Res. 2018. V. 186. No. 2. P. 489-497. DOI: 10.1007/s12011-018-1338-6.
- Bagheri H., Salajegheh A., Javadi A., et al. Radioprotective Effects of Zinc and Selenium on Mice Spermatogenesis. J Biomed Phys Eng. 2020. V. 10. 707–712. DOI: 10.31661/jbpe.v0i0.957.
- Wang Q., Zhou Y., Wang X., Evers B.M. Glycogen synthase kinase-3 is a negative regulator of extracellular signal-regulated kinase. Oncogene. 2006. V. 25. No. 1. P. 43-50. DOI: 10.1038/sj.onc.1209004.
- Morel C., Carlson S.M., White F.M., Davis R.J. Mcl-1 integrates the opposing actions of signaling pathways that mediate survival and apoptosis. Mol Cell Biol. 2009. V. 29. No. 14. P. 3845-3852. DOI: 10.1128/MCB.00279-09.
- Reisz J.A., Bansal N., Qian J., et al. Effects of ionizing radiation on biological molecules--mechanisms of damage and emerging methods of detection. Antioxid Redox Signal. 2014. V. 21. No. 2. P. 260-292. DOI: 10.1089/ars.2013.5489.
- Демяшкин Г.А. Иммунофенотипическая характеристика сперматогенеза при идиопатической форме мужского бесплодия. Патологическая физиология и экспериментальная терапия. 2020. Т. 64. No. 2. С. 63-73. DOI: 10.25557/0031-2991.2020.02.%2063-73
- Кубатиев А.А., Боровая Т.Г. Жуховицкий В.Г. и др. Микрочастицы тромбоцитов: образование и свойства. Патогенез. 2017. Т. 15. No. 2. С. 4-13. DOI: 10.25557/GM.2017.2.7296
- Maria-Angeliki G., Alexandros-Efstratios K., Dimitris R., Konstantinos K. Platelet-rich Plasma as a Potential Treatment for Noncicatricial Alopecias. Int J Trichology. 2015. V. 7. No. 2. P. 54-63. DOI: 10.4103/0974-7753.160098.


