Влияние Helicobacter pylori на содержание провоспалительных Т-клеточных цитокинов и продуцирующих их субпопуляций
Автор: Цыганова М.И., Талаева М.В., Талаев В.Ю., Неумоина Н.В., Перфилова К.М., Мохонова Е.В., Лапин В.А., Мелентьев Д.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 3 (23), 2018 года.
Бесплатный доступ
Резюме: Helicobacter pylori - распространенный патогенный микроорганизм, проникающий в слизистую желудка и двенадцатиперстную кишку и способствующий развитию заболеваний желудочно-кишечного тракта, в том числе и онкологического характера. Данный возбудитель склонен к длительному хроническому персистированию в организме, часто не сопровождающемуся какими-либо выраженными симптомами, что сильно затрудняет его своевременное обнаружение. Анализ риска возникновения и развития различных патологий, ассоциированных с Helicobacter pylori, показывает, что значительную роль в их протекании играет характер иммунного ответа, развивающегося после инфицирования. Существуют данные, что Helicobacter pylori способен влиять на защитные иммунные реакции, смещая их баланс в сторону иммуносупрессивной составляющей, например, повышения содержания Т-регуляторных клеток и вырабатываемых ими цитокинов. Однако существуют также данные о том, что параллельно Helicobacter pylori способен вызывать ответные реакции провоспалительного характера, включающие в себя пути, ассоциированные с Т-хелперными клетками 1-го и 17-го типа...
Лимфоциты, т-хелперные клетки, дифференцировка, костимуляция, антитела, проточная цитофлюорометрия, клеточные культуры, т-helpers
Короткий адрес: https://sciup.org/142215928
IDR: 142215928 | УДК: 616.98: | DOI: 10.21668/health.risk/2018.3.13
Текст научной статьи Влияние Helicobacter pylori на содержание провоспалительных Т-клеточных цитокинов и продуцирующих их субпопуляций
Вследствие этого оценка провоспалительного действия H. pylori и механизмов, определяющих склонность возбудителя как к регуляторному, так и провоспалительному действию представляется актуальной научно-практической задачей. Кроме того, значительный интерес представляет предварительно показанная для H. pylori возможность напрямую, без участия антигенпрезентирующих клеток (АПК) влиять по крайней мере на некоторые субпопуляции Т-клеток человека.
Целью работы была оценка способности H. pylori стимулировать образование INF-γ, IL-17A и Th17 в условиях прямого контакта между бактериями и Т-клетками, без участия АПК.
37 °С, в течение 7 суток. Идентификацию H. pylori осуществляли на основании культуральных и морфологических признаков.
Для оценки влияния H. pylori на дифференцировку лимфоцитов производилось сокультивирова-ние лимфоцитов с различными концентрациями бактерий (последовательно использовались соотношения лимфоцитов к H. pylori 1:10, 1:20, 1:50) в течение 18 часов в условиях: 5 % CO 2 , 37 °С, среда RPMI-1640 (Gibco, США) с добавлением 10%-ной эмбриональной телячьей сыворотки и 0,3 г/л L-глутамина («Панэко», Россия). Часть лимфоцитов со-культивировалась с бактериями в присутствии дополнительных стимуляторов – моноклональных антител к молекуле CD3 (1 мкг/мл, eBioscience, США), имитирующих воздействие на Т-клеточный рецептор, или смеси антител к CD3 и CD28 (1 мкг/мл, eBioscience, США, и 3 мкг/мл, Beckman Coulter, Франция), имитирующих воздействие АПК на Т-клетки. Имелись следующие культуры: лимфоциты с добавлением H. pylori , но без добавления стимулирующих антител; лимфоциты с добавлением антител к CD3 и без добавления бактерий; лимфоциты с добавлением антител к CD3 и с добавлением H. pylori ; лимфоциты с добавлением антител к CD3 и CD28, и без добавления H. pylori ; и лимфоциты с добавлением антител к CD3 и CD28 и добавлением H. pylori . Последний вариант добавлялся с целью оценить степень влияния, оказываемого на характер стимуляции непосредственным присутствием возбудителя. Эксперименты для всех соотношений лимфоцитов и бактерий проводились отдельно. Негативными контролями для всех вариантов культур служили лимфоциты без добавления H. pylori и стимулирующих антител.
По истечении 18 часов в культурах цитофлюорометрически оценивалось содержание Th17 как клеток фенотипа CD4+CD161+ и CD4+IL-17A+. Для окрашивания указанных маркеров применялись антитела к CD4, меченные FITC, антитела к CD161, меченные PE, антитела к IL-17A, меченные PE, все – производства eBioscience, США. Пермеабилизацию мембран, необходимую для мечения IL-17A, производили набором реагентов Fix/Perm Concentrate и Perm Buffer (eBioscience, США), согласно инструкциям производителя. Анализ осуществляли на ци-тофлюориметре FacsCalibur (Beckton Dickinson, США). Активность Th1 определялась путем измерения концентрации INF-γ в надосадках культур методом ИФА («Вектор-Бест», Россия). Для статистической обработки данных использовался критерий Ньюмена–Кейлса.
Результаты и их обсуждение. Одним из важных моментов в реализации иммунного ответа является повышение уровня INF-γ. Как активатор макрофагов этот цитокин задействован в непосредственном ответе на инфекционные атаки, кроме того, он усиливает эффекты интерферонов α и β, способствует развитию иммунного ответа по Th1-типу и обладает способностью стимулировать активность антигенпрезентирующих клеток [22]. Как можно видеть на рис. 1, добавление H. pylori к суспензии выделенных лимфоцитов как без дополнительных стимуляторов, так и в совокупности с антителами к CD3 или CD3/CD28 приводило к статистически достоверному повышению продукции INF-γ.
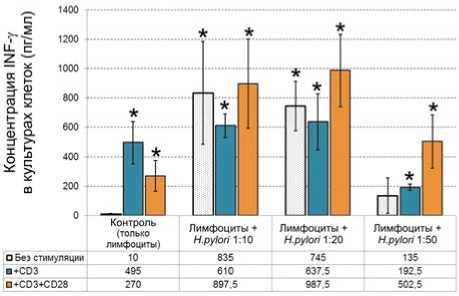
Рис. 1. Влияние H. pylory на продукцию INF-γ. Варианты стимуляции обозначены под диаграммой. Контроль – лимфоциты без добавления бактерий и антител, * – достоверные отличия от контроля ( p <0,05)
Данные о влиянии H. pylori на дифференцировку лимфоцитов в сторону Th17 и приобретении ими фенотипа CD4+CD161+ при отсутствии в культурах дендритных клеток представлены на рис. 2 и 3.
Как можно видеть, совместное культивирование H. pylori и Т-клеток в течение 18 часов не приводило к повышению числа CD4+CD161+-клеток. Среднее содержание их в культурах без стимуляции бактериями составляло 20,065 ± 0,72 % от всех CD4+-клеток, при добавлении H. pylori к отвечающим лимфоцитам в соотношении 10:1 составляло 22,15 ± 1,49 %. При этом содержание этих клеток
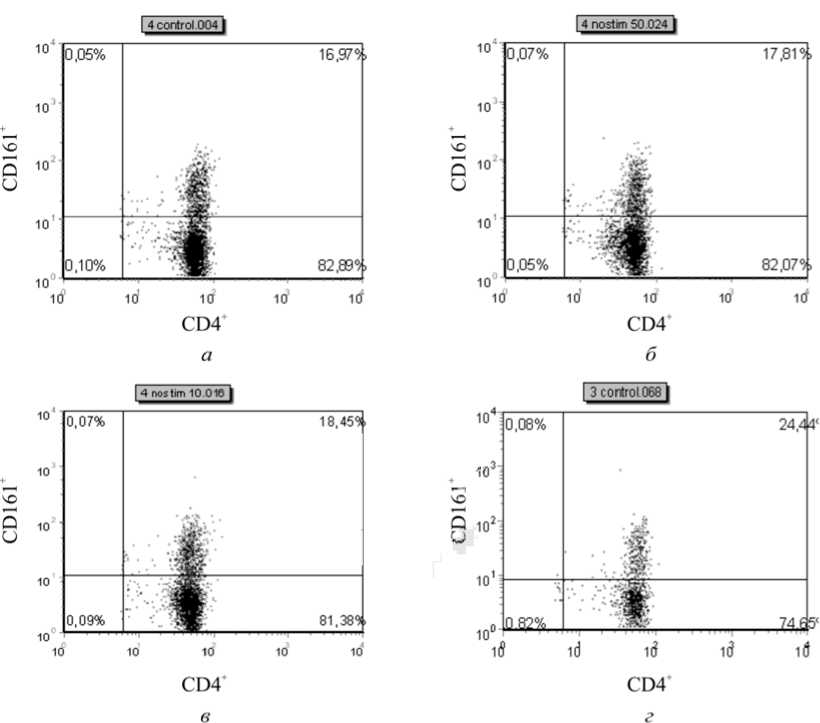
Рис. 2. Содержание CD4+CD161+-клеток в культуре Т-лимфоцитов при прямом сокультивировании с H. pylori без дополнительной стимуляции, в % от общего количества CD4+ клеток (данные репрезентативного эксперимента): а – контрольная суспензия лимфоцитов без добавления H. pylori , б – сокультивирование с H. pylori в соотношении 1:10, в , г – сокультивирование с H. pylori в соотношении 1:20 и 1:50 соответственно. Процентное содержание клеток указано в углах квадрантов
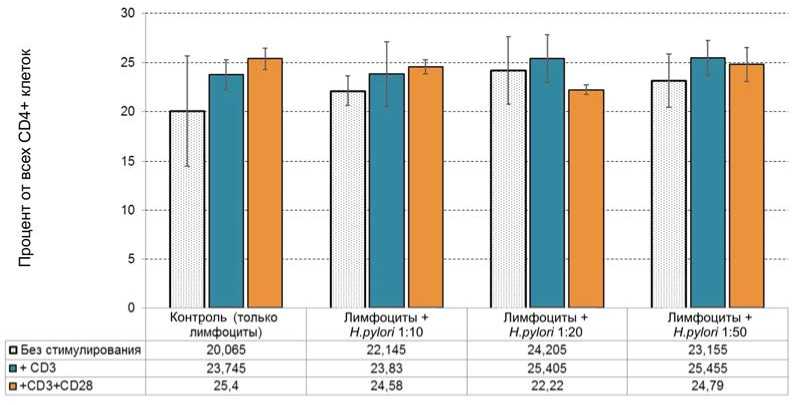
Рис. 3. Влияние H. pylory на содержание CD4+CD161+-клеток. Варианты стимуляции обозначены под диаграммой. Контроль – лимфоциты без добавления бактерий и антител
Содержание IL-17А+СD4+ клеток в условиях сокультивирования с H. pylory и/или дополнительной стимуляции антителами к CD3 и CD28
в культурах с соотношением клеток 1:20 и 1:50 также было практически не отличимо от контрольных значений нестимулированных лимфоцитов (для соотношения 20:1 содержание составило 24,2 ± 3,41 %, а для соотношения 50:1 – 23,15 ± 2,73 %.).
Для проверки значимости костимуляции нами были поставлены дополнительные эксперименты с добавлением стимулирующих антител к молекулам CD3 и CD3+CD28, предоставляющих Т-клеткам сигнал, подобный стимуляции от антигенпрезентирующих клеток. В культуре Т-лимфоцитов без H. pylori но с добавлением антител к CD3 содержание CD4+CD161+-клеток составило 23,745 ± 7,3 %. В то же время при добавлении и H. pylori, и антител к CD3 содержание CD4+CD161+-клеток составило 23,83 ± 3,30 % для соотношения 1:10, 25,4 ± 2,42 % для соотношения 1:20 и 25,4 ± 1,75 % для соотношения 1:50.
Молекула CD161 при ее коэкспрессии с молекулой CD4 широко используются в мировой научной практике как маркер популяции Th17. Однако наличие мембранных фенотипических маркеров не гарантирует функциональной способности отвечающих клеток к продукции IL-17A – основной функции Th17. Также, по мнению некоторых авторов, оценка содержания Th17 по наличию внутриклеточного IL-17A или его продукции является более надежным методом, чем применение CD161. Учитывая вышеизложенное, было оценено содержание внутриклеточного IL-17А в культурах лимфоцитов, отвечающих на H. pylory . Для этого произвели пермеабилизацию мембран отвечающих клеток и окрашивание их моноклональными антителами к IL-17A. Было установлено, что в применяющихся условиях культивирования большинство клеток не повышают экспрессию IL-17А (таблица).
Так, ни в одном из применяемых вариантов стимуляции и соотношений отвечающих клеток и бактерий содержание IL-17А+-клеток не превышало 0,5 % от всех CD4+-клеток пробы, что не отличается от нормального содержания IL-17+-клеток в крови человека [23–25].
Выводы. Прямое сокультивирование выделенных Т-лимфоцитов с H. pylori способствует резкому повышению продукции INF-γ, что в условиях данного эксперимента может с большой вероятностью свидетельствовать об активации Th1. Однако процент содержания Тh17, определяемых и как CD4+CD161+, и как CD4+IL17A+ в таких условиях сколько-нибудь значимо не изменяется. Можно предположить, что ответная реакция Т-хелперов на прямой контакт с H. pylori при ее провоспалитель-ном течении проходит по Th1-типу, без существенного вовлечения Th17. Механизм же, определяющий способность H. pylori стимулировать активность как Th1, так и T-reg (что было показано нами ранее), требует дополнительного исследования. В целом механизмы и действующие агенты, с помощью которых может осуществляться прямое воздействие патогенов на выбор преобладающего типа иммунного ответа, по мнению авторов, представляют значительный фундаментальный и практический интерес, поскольку потенциально могут быть использованы при разработке лекарственных средств, направляющих иммунный ответ в благоприятную сторону. Также значимы они и для оценки риска развития гиперстимулированных форм иммунного ответа у пациентов, инфицированных H. pylori .
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Влияние Helicobacter pylori на содержание провоспалительных Т-клеточных цитокинов и продуцирующих их субпопуляций
- Inflammatory bowel diseases: review of known environmental protective and risk factors involved/K.W.J. van der Sloot, M. Amini, V. Peters, G. Dijkstra, B.Z. Alizadeh//Inflamm Bowel Dis. -2017. -Vol. 9. -P. 1499-1509.
- Pachathundikandi S.K., Müller A., Backert S. Inflammasome activation by Helicobacter pylori and its Implications for persistence and immunity//Curr. Top. Microbiol. Immunol. -2016. -Vol. 397. -P. 117-131.
- Helicobacter pylori polyclonally activates murine CD4+ T-cells in the absence of antigen-presenting cells/C. Rosenplenter, F. Sommer, P. Kleemann, A. Belkovets, A. Schmidt, M. Lohoff//Eur. J. Immunol. -2007. -Vol. 37, № 7. -P. 1905-1915.
- Microbes and viruses are bugging the gut in celiac disease. Are they friends or foes?/A. Lerner, M. Arleevskaya, A. Schmiedl, T. Matthias//Front Microbiol. -2017. -Vol. 8. -P. 1392.
- Chen Y., Blaser M.J. Helicobacter pylori colonization is inversely associated with childhood asthma//J. Infect. Dis. -2008. -Vol. 198. -P. 553-560.
- Diagnosis of Helicobacter pylori infection is associated with lower prevalence and subsequent incidence of Crohn's disease/L.E. Bartels, P. Jepsen, L.A. Christensen, L.U. Gerdes, H. Vilstrup, J.F. Dahlerup//Journal of Crohn's and Colitis. -2016. -Vol. 10, № 4. -P. 443-448.
- Helicobacter pylori infection prevents allergic asthma in mouse models through the induction of regulatory T cells/I.C. Arnold, N. Dehzad, S. Reuter, H. Martin, B. Becher, C. Taube, A. Mьller//Journal Clin. Invest. -2011. -Vol. 121, № 8. -P. 3088-3093.
- The effect of Helicobacter pylori on asthma and allergy/A. Amedei, G. Codolo, G. Del Prete, M. de Bernard, M.M. D'Elios//Journal Asthma. Allergy. -2010. -Vol. 3. -P. 139-147.
- Lymphocytes in the human gastric mucosa during Helicobacter pylori have a T-helper cell 1 phenotype/K.B. Bamford, X. Fan, Sh.E. Crowe, J.F. Leary, W.K. Gourley, G.K. Luthra, E.G. Brooks, D.Y. Graham, V.E. Reyes, P.B. Ernst//Gastroenterology. -1998. -Vol. 114, № 3. -P. 482-492.
- Tarkkanen J., Kosunen T.U, Saksela E. Contact of lymphocytes with Helicobacter pylori augments natural killer cell activity and Induces Production of Gamma Interferon//Infection and immunity. -1993. -Vol. 61, № 7. -P. 3012-3016.
- Tsai H.-F., Hsu P.-N. Interplay between Helicobacter pylori and immune cells in immune pathogenesis of gastric inflammation and mucosal pathology//Cellular & Molecular Immunology. -2010. -Vol. 7. -P. 255-259.
- Влияние Helicobacter pylori на дифференцировку Т-регуляторных клеток/А.В. Матвеичев, М.В. Талаева, В.Ю. Талаев, Н.В. Неумоина, К.М. Перфилова, Д.Г. Лапаев, Е.В. Мохонова, М.И. Цыганова, В.Н. Коптелова, З.И. Никитина, В.А. Лапин, Д.А. Мелентьев//Анализ риска здоровью. -2017. -№ 1. -С. 21-28.
- Human peripheral and gastric lymphocyte responses to Helicobacter pylori NapA and AphC differ in infected and uninfected individuals/H.J. Windle, Y.S. Ang, V. Athie-Morales, R.McManus, D.Kelleher//Gut. -2005. -Vol. 54, № 1. -P. 25-32.
- Involvement of Toll-like receptors on Helicobacter pylori-induced immunity/R. Kдbisch, R. MejнasLuque, M. Gerhard, C. Prinz//PLoS One. -2014. -Vol. 9, № 8. -P. e104804.
- Shiu J., Blanchard T.G. Dendritic cell function in the host response to Helicobacter pylori infection of the gastric mucosa//Pathog. Dis. -2013. -Vol. 67, № 1. -P. 46-53.
- Interleukin-17C in human Helicobacter pylori gastritis/S. Tanaka, H. Nagashima, M. Cruz, T. Uchida, T. Uotani, J.A. Jimйnez Abreu, V. Mahachai, R. Vilaichone, T. Ratanachu-ek, L. Tshering, D.Y. Graham, Y. Yamaoka//Infect Immun. -2017. -Vol. 85, № 10. -P. e00389-e00417.
- Permin H., Andersen L.P. Inflammation, immunity, and vaccines for Helicobacter infection//Helicobacter. -2005. -Vol. 10, № 1. -P. 21-25.
- Pre-differentiated Th1 and Th17 effector T cells in autoimmune gastritis: ag-specific regulatory T cells are more potent suppressors than polyclonal regulatory T cells/E.N. Huter, G.H. Stummvoll., R.J. DiPaolo D.D. Glass, E.M. Shevach//Int. Immunopharmacol. -2009. -Vol. 9, № 5. -P. 540-545.
- Правада Н.С., Будрицкий А.М. Комплексная терапия с применением иммунотропных препаратов при туберкулезе и система интерферона-гамма//Вестник Витебского государственного медицинского университета. -2015. -Т. 14, № 4. -С. 5-14.
- Th1-Th17 ratio as a new insight in rheumatoid arthritis disease/H. Bazzazi, M. Aghaei, A. Memarian, H. Asgarian-Omran, N.Behnampour, Y.Yasdani//Iran J. Allergy Asthma Immunol. -2018. -Vol. 17, № 1. -P. 68-77.
- Роль Helicobacter Pylori при развитии экстрагастродуоденальных заболеваний/Э.А. Бардахчьян, С.Ю. Ломов, Н.Г. Харланова, Н.В. Камнева//Экспериментальная и клиническая гастроэнтерология. -2005. -№ 3. -С. 20-27.
- Интерферон-γ: биологическая функция и значение для диагностики клеточного иммунного ответа/А.А. Луцкий, А.А. Жирков, Д.Ю. Лобзин, М. Рао, Л.А. Алексеева, М. Мейрер, Ю.В. Лобзин//Журнал инфектологии. -2015. -Т. 7, № 4. -С. 10-22.
- Percentages of CD4+CD161+ and CD4-CD8-CD161+ T сells in the synovial fluid are correlated with disease activity in rheumatoid arthritis/J. Miao, K. Zhang, F. Qiu, T. Li, M. Lv, N. Guo, Q. Han, P. Zhu//Mediators Inflamm. -2015. -Vol. 2015. -P ID 563713.
- Rheumatoid synovial fluid interleukin-17-producing CD4 T cells have abundant tumor necrosis factor-alpha co-expression, but little interleukin-22 and interleukin-23R expression/L.D. Church, A.D. Filer, E. Hidalgo, K.A. Howlett, A.M.C. Thomas, S. Rapecki, D. Scheel-Toellner, C.D. Buckley, K. Raza//Arthritis Res. Ther. -2010. -Vol. 12, № 5. -P. R184.
- Shen H., Goodall J.C, Hill Gaston H.J.S. Frequency and phenotype of peripheral blood Th17 cells in ankylosing spondylitis and rheumatoid arthritis//Arthritis & rheumatism. -2009. -Vol. 60, № 6. -P. 1647-1656.


