Влияние хронического психосоциального стресса на интенсивность дегенеративных изменений в сетчатке у крыс с различной стресс-резистентностью
Автор: Коршунова Динара Викторовна, Гиззатуллина Екатерина Александровна, Брындина Ирина Георгиевна
Рубрика: Фундаментальная медицина
Статья в выпуске: 5-4 т.16, 2014 года.
Бесплатный доступ
У 20 крыс моделировали хронический психосоциальный стресс в течение 10 и 18 дней, после чего изучали признаки апоптоза ганглиозных клеток сетчатки методом TUNEL и содержание церамида и сфингомиелина в тканях методом тонкослойной хроматографии. Проведено сравнение с контрольной группой (10 крыс). При стрессе обнаружены отдельные TUNEL-позитивные ядра ганглиозных клеток сетчатки, отсутствовавшие у контрольных животных. У стресс-неустойчивых крыс признаки дегенеративных изменений сетчатки (уменьшение количества ганглиозных клеток), как и повышение уровня церамида в структурах заднего сегмента глаз и плазме крови были более выражены, чем у стресс-устойчивых (в 5,9 раз и 4,3 раза соответственно). Полученные данные свидетельствуют о том, что психоэмоциональный стресс может способствовать развитию дегенеративных изменений в сетчатке, в большей степени у особей с низкой резистентностью к стрессу.
Апоптоз, ганглиозные клетки сетчатки, сфинголипиды, психосоциальный стресс, стресс-резистентность
Короткий адрес: https://sciup.org/148101909
IDR: 148101909 | УДК: 617.735:612.823:612.123:616
Текст научной статьи Влияние хронического психосоциального стресса на интенсивность дегенеративных изменений в сетчатке у крыс с различной стресс-резистентностью
С постоянным ростом требований, предъявляемых социальной средой, все более значимым становится влияние стрессовых факторов на нервную систему и организм в целом. Показано, что психогенный стресс приводит к росту заболеваемости многими психосоматическими патологиями [2, 7]. Эмоциональный стресс является важным фактором снижения качества жизни и трудоспособности населения. В то же время клинические наблюдения свидетельствуют о существовании как людей, так и животных с различной пред-расположенностью к развитию нарушений в сходных стрессогенных ситуациях [5].
В настоящее время значимая роль в реализации стрессовых влияний на клеточном уровне отводится производным сфинголипидов: сфингозину, церамиду и др., которые считаются одними из ключевых сигнальных молекул [8]. Сфинголипиды широко изучаются в качестве внутри- и межклеточных регуляторов при различных видах клеточного стресса. Так, церамид, как вторичный мессенджер, вызывает остановку
роста и программированную гибель клеток. Показано участие церамида во всех известных механизмах инициации апоптоза [7]. Ранее нами было показано, что накопление церамида в различных тканях при стрессорных воздействиях существенно выше у животных с низкой устойчивостью к стрессу по сравнению с резистентными особями [1]. Апоптоз ганглиозных клеток сетчатки считается одним из ключевых звеньев развития глаукомной оптической нейропатии [6].
Цель исследования: оценить влияние психосоциального стресса на интенсивность дегенеративных изменений в сетчатке под действием эмоционального стресса.
Материалы и методы. Экспериментальные исследования проведены на 30 белых нелинейных крысах-самцах массой 180-220 г. с соблюдением всех регламентированных норм и правил этического обращения с лабораторными животными. Интенсивность дегенеративных изменений в сетчатке под действием эмоционального стресса оценивали гистологическими и иммуногистихимическими методами, также определяли содержание проапоптотического фактора церамида и его предшественника сфингомиелина в тканях заднего сегмента глаза и плазмы крови крыс методом тонкослойной хроматографии.
Для моделирования стресса 2-х месячных крыс на 2 месяца помещали в изолированные клетки при естественном световом режиме и свободном доступе к воде и пище. Перед помещением в условия изоляции, а также после нее животных тестировали согласно методу «открытого поля». По результатам тестирования были выделены 2 группы: стресс-устойчивые и стресс-неустойчивые (СУ и СН) крысы. После окончания периода изоляции животных ссаживали попарно с ежедневной сменой партнера. Проведено 2 серии опытов, в которых крысы подвергались воздействию 10-дневного (10 крыс) и 18-дневного (10 крыс) психосоциального стресса. 10 животных были интактными и послужили контролем. После окончания воздействий крыс выводили из эксперимента путем декапитации под тиопенталовым наркозом, глазные яблоки энуклеировали. Для гистологического и иммуногистохимического исследования глаза животных фиксировали в 10% нейтральном формалине 24 часа и использовали для приготовления парафиновых срезов согласно стандартному протоколу (Sennlaub F. et al., 2002). Срезы толщиной 5 мкм приклеивали на стекла с адгезивным покрытием (Silane-Prep Slides, Sigma). После депарафинирования для иммуногистохимического исследования срезы обрабатывали методом TUNEL (Terminal desoxynucleotidyl transferase – mediated desoxyuridine triphosphate (UTP) – nick end labeling). Использовали набор реактивов «Apoptag», Chemicon, США. В качестве субстрата для пероксидазы был применен диаминобензидин (DAB). Апоптотические ядра приобретали коричневое окрашивание. После реакции для дополнительного прокрашивания интактных ядер срезы обрабатывали 0,5% метиловым зеленым. Срезы для гистологического исследования окрашивали гематоксилином и эозином.
Для определения фракций сфинголипидов по экватору глазных яблок отсекали заднюю часть, из которой экстрагировали общие липиды смесью хлороформ/метанол 2:1 по Фолчу. Для разделения липидов на классы использовали метод восходящей хроматографии в тонком слое силикагеля по Boath et al. (2010). Использовали систему растворителей бутанол: ледяная уксусная кислота: вода (3:1:1) на пластинах фирмы «Merсk» с УФ индикатором (Германия). Пластины проявляли в парах кристаллического йода. Локализацию фракций на пластинах определяли с помощью «свидетелей» – стандартных хлороформенных растворов сфинголипидов фирмы Avanti polar lipids (CША). Расчет параметров и количественная оценка хроматограмм проводилась с помощью программы «Sorbfil TLC Videodensitometer».
В день получения материала забирали артериальную кровь, центрифугировали ее при 1000 об/мин в течение получаса для получения плазмы. Из 1 мл плазмы экстрагировали общие липиды смесью хлороформ/метанол 2:1 по Фол-чу и с помощью описанной выше методики восходящей тонкослойной хроматографии по Boath et al. (2010) разделяли липиды на классы. Количественную оценку хроматограмм (содер-жание в пятнах церамида и сфингомиелина) проводили так же, как описано выше. В другой порции плазмы (0,2 мл) определяли содержание 11-оксикортикостероидов по Резникову А.Г., 1980. Для оценки достоверности различий в группах использовали непараметрический критерий Манна-Уитни. Различия выборок считали статистически достоверными при р<0,05. Анализ зависимости между признаками проводили с помощью расчета r – коэффициент корреляции (r-критерия Спирмена).
Результаты и обсуждение. Иммуногистохимическое исследование сетчатки глаз позволило обнаружить у 2-х из 10-и животных опытной группы отдельные ТUNEL-положи-тельные ядра в ганглиозном слое сетчатки. В других слоях сетчатки апоптотических ядер выявлено не было. Таким образом, вовлеченными в апоптоз оказывались только ганглиозные клетки сетчатки, что может свидетельствовать об их большей уязвимости в сравнении с другими популяциями клеток ретины. Для определения интенсивности апоптоза в ходе гистологического исследования производили подсчет количества ядер ганглиозных клеток в срезах при увеличении ×400 от 300 мкм до 1300 мкм от края решетчатой пластинки (рис. 1). Как видно из диаграмм, количество ганглиозных клеток под действием зоосоциального стресса уменьшалось, что оказалось статистически значимым в группе СН крыс.
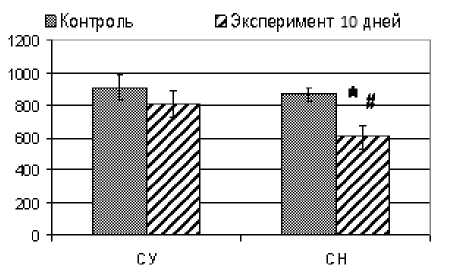
Рис. 1. Количество ядер ганглиозных клеток сетчатки сетчатки СУ и СН крыс при 10дневном зоосоциальном стрессе (*- p<0,05 в сравнении с контролем; # -p<0,05 – межгрупповые различия)
В контрольной серии содержание церамида и сфингомиелина у СН животных достоверно не отличалось от его количества в исследуемых тканях СУ крыс. Под действием 10 и 18 дневного психосоциального стресса как в заднем сегменте глаза, так и в плазме содержание церамида достоверно увеличилось в обеих группах в сравнении с контрольной, а количество сфингомиелина достоверно уменьшалось (табл. 1, 2). В группе СН животных увеличение оказалось более выраженным, чем в группе СУ крыс. Различия между типами животных в обеих сериях оказались достоверными (p<0,05).
Таблица 1. Сфинголипиды в заднем сегменте глаза у крыс с разной стресс-устойчивостью при психоциальном стрессе (в мкг на 1 мг)
|
Параметр |
Церамид |
Сфингомиелин |
||
|
СУ |
СН |
СУ |
СН |
|
|
контроль |
1,03±0,34 |
2,33±0,97 |
2,88±0,43 |
3,37±0,90 |
|
стресс (10 дней) |
4,47±0,90 * |
13,83±3,04 * # |
1,38±0,35 * |
0,50±0,10 * # |
|
стресс (18 дней) |
3,20±0,81 * |
6,10±1,30 * # |
1,77±0,20 * |
0,98±0,16 * # |
Примечание: здесь и далее *- p<0,05 в сравнении с контролем; # -p<0,05 – межгрупповые различия CУ – стрессоустойчивые, СН – стресснеустойчивые
Таблица 2. Сфинголипиды в плазме крови крыс с разной стресс-устойчивостью при психосоциальном стрессе (в мкг на 1 мл)
|
Параметр |
Церамид |
Сфингомиелин |
||
|
СУ |
СН |
СУ |
СН |
|
|
контроль |
0,034±0,007 |
0,041±0,009 |
0,021±0,004 |
0,016±0,0029 |
|
стресс (10 дней) |
0,072±0,01 * |
0,18±0,036 * # |
0,01±0,0018* |
0,004±0,0009* # |
|
стресс (18 дней) |
0,06±0,0087* |
0,132±0,027* # |
0,012±0,0011* |
0,008±0,0012* # |
Для выявления наличия или отсутствия связи между изменением содержания изучаемых фракций липидов в структурах заднего сегмента глаза и плазме артериальной крови был проведен корреляционный анализ. При сравнении содержания церамида в заднем сегменте глаза и плазме крови была выявлена сильная прямая зависимость, как у СУ, так и у СН животных (r=0,91 и r=0,88 соответственно, p<0,05). Это, по нашему мнению, может указывать на системный характер происходящего под действием стресса изменения обмена исследуемых сфинголипидов.
Аналогичная по силе и направленности зависимость наблюдалась и при сравнении содержания сфингомиелина в заднем сегменте глаз и плазме крови у обоих типов животных – СУ и СН (r=0,82 и r=0,87 соответственно, p<0,05), что может быть объяснено расходова-нием сфингомиелина в реакции образования церамида и также указывает на системность про-исходящих изменений. Сильная обратная зависимость с высоким уровнем достоверности была выявлена между содержанием церамида и сфингомиелина в тканях заднего сегмента глаз СУ и СН животных (r=- 0,91, p<0,05 и r=- 0,8, p<0,05 соответственно). Однако подобной достоверной связи не удалось обнаружить между содержанием церамида и сфингомиелина в плазме крови обоих типов животных, что, вероятно, может указывать на активность иных путей метаболизма церамида и сфингомиелина в разных тканях организма.
Это приводит к ослаблению корреляционных взаимосвязей на системном уровне.
Выводы: в эксперименте обнаружено нарастание содержания проапоптотического фактора – церамида, признаки дегенеративных изменений ганглиозного слоя сетчатки под действием зоосоциального стресса, зависящие от стресс-резистентности животных. Это позволяет предположить, что длительные повторные эпизоды стресса или тяжелое стрессовое воздействие может привести к более выраженным дегенеративным изменениям в сетчатке за счет накопления свободных радикалов, нейротоксических агентов (эксайтотоксичность) или за счет увеличения генерации церамида, способного активировать апоптоз клеток сетчатки [3, 5].
Исследование поддержано грантом ФГБУ «Фонд содействия развитию малых форм предприятий в научно-технической сфере» №0002918.
Список литературы Влияние хронического психосоциального стресса на интенсивность дегенеративных изменений в сетчатке у крыс с различной стресс-резистентностью
- Брындина, И.Г. Церамиды скелетных мышц, печени и легких грызунов при хроническом эмоциональном стрессе и моделированной невесомости/И.Г. Брындина, М.Р. Багаутдинов, Н.Н. Васильева и др.//Вестник Уральской медицинской академической науки. 2012. № 2(39). С.108-109.
- Судаков, К.В. Индивидуальность эмоционального стресса//Журнал неврологии и психологии. 2005. Т. 105, № 2. С. 4-12.
- Barak, A. Laser induces apoptosis and ceramide production in human retinal pigment epithelial cells/A. Barak, T. Goldkorn, L.S. Morse//Invest. Ophthalmol. Vis. Sci. 2005. Vol. 46. P. 2587-2591.
- Chida, Y. A bidirectional relationship between psychosocial factors and atopic disorders: A systematic review and meta-analysis/Y. Chida, M. Hamer, A. Steptoe//Psychosom. Med. 2008. Vol. 70. P. 102-116.
- Nora, P. Regulating survival and development in the retina: key roles for simple sphingolipids/P. Nora, E. Gisela, E. Carolina, O. German//J. Lipid Res. 2010. Vol. 51, № 6. P. 1247-1262
- Quigley, H.A. Neuronal death in glaucoma//Prog. Retin. Eye Res. 1999. Vol. 18. P. 39-57.
- Sanvicens, N. Ceramide is the key mediator of oxidative stress-induced apoptosis in retinal photoreceptor cells/N. Sanvicens, T. G. Cotter//J. Neurochem. 2006. Vol. 98. P. 1432-1444.
- Schenck, M. Ceramide: Physiological and pathophysiological aspects/M. Schenck et al.//Arch Biochem Biophys. 2007. Vol. 462. P. 171-175.


