Влияние экзогенного глюкокортикоида на активность прооксидантных и антиоксидантных ферментов и количество ядросодержащих клеток иммунных органов у крыс с различными фенотипами микросомального окисления
Автор: Цейликман Ольга Борисовна, Мишарина Мария Евгеньевна, Батуева Альбина Эмильевна, Деев Роман Владимирович, Абрамовких Ольга Сергеевна, Комелькова Мария Владимировна, Лапшин Максим Сергеевич, Никитина Анна Александровна, Мекешкин Евгений Анатольевич, Горбачева Юлия Владимировна, Солодков Александр Петрович, Лазуко Светлана Степановна
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 4 т.13, 2013 года.
Бесплатный доступ
Исследованы особенности уровня активности прооксидантных и антиоксидантных ферментов крови у крыс при введении экзогенного глюкокортикоида. В ходе исследования, в зависимости от продолжительности гексеналового сна, животных разделяли на быстрых и медленных метаболизеров. В изученных образцах определены основные параметры активности прооксидантных и антиоксидантных ферментов, чувствительность лимфоидной ткани к действию экзогенных глюкокортикоидов. Показано, введение экзогенного глюкокортикоида привело к снижению активности глутатионтрансферазы в крови у быстрых метаболизеров, что отражает способность глюкокортикоидов осуществлять негативную регуляцию биотрансформации ксенобиотиков. У медленных метаболизеров после введения триамциналона ацетонида имеется дисбаланс между прооксидантными и антиоксидантными системами.
Прооксидантная и антиоксидантная системы, быстрые и медленные метаболизеры, гексенал
Короткий адрес: https://sciup.org/147153183
IDR: 147153183 | УДК: 616-092.8
Текст научной статьи Влияние экзогенного глюкокортикоида на активность прооксидантных и антиоксидантных ферментов и количество ядросодержащих клеток иммунных органов у крыс с различными фенотипами микросомального окисления
Введение. В настоящее время данные по глю-кокортикоид-зависимой регуляции свободно-радикального окисления в условиях стресса весьма противоречивы. С одной стороны, имеются данные о глюкокортикоид-зависимом усилении свободно-радикального окисления в условиях стресса. Установлено, что введение кортикостерона как в высоких, так и в низких дозах cопровождается угнетением активностей супероксиддисмутазы (СОД), каталазы, глутатионтрансферазы и глутатионре-дуктазы, при одновременном увеличении окисления белков в мозге, печени и сердце [8]. С другой стороны, имеются данные противоположного характера о том, что стрессорные воздействия с повышенным содержанием кортикостерона приводят к снижению в печени перекисного окисления липидов, при одновременном увеличении экспрессии СОД, каталазы, глутатионредуктазы и глутатионпероксидазы, при одновременном снижении экспре-сии транскрипционного фактора NF-kB [6]. Поэтому целью нашей работы является изучение глю-кокортикоид-зависимого изменения соотношения между прооксидантными и антиоксидантными системами при введении экзогенного глюкокортикоидного препарата – триамцинолона ацетонида (ТА).
Методика. Состояние микросомального окисления оценивали по «времени гексеналового сна», с помощью теста «гексеналовый сон» [4]. Гексенал вводили внутрибрюшинно в виде 5 % водного раствора из расчета 60 мг на 1 кг массы. Длительность сна оценивали по времени нахождения животных в боковом положении. Окончанием сна считали момент восстановления рефлекса переворачивания. Это позволило по скорости метаболизма гек-сенала разделить особей на фенотипические группы по каталитической активности изоформ цитохрома Р-450 зависимых монооксигеназ. Каталазную активность определяли по методу [2]. Активность миелопероксидазы определялась по методу [3]. Определение активности ксантиноксидазы в гомогенатах почек и сыворотке крови производилось по методу [7]. Активность глутатионтрансферазы определялась по методу С.Н. Власовой и соавт. [1]. Содержание кариоцитов в тимусе и селезенки рассчитывали на весь орган, на 1 мг массы органа и на 1 г массы тела [5].
Результаты обрабатывались общепринятыми методами вариационной статистики и выражались в виде среднеарифметической (М) и ее стандартной ошибки (м).
Статистические взаимосвязи изучали при помощи непараметрического корреляционного анализа, выполняя расчет коэффицентов корреляции рангов по Спирмену(r s ). Для обработки результатов исследования использован пакет прикладных программ Statistica 6.0 for Windows.
Результаты исследования и их обсуждение.
В зависимости от продолжительности гексенало-вого сна (см. рисунок) животные в ходе исследования были разделены на быстрых метаболизеров (БМ) и медленных метаболизеров (ММ).
Причем эти группы существенно отличаются друг от друга по массе печени. Это проявлялось в более высоком массовом индексе печени у быстрых мин
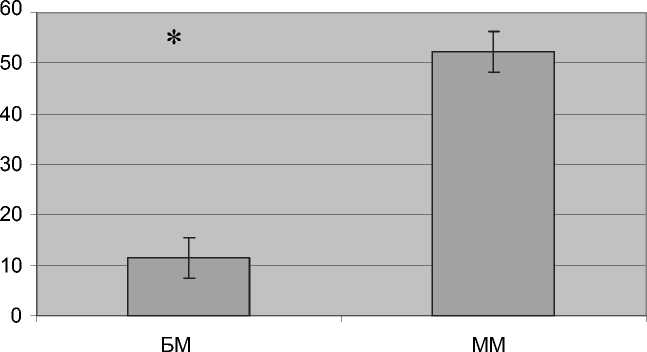
Продолжительность гексеналового сна у быстрых и медленных метаболизеров (обработка произведена с использованием непараметрического критерия Манна–Уитни)
метаболизеров (3,1 ± 0,14) по сравнению с медленными метаболизерами (2,21 ± 0,25; P = 0,042U). Важно отметить, что у быстрых метаболизеров обнаружена отрицательная корреляция между продолжительностью гексеналового сна и значением массового индекса печени (Rs = –0,767; P = 0,018). Вероятно, более высокое значение массового индекса печени у быстрых метаболизеров отражает более высокую мощность микросомального окисления. В пользу этого предположения косвенно свидетельствует то, что между медленными и быстрыми метаболизерами обнаружены различия по уровню активности печёночной глу-татионтрансферазы, играющей существенную роль в метаболизме ксенобиотиков. Так быстрые мета-болизеры характеризовались более высоким уровнем ферментативной активности по сравнению с медленными.
Важно отметить, что у быстрых метаболизе-ров обнаружена отрицательная корреляция между продолжительностью гексеналового сна и уровнем активности глутатионтрансферазы печени (Rs = = –0,825; P = 0,012). Помимо этого, высокий уровень глутатионтрансферазной активности у быстрых метаболизеров по сравнению с медленными обнаружен в крови. Возможно, у быстрых метабо-лизеров более высокие аэробные возможности в целом, что ассоциируется с более высоким уровнем активности прооксидантных ферментов и вследствие этого и более высоким уровнем антиоксидантной защиты. Это предположение подтверждается полученными нами результатами. Так в крови быстрых метаболизеров обнаружен более высокий уровень активности антиоксидантных ферментов: глутатионпероксидазы и каталазы, а также прооксидантных ферментов ксантиноксида-зы и миелопероксидазы (табл. 1).
При введении экзогенного глюкокортикоида триамцинолон ацетонида (ТА) нивелировались различия между быстрыми и медленными метабо- лизерами по активности прооксидантных и антиоксидантных ферментов. Это означает, что ТА у быстрых метаболизеров вызывал более резкое падение ферментативной активности, чем у медленных. Это особенно наглядно проявляется в случае ксантиноксидазы, где введение ТА привело к снижению активности в 4 раза у медленных метаболи-зеров и в 15 раз – у быстрых. В 3 раза снижена активность глутатионтрансферазы у медленных метаболизеров и в 7 раз – у быстрых. Кроме того, у быстрых метаболизеров наблюдалось двухкратное снижение активности каталазы в крови, в то время как у медленных метаболизеров после введения ТА активность этого антиоксидантного фермента снизилась в 15 раз. Активность каталазы у быстрых метаболизеров снижалась также более отчетливо по сравнению с медленными метаболи-зерами. Основным атрибутивным признаком ТА считается вызываемая им гипоплазия иммунных органов (табл. 2).
Наши исследования показали, что этот феномен одинаково эффективно воспроизводился как у быстрых, так и у медленных метаболизеров. При этом между ними не были обнаружены исходные фоновые различия. Их отсутствие может означать, что уровень микросомального окисления не оказывает непосредственное влияние на процессы, определяющие численность клеток в иммунных органах, то есть на соотношение между уровнем пролиферации и апоптоза, а также клеточной миграцией.
Выводы
-
1. Введение экзогенного глюкокортикоида нивелирует различия между быстрыми и медленными метаболизерами по активности проокси-дантных и антиоксидантных ферментов крови.
-
2. Фенотип микросомального окисления не оказывает влияния на чувствительность лимфоидной ткани к гипоплазирующему действию экзогенных глюкокортикоидов.
Проблемы здравоохранения
Таблица 1
Уровень активности прооксидантных и антиоксидантных ферментов крови у быстрых и медленных метаболизеров
|
Показатель |
Медленные метаболизеры (n = 18) |
Быстрые метаболизеры (n = 18) |
Медленные метаболизеры +ТА (n = 6) |
Быстрые метаболизеры + ТА (n = 6) |
|
Каталаза, кат/мл/мин |
5,97 ± 0,86 |
18,64 ± 0,45* |
0,35 ± 0,045** |
9,36 ± 0,89** |
|
Глутатионпероксидаза, мкМ/г Нв/мин |
7,71 ± 0,46 |
9,28 ± 1,56 |
1,47 ± 0,45* |
1,58 ± 0,67* |
|
Глутатион-трансфераза, мкМ/г Нв/мин |
10,11 ± 1,91 |
22,95 ± 2,62* |
3,6 ± 0,45* |
3,09 ± 0, 8* |
|
Ксантино-оксидаза, мкМ/мл/мин |
6,67 ± 0,66 |
19,3 ± 1,78* |
1,17 ± 0,14* |
1,14 ± 0,69* |
|
Миелопероксидаза, мкМ/л/мин |
37,65 ± 2,16 |
47,63 ± 3,19 * |
33,15 ± 3,23 |
30,17 ± 1,41 * |
Примечание. Здесь и в табл. 2 статистическая обработка проведена с использованием критериев Манна–Уитни, Вольда–Вольфовица, различия считали статистически значимыми при р > 0,05; статистически значимые различия между группами: * – «медленные метаболизеры» и «быстрые метаболизеры», ** – «триамциналона ацетонид» и «медленные метаболизеры», «триамциналона ацетонид» и «быстрые метаболизеры».
Таблица 2
Влияние триамцинолона ацетонида на содержание ядросодержащих клеток в иммунных органах
|
Показатель |
Медленные метаболизеры |
Быстрые метаболизеры |
Медленные метаболизеры +ТА (n = 6) |
Быстрые метаболизеры + ТА (n = 6) |
|
ЯСК тимуса (×106 клеток) |
232,5 ± 28,4 |
235,34 ± 19,25* |
122,65 ± 24,43** |
125,7 ± 47,5 |
|
ЯСК селезенки (×106 клеток) |
395,62 ± 44,65 |
383,49 ± 25,13* |
213,28 ± 36,88** |
233,7 ± 30,81 |
|
ЯСК костного мозга |
81,7 ± 3,82 |
87,75 ± 5,34 |
65,0 ± 2,73** |
67,5 ± 1,73** |
Исследование выполнено при поддержке Министерства образования и науки Российской Федерации, соглашение 14.B37.21.0578 от 10.08.2012.
Список литературы Влияние экзогенного глюкокортикоида на активность прооксидантных и антиоксидантных ферментов и количество ядросодержащих клеток иммунных органов у крыс с различными фенотипами микросомального окисления
- Власова, С.Н. Активность глутатионзависимых ферментов в эритроцитах при хронических заболеваниях печени у детей/С.Н. Власова, Е.И. Шабунина, И.А. Переслегина//Лаборатор. дело. -1990. -№ 8. -С. 19-22.
- Метод определения активности каталазы/М.А. Королюк, Л.И. Иванов, М.Г. Майорова, B.Е. Токарева//Лаборатор. дело. -1988. -№ 1. -C. 16-19.
- Симаков, П.В. Миелопероксидаза модификация метода/П.В. Симаков//Санитария и гигиена. -1971. -№ 10. -C. 89-91.
- Сперанский, С.В. Оценка избирательности токсических поражений с помощью гексеналовой пробы/С.В. Сперанский, Г.Г. Кравшева//Гигиена окружающей среды. -1980. -№ 28. -С. 80-85.
- Экспериментальное моделирование и лабораторная оценка адаптационных реакций организма/И.А. Волчегорский, И.И. Долгушин, О.Л. Колесников, В.Э. Цейликман. -Челябинск, 2000. -167 с.
- Chronic stress differentially affects antioxidant enzymes and modifies the acute stress response in liver of Wistar rats/J. Djordjevic, A. Djordjevic, M. Adzic et al.//Physiol Res. -2010. -Vol. 59 (5). -P. 729-736.
- Hashimoto, S. A new spectrophotometric Assay Method of Xantineoxidase in Grude Tissue Homogenate/S. Hashimoto//Analytical biochemistry. -1974. -Vol. 62. -P. 426-435.
- Zafir, A. Modulation of in vivo oxidative status by exogenous corticosterone and restraint stress in rats/A. Zafir, N. Banu//Stress. -2009. -Vol. 12 (2). -P. 167-177.


