Влияние концентратного типа кормления на выработку метана у овец
Автор: Зеленченкова А.А., Боголюбова Н.В., Колесник Н.С., Вьючная П.С., Лахонин П.Д., Гладырь Е.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Зоотехния и ветеринария
Статья в выпуске: 6, 2024 года.
Бесплатный доступ
Цель исследования - изучить влияние рационов с разным уровнем концентратов на образование метана в организме овец. В статье представлены исследования на овцах романовской породы с фистулами рубца в условиях физиологического двора ВИЖ им. Л.К. Эрнста. Эксперимент проведен методом групп периодов. В первый период овцы получали сено-концентратный рацион с содержанием 20 % концентратов, во второй - 30 % концентратов, в третий - 40 % концентратов по питательности. Рационы для животных были сбалансированы по питательной и энергетической ценности, уровню минеральных веществ согласно нормам. В результате установлено, что при вводе 20, 30 и 40 % концентратов в рацион овец количество выделенного CH4 составило 21,10; 17,88 и 15,88 л/сут соответственно, т. е. повышение концентратной части рациона в 2 раза способствует снижению выработки CH4 в ЖКТ в 1,33 раза. Показатель pH рубца при рационе с вводом 20 % (p ≤ 0,01), 30 и 40 % концентратов снижался через 3 часа после кормления, до кормления между первым и третьим периодом уровень pH понизился с 6,71 до 6,25 (p ≤ 0,05); количество кислых метаболитов (ЛЖК) увеличивалось с 6,65 до 7,21 Ммоль/100 мл до кормления и с 7,63 до 8,45 Ммоль/100 мл через три часа после кормления; амилолитическая активность рубца после кормления постепенно увеличивалась с 12,73 до 14,21 при смене рациона на более концентрированный. С увеличением уровня концентратов снизилось количество метаногенов Methanobrevibacter smithii, Methanosphaera stadtmanae как в рубце, так и в толстом отделе кишечника.
Питание, овцы, концентраты, микробиом, метаногены, парниковые газы, метан, метаболизм
Короткий адрес: https://sciup.org/140306724
IDR: 140306724 | УДК: 636.32+636.38+612.22 | DOI: 10.36718/1819-4036-2024-6-94-100
Текст научной статьи Влияние концентратного типа кормления на выработку метана у овец
Введение. В процессе ферментации корма в рубце образуются газы, основные из которых углекислый газ (СO 2 ), метан (CH 4 ), водород (H 2 ), азот (N 2 ) и сероводород (H 2 S). Метан является естественным побочным продуктом микробной ферментации углеводов и в меньшей степени аминокислот в рубце. Синтез метана предположительно служит для выравнивания окислительно-восстановительного баланса, и его выход может варьироваться у разных животных, несмотря на одинаковые условия кормления [1].
Метан играет важную роль в круговороте углерода в природных средах, и его преоб- ладающим источником является продукция метаногенных архей [2]. Большинство метаногенов удаляют газообразный водород путем восстановления CO2 газообразным H2 с образованием метана [3]. Синтез метана позволяет избежать накопления H2, который подавляет нормальную функцию микробных ферментов, участвующих в переносе электронов [4]. Предполагалось, что если бы жвачные животные вовсе не производили метан, то pH рубца неуклонно бы снижался и ухудшилось бы переваривание клетчатки [5].
При увеличении количества концентратов (особенно содержащих крахмал) в рационе снижается количество целлюлозолитических бактерий и увеличивается количество амилолитических бактерий за счет изменения соотношения субстратов [6, 7]. Из-за изменения соотношения летучих жирных кислот (ЛЖК) уменьшается количество водорода, доступного метаногенным археям, и снижается pH рубца, что еще больше ингибирует (снижает) популяции целлюлозолитических бактерий, простейших и метаногенов [8, 9].
Если бы метаногенез был ингибирован и доступный H 2 был перенаправлен на альтернативные метаболические пути, дающие энергию, можно было бы ожидать увеличения продуктивности. Таким образом, снижение выработки CH 4 потенциально может улучшить продуктивность при том же энергетическом потреблении животным, при условии, что метаболизм в рубце не будет нарушен.
Цель исследования – изучить влияние рационов с разным уровнем концентратов на образование метана в организме овец.
Объект, материал и методы. Исследование было проведены методом групп-периодов на овцах романовской породы в возрасте 2 лет, в количестве 6 голов с живой массой 36–42 кг, с хроническими фистулами рубца по Басову в условиях физиологического двора ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста.
Животным 1-го периода скармливали 20 % концентратов, 2-го – 30, 3-го периода 40 % концентратов. Основной рацион (ОР) соответствовал по показателям энергетической и питательной ценности требованиям для данного возрастного и весового показателя животных (Калашников А.П. и др., 2003). Анализ показателей рубцовой ферментации проводили в отделе физиологии и биохимии ВИЖ им Л.К. Эрнста.
Для характеристики рубцового пищеварения у животных брали пробы содержимого рубца за 1 ч до кормления и через 3 ч после кормления для определения следующих показателей: рН, общее количество ЛЖК – методом паровой дистилляции в аппарате Маркгама; амилолитическая активность – фотометрическим методом.
В конце каждого балансового опыта у всех животных (n = 6) отбирались пробы рубцового и содержимого толстого отдела кишечника для генетического исследования толстокишечной и рубцовой микробиоты. Использовали метод
ПЦР-РВ с флуоресцентной детекцией. Для этого применяли комплект реагентов «Колоноф-лор-16 (премиум)» ООО «Альфалаб» (Россия, г. Санкт-Петербург) в соответствии с инструкцией производителя в модицификации лаборатории фундаментальных основ питания сельскохозяйственных животных и рыб ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста при сотрудничестве с лабораторией молекулярной генетики сельскохозяйственных животных ФГБНУ ФНЦ ВИЖ им. Л.К. Эрнста.
Интерпретацию результатов амплификации осуществляли с использованием программного обеспечения, входящего в состав набора «Ко-лонофлор-16 (премиум)», согласно инструкции производителя.
Выделение метана учитывалось в метаболических камерах открытого типа. Для изучения газообразования животное помещалось в камеру и содержалось в ней в течение 2 смежных суток. Камеру открывали в 9-00 и 16-00 для раздачи концентрированных и грубых кормов.
Полученные в опыте материалы обработаны биометрически с использованием метода дисперсионного анализа (ANOVA), посредством программы STATISTICA, version 13 Ru, StatSoft, Inc., 2011 (. При этом вычислены следующие величины: среднеарифметическая (М), среднеквадратическая ошибка (±m) и уровень значимости (р). Результаты исследований считали высокодостоверными при р ≤ 0,001 и достоверными при р ≤ 0,01 и р ≤ 0,05. При р ≤ 0,1 до р ≥ 0,05 – тенденция к достоверности полученных данных. При р ≥ 0,1 разницу считали недостоверной.
Результаты и их обсуждение. Высокий уровень концентратов в рационах (свыше 50 %) взрослых жвачных является физиологически противоестественным, так как нарушает процессы рубцового пищеварения и повышает заболеваемость [10].
В наших исследованиях показатели рубцового метаболизма у исследуемых овец отображены в таблице 1.
В текущем эксперименте pH при рационе с вводом 20 % (p ≤ 0,01), 30 и 40 % концентратов снижался через 3 ч после кормления. Также наблюдается постепенное повышение кислотности рубцового содержимого до кормления между первым и третьим периодом, где уровень pН понизился с 6,71 до 6,25 (p ≤ 0,05). Помимо снижения pН, можно отметить увеличение количества кислых метаболитов (ЛЖК) с 6,65 до 7,21 Ммоль/100 мл до кормления и с 7,63 до 8,45 Ммоль/100 мл через 3 ч после кормления.
Образование ЛЖК в рубце тесно связано с производством метана [11]. ЛЖК могут оказать влияние на снижение pH ферментации до уров- ня ниже 6,0, тем самым подавляя пролиферацию метаногенных микроорганизмов. Правильное распределение ЛЖК для различных физиологических процессов обеспечивает эффективное использование энергии и поддерживает рост, воспроизводство, продуктивность и выбросы метана [12].
Таблица 1
Показатели рубцового метаболизма у овец (n = 6)
|
Группа |
Время взятия проб |
|
|
до кормления |
3 ч после кормления |
|
|
Показатель pH |
||
|
20 % концентратов |
6,71 ± 0,09 |
6,28 ± 0,09** |
|
30 % концентратов |
6,68 ± 0,07 |
6,31 ± 0,16 |
|
40 % концентратов |
6,25 ± 0,08* |
6,26 ± 0,04 |
|
ЛЖК, Ммоль/100мл |
||
|
20 % концентратов |
6,65 ± 0,47 |
7,63 ± 0,58 |
|
30 % концентратов |
6,80 ± 0,39 |
7,99 ± 0,46 |
|
40 % концентратов |
7,21 ± 0,33 |
8,45 ± 0,13 |
|
Амилолитическая активность, Е/мл |
||
|
20 % концентратов |
12,73 ± 0,66 |
|
|
30 % концентратов |
13,00 ± 1,03 |
|
|
40 % концентратов |
14,21 ± 0,33 |
|
*р ≤ 0,05;**р ≤ 0,01.
Таким образом, в нашем исследовании по мере повышения процента концентратов в рационе 2-летних овец повышается кислотность рубцовой жидкости в пределах нормы и общее количество летучих жирных кислот, что применимо при концентрированном типе кормления.
Амилолитические бактерии, в основном стрептококки, представлены в рубце многочисленной группой. В наших опытах амилолитическая активность рубца после еды постепенно увеличивалась с 12,73 до 14,21 при смене рациона на более концентрированный.
Производство метана в рубце в первую очередь связано с метаболической активностью метаногенных архей, вырабатывающих метан в качестве побочного продукта. Основные виды метаногенных архей: Methanobrevibacter smithii , Methanosphaera stadtmanae , Methanomirobium mobile и Methanosarcina spp. [13]. Эти археи используют H 2 , CO 2 и метанол для синтеза метана [14, 15].
В наших исследованиях с увеличением уровня концентратов снижается количество Metha-nobrevibacter smithii , Methanosphaera stadtmanae как в рубце, так и в кишечнике (рис. 1).
Наиболее зависящими от концентратного типа кормления оказались Methanobrevibacter smithii. Их количество заметно сократилось в рубцовом содержимом при вводе 40 % концентратов, а в кишечном содержимом начиная с ввода 30 и 40 % концентратов. Methanosphaera stadtmanae оказались более устойчивыми к повышению уровня вводимых концентратов, что требует дальнейшего изучения.
Изучение выделения метана из организма овец при различном уровне концентратов в рационе показало, что при увеличении доли концентрированных кормов снижается выделение метана и углекислого газа из организма животных в результате количественного изменения метаногенов в ЖКТ овец (табл. 2).
1,00E+10
1,00E+09
1,00E+08
1,00E+07
1,00E+06
1,00E+05
1,00E+04
1,00E+03
1,00E+02
1,00E+01
1,00E+00
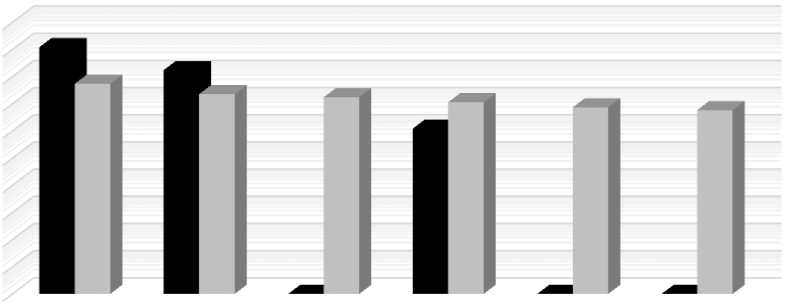
Рубцовое Рубцовое Рубцовое Кишечное Кишечное Кишечное сод. 20% сод. 30% сод. 40% сод. 20% сод. 30% сод. 40% конц.
конц.
конц.
конц.
конц.
конц.
-
■ Methanobrevibacter smithii
-
■ Methanosphaera stadmanae
Содержание метаногенов
Таблица 2
Выделение метана из организма овец при различных уровнях концентратов в рационе
|
Группа |
Выделение СН 4 , л/сут |
|
20 % концентратов |
21,10±0,33 |
|
30 % концентратов |
17,88±0,35 |
|
40 % концентратов |
15,88±0,15 |
При вводе 20, 30 и 40 % концентратов в рацион овец количество выделенного СН 4 составило 21,10; 17,88 и 15,88 л/сут соответственно. Повышение концентратной части рациона в 2 раза способствует снижению выработки СН 4 ЖКТ в 1,33 раза.
Заключение. Увеличение в рационах романовских овец концентратов оказало влияние на рубцовое пищеварение: показатель pH при рационе с вводом 20 % (p ≤ 0,01), 30 и 40 % концентратов снижался через 3 ч после кормления, до кормления между первым и третьим периодом уровень pН понизился с 6,71 до 6,25 (p ≤ 0,05); количество кислых метаболитов (ЛЖК) увеличивалось с 6,65 до 7,21 Ммоль/100 мл до кормления и с 7,63 до 8,45 Ммоль/100 мл через 3 ч после кормления; амилолитическая активность рубца после еды постепенно увеличивалась с 12,73 до 14,21 при смене рациона на более концентрированный. Повышение в рационах овец концентратов с 20 до 40 % способствует снижению выработки СН 4 ЖКТ в 1,33 раза за счет снижения количества метаногенов Metha-nobrevibacter smithii , Methanosphaera stadtmanae как в рубце, так и в кишечнике.
Список литературы Влияние концентратного типа кормления на выработку метана у овец
- Samal L., Dash S.K. Nutritional Interventions to Reduce Methane Emissions in Ruminants // Animal Feed Science and Nutrition-Production, Health and Environment. IntechOpen, 2022. DOI: 10.5772/intechopen.101763.
- Hydrogenotrophic methanogenesis in archaeal phylum Verstraetearchaeota reveals the shared ancestry of all methanogens / B.A. Ber-ghuis [et al.] // Proceedings of the National Academy of Sciences. 2019. № 11. P. 50375044.
- The rumen microbiome: a crucial consideration when optimising milk and meat production and nitrogen utilisation efficiency / C. Matthews [et al.] // Gut microbes. 2019. № 2. P. 115-132. DOI: 10.1080/19490976.2018.1505176.
- Microbial ecosystem and methanogenesis in ruminants / D.P. Morgavi [et al.] // Animal. 2012. № 5. P. 1024-1036. DOI: 10.1017/S175173111 0000546.
- Methane inhibition alters the microbial community, hydrogen flow, and fermentation response in the rumen of cattle / G. Martinez-Fernandez [et al.] // Frontiers in Microbiology. 2016. № 7. P. 1122. DOI: 10.3389/fmicb.2016. 01122.
- Subacute ruminal acidosis challenge changed in situ degradability of feedstuffs in dairy goats / F. Li [et al.] // Journal of Dairy Science. 2014. № 8. P. 5101-5109. DOI: 10.3168/jds. 2013-7676.
- Characterization of rumen bacterial diversity and fermentation parameters in concentrate fed cattle with and without forage / R.M. Petri [et al.] // Journal of Applied Microbiology. 2012. № 6. P. 1152-1162. DOI: 10.1111/j. 1365-2672.2012.05295.x.
- Enteric methane mitigation strategies in ruminants: a review / Ribeiro L.G. Pereira [et al.] // Revista Colombiana de Ciencias Pecuarias. 2015. № 2. P. 124-143. DOI: 10.17533/udea. rccp.v28n2a02.
- Enteric methane mitigation interventions / J.Q. Fouts [et al.] // Translational Animal Science. 2022. № 2. txac041. DOI: 10.1093/ tas/txac041.
- Погосян Д.Г., Гаджимусаев Р.С. Физиологические особенности молодняка овец при раннем интенсивном откорме // Проблемы биологии продуктивных животных. 2017. № 3. С. 77-86.
- Measuring methane production from ruminants / J. Hill [et al.] // Trends in Biotechnology. 2016. № 1. P. 26-35.
- González L.A., Kyriazakis I., Tedeschi L.O. Review: Precision nutrition of ruminants: Approaches, chalenges and potential // Animal. 2018. P. 246-261.
- Archaea are interactive components of complex microbiomes / C. Moissl-Eichinger [et al.] // Trends Microbiol. 2018. Vol. 26. P. 70-85.
- Welander, P.V., Metcalf, W.W. Loss of the mtr operon in Methanosarcina blocks growth on methanol, but not methanogenesis, and reveals an unknown methanogenic pathway // Proc. Natl. Acad. Sci. USA. 2005. Vol. 102. P. 10664-10669.
- Diverse hydrogen production and consumption pathways influence methane production in ruminants / C. Greening [et al.] // ISME J. 2019. Vol. 13. P. 2617-2632.


