Влияние модулированных ex vivo аминазином иммунокомпетентных клеток на гемопоэз при агрессии
Автор: Маркова Е.В., Серенко Е.В., Топоркова Л.Б., Княжева М.А., Савкин И.В., Гойман Е.В., Орловская И.А.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 3 (120), 2023 года.
Бесплатный доступ
Актуальность. Следствием пролонгированного стресса, включая хронический социальный стресс, являются тревога и агрессивное либо депрессивно-подобное поведение. Нейроэндокринные сигналы, формирующиеся при длительном социальном стрессе, обусловливают активацию миелопоэза, что сопровождается усиленной миграцией моноцитов из костного мозга на периферию и приобретением ими «воспалительного» М1-фенотипа. Часть таких моноцитов мигрирует также в головной мозг, активируя эндотелиальные клетки и микроглию, что приводит к формированию нейровоспалительного статуса и изменению поведения. Ранее нами были получены приоритетные данные о возможности редактирования паттернов агрессивного поведения модулированными ex vivo аминазином сингенными иммунокомпетентными клетками и показаны цитокин-опосредованные механизмы этого эффекта.
Экспериментальные животные, агрессивное поведение, иммунокомпетентные клетки, аминазин, гемопоэз, костный мозг, периферическая кровь
Короткий адрес: https://sciup.org/142239809
IDR: 142239809 | УДК: 615.015.4:615.214:57.084-1:612.41:591.111.1 | DOI: 10.26617/1810-3111-2023-3(120)-12-20
Текст научной статьи Влияние модулированных ex vivo аминазином иммунокомпетентных клеток на гемопоэз при агрессии
Известно, что в результате хронического социального конфликта формируется аберрантное поведение, в частности агрессивное [1, 2], сопровождающееся перераспределением субпопуляций лимфоцитов в костном мозге в сторону увеличения количества СD4+-клеток при снижении количества СD8+-клеток [3], активацией миелопоэза, усилением миграции костномозговых клеток моноцитарного ряда на периферию и приобретением ими «воспалительного» фенотипа [4]. Приводятся данные, что этому способствует высокое содержание в крови у агрессивных животных одного из ключевых хемокинов, регулирующего миграцию моноцитов – моноцитарного хемоаттрактантного протеина (МСР-1) [3]. Более того, хемокины, включая МСР-1, представлены не только в иммунной системе, но и в мозге, где они могут играть роль нейромодуляторов [5]. Считается доказанным, что костномозговые моноциты способны мигрировать также и в головной мозг с последующей дифференцировкой в макрофаги М1-фенотипа, обладающие провоспалительной активностью [6, 7, 8]. Их воздействие на эндотелиальные клетки, нейроны и микроглию обусловливает повышенную продукцию цитокинов, хе-мокинов, молекул адгезии, что создает условия для ускорения аккумуляции мигрирующих в мозг костномозговых моноцитов. В этой парадигме резидентным иммунным клеткам (микроглии)
отводится роль источника нейровоспалительных сигналов [8, 9].
Активация микроглии с повышением продукции в мозге провоспалительных цитокинов, ключевых регуляторов настроения и поведения, изменяет нейрохимическую установку мозга, влияет на нейропластичность, а также индуцирует нейроэндокринные сигналы, модулирующие функционирование центральных и периферических иммунных органов [3, 10, 11]. Так, симпатическая нервная система, регулирующая физические реакции на ситуации борьбы/бегства, иннервирует ниши гемопоэтических стволовых клеток, расположенные в костном мозге и лимфоидных органах, с модуляцией дифференцировки и высвобождения лейкоцитов посредством в" адренорецепторного механизма [10, 12]. При этом гипоталамо-гипофизарно-надпочечниковая и ги-поталамо"гипофизарно"гонадная системы находятся между собой в антагонистических взаимодействиях, в силу чего нейробиологический профиль взаимоотношений данных систем смещается в сторону дисбаланса либо с высоким уровнем тестостерона и низким уровнем кортизола, либо с высоким уровнем кортизола и низким уровнем тестостерона.
В литературе приводятся убедительные сведения о том, что тестостерон и кортизол оказывают влияние на социальную агрессию [13, 14, 15, 16, 17]. В частности, показана отрицательная корреляционная связь между уровнем кортизола и показателями общей агрессии на различных когортах лиц [14]. Кроме того, высокие концентрации кортизола способны подавлять синтез серотонина и серотониновых рецепторов 1-го типа [18], что согласуется с данными об ингибирующем влиянии многократного опыта агрессии у самцов на серотонинергическую систему с тотальной активацией дофаминергической системы [1, 3, 10, 19], и может быть механизмом регистрируемых при этом изменений иммунологического статуса. Так, обнаружено, что базальное содержание Т-лимфоцитов и их субпопуляций (CD8 + и CD4 + ) у агрессивных и неагрессивных животных существенно различается. При этом агрессивная линия крыс по сравнению с неагрессивными имеет более высокий индекс реактивности (отношение CD4 + /CD8 + Т-лимфоцитов) в крови и селезенке, обусловленный пониженным содержанием CD3 + CD8 + Т-лимфоцитов, повышенную иммунную реактивность, проявляющуюся усилением цитотоксической активности NK-клеток селезенки, пролиферативного ответа спленоцитов на Т-зависимый антиген и гуморального иммунного ответа [3, 10].
Важным звеном, объединяющим функционирование нервной, иммунной и эндокринной си- стем, являются также цитокины, оказывающие влияние как на активность симпатической, гипо-таламо-гипофизарно-надпочечниковой и гипота-ламо-гипофизарно-гонадной систем, так и на центральные нейромедиаторные системы, включенные, как указывалось выше, в нейробиологиче-ские механизмы агрессивного поведения и играющие важную роль в психонейроиммуномодуля-ции [3, 10, 11, 20, 21, 22, 23]. Установлена прямая корреляционная связь между уровнями медиаторов воспаления и выраженностью агрессивного поведения [24]. С этими данными согласуются результаты собственных исследований, согласно которым при формировании агрессивной стратегии поведения в отдельных структурах головного мозга увеличиваются уровни провоспалительных цитокинов IL-1e, IL-2 и IL-6, а редактирование агрессивного поведения модулированными ex vivo аминазином сингенными спленоцитами сопровождается снижением нейровоспаления [25, 26, 27, 28]. При этом у агрессивных реципиентов показана также модуляция продукции цитокинов периферическими иммунокомпетентными клетками, что проявилось в снижении стимулированной митогенами продукции спленоцитами IFN-y, IL-2, IL-6 и IL-10 [29, 30]. Противоположные изменения уровней центральных и периферических цитокинов, наблюдаемые при формировании агрессивного поведения и его купировании, свидетельствуют о цитокин-опосредованном редактировании поведенческого фенотипа агрессивных реципиентов после трансплантации прекультиви-рованных с аминазином сингенных иммунокомпетентных клеток. Существенным звеном здесь может быть модуляция миелопоэза и миграции костномозговых клеток моноцитарного ряда в головной мозг и на периферию с приобретением ими «воспалительного» потенциала.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка костномозгового гемопоэза и клеточного состава периферической крови у экспериментальных животных при формировании агрессивного поведения вследствие хронического социального конфликта и после его редактирования модулированными ex vivo аминазином сингенными иммунокомпетентными клетками селезенки.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на мышах-самцах (CBAxC57BL/6)F1 в возрасте 3-4 месяцев, полученных из питомника НИЛЭМ (Томск). Животные содержались в условиях лабораторного вивария в клетках по 5-10 особей, в течение не менее двух недель до начала эксперимента на стандартной диете, при свободном доступе к воде и естественном световом режиме. Все манипуляции выполняли в световой фазе цикла дня.
Исследования проведены с соблюдением норм современной биомедицинской этики и одобрены на заседании локально-этического комитета НИИФКИ. При выполнении исследования исполнителями были приложены все усилия, чтобы минимизировать количество животных, использованных в экспериментах.
Учитывая наличие в популяции самцов (CBA×C57BL/6)F1 особей с активным и пассивным типами поведения, представители которых характеризуются определенными структурнофункциональными характеристиками нервной и иммунной систем и различной психофизиологической реакцией на стрессовые воздействия [26], для формирования однородных групп используемых в исследовании экспериментальных животных все мыши были предварительно протестированы в соответствии со стандартной процедурой теста Открытое поле. В исследование были включены только особи с активным типом поведения, у которых в результате 20-кратного опыта побед в ежедневных агонистических взаимодействиях с пассивным партнером было сформировано агрессивное поведение (модель хронического социального конфликта) [2]. Формирование агрессивного поведения у мышей-самцов (CBA×C57BL/6)F1 было подтверждено поведенческим фенотипированием [31].
Агрессивные самцы (CBA×C57Bl/6)F1 использовались в последующих экспериментах, в том числе в качестве доноров и реципиентов иммунокомпетентных клеток. Спленоциты агрессивных доноров были выделены в стерильных условиях, обработаны in vitro аминазином и внутривенно введены сингенным агрессивным реципиентам, как это было подробно описано ранее [26, 27, 30, 31]. В контрольной группе агрессивных реципиентов подготовка и трансплантация иммунокомпетентных клеток селезёнки были проведены в аналогичных условиях эксперимента, за исключением того, что прекультивирование донорских клеток проводилось без аминазина. В качестве группы интактного контроля использовались мыши с активным типом поведения в соответствии с тестом Открытое поле.
Через 24 часа после трансплантации сингенных спленоцитов всех животных выводили из эксперимента путем декапитации. Для оценки количества костномозговых гемопоэтических предшественников костный мозг мышей вымывали из бедренной кости с помощью шприца кондиционной средой RPMI1640, содержащей 10% FCS. Подсчитывали количество клеток костного мозга (ККМ) в 1 мл с помощью гематологического анализатора PCE-90 (ERMA Inc, Japan). Для определения количества коммитированных предшественников клетки костного мозга животных в концентрации 2,0х104/мл инкубировали в 24-луночных планшетах в метилцеллюлозной среде М 3434 (Stem Cell Technology, Canada), содержащей цитокины SCF, EPO, IL-3, IL-6. Гранулоцитарно-макрофагальные (КОЕ-ГМ) и гранулоцитар-но-эритроидно-макрофагально-мегакариоцитарные (КОЕ-ГЭММ) колонии подсчитывали под инвертированным микроскопом после 14-дневной инкубации при температуре 37⁰С, во влажной атмосфере, содержащей 5% СО2, согласно рекомендациям Stem Cell Technologies (Canada). Полученные данные представлены как количество КОЕ/105 ККМ.
Клеточный состав периферической крови мышей оценивали на гематологическом анализаторе PCE-90 (ERMA Inc, Japan). Относительное количество форменных элементов крови подсчитывали в мазках, окрашенных по Романовскому-Гимзе.
Статистическую обработку данных проводили с помощью пакета программ SPSS 11.0. При анализе количественных данных проверку на нормальность распределения фактических данных проводили с помощью критерия Шапиро‒Уилка. Для каждой из непрерывных величин определяли среднее (М) и стандартное отклонение (SD). В ходе проведения сравнений независимых выборок при числе групп, равном 2, учитывая выявленное отклонение распределения от нормального в исследуемых группах, применяли критерий Манна‒Уитни. Для множественного сравнения показателей использовали критерий Крускала– Уоллиса. Критический уровень значимости при проверке статистических гипотез в исследовании принимался p≤0,05. Объем выполненных исследований позволял оценить результаты с достоверностью 95-99% при использовании соответствующих статистических методов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Формирование агрессивного поведения у мышей-самцов (CBA×C57Bl/6)F1 сопровождалось, как и ожидалось, оживлением в костном мозге миелоидной дифференцировки гемопоэтической стволовой клетки: количество гранулоцитарномакрофагальных предшественников (КОЕ – ГМ) значительно превышало таковое в костном мозге контрольной группы интактных мышей с активным типом поведения (рис. 1).
В результате усиления миелоидной дифференцировки в костном мозге в периферической крови агрессивных мышей наблюдалось значительное увеличение количества лейкоцитов и моноцитов (табл. 1). Усиление костномозгового гемопоэза, равно как и нарастание в периферической крови указанных клеточных популяций, по всей видимости, является следствием активации при стресс-индуцированной агрессии симпатического отдела вегетативной нервной системы [10, 12, 32].
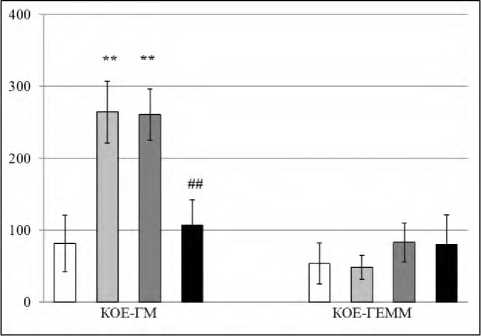
Рисунок 1. Колониеобразующая активность костномозговых гемопоэтических предшественников агрессивных реципиентов (CBA×C57Bl/6)F1 после трансплантации сингенных спленоцитов, модулированных ex vivo аминазином
Примечание. КОЕ-ГМ - гранулоцитарномакрофагальные колонии. КОЕ-ГЭММ - гранулоци-тарно-эритроидно-макрофагально-мегакариоцитарные колонии. По оси ординат - количество КОЕ/105 клеток костного мозга. Обозначение столбиков: белые - интактный контроль (мыши с активным типом поведения); светло-серые - агрессивные мыши; тёмно-серые - агрессивные реципиенты после трансплантации спленоцитов, прекультивированных без аминазина (контрольная группа агрессивных реципиентов); чёр-
ные - агрессивные реципиенты после трансплантации спленоцитов, прекультивированных с аминазином (опытная группа агрессивных реципиентов). Статистические значимые различия по сравнению с соответствующим показателем в группе интактного контроля: ** - p<0,01; в группах агрессивных мышей и агрессивных реципиентов после трансплантации сингенных спленоцитов: #-# - p<0,01. Результаты представлены в виде M±SD; n=10-12 в каждой группе.
Как показано на рисунке 1, после трансплантации агрессивным самцам (CBA×C57Bl/6)F1 сингенных спленоцитов, прекультивированных без аминазина, объем популяции КОЕ-ГМ оставался на уровне такового у агрессивных мышей. Обработка выделенных у агрессивных доноров спленоцитов перед трансплантацией аминазином приводила к существенному снижению количества КОЕ-ГМ у сингенных агрессивных реципиентов практически до уровня интактного контроля. Вместе с тем не обнаружено статистически значимых различий между показателями количества ранних предшественников (КОЕ-ГЭММ) в костном мозге у агрессивных и интактных мышей-самцов (CBAxC57Bl/6)F1, равно как и у агрессивных реципиентов (CBA×C57Bl/6)F1 после трансплантации сингенных иммунокомпетентных клеток селезенки.
Таблица 1. Количество форменных элементов в периферической крови агрессивных реципиентов (CBA×C57Bl/6)F1 после трансплантации сингенных спленоцитов, модулированных ex vivo аминазином
|
Группа исследования |
Лейкоциты (106/мл) |
Моноциты (%) |
Нейтрофилы (%) |
Лимфоциты (%) |
|
Интактный контроль (мыши с активным типом поведения) |
6,9 ±1,4 |
1,1±0,3 |
17,1±2,0 |
62,0±3,0 |
|
Мыши с агрессивным поведением |
12,3±2,8** |
3,1±1,2** |
26,3±4,3** |
79,9±5,1** |
|
Контрольная группа агрессивных реципиентов |
10,2±2,1** |
2,7±1,1* |
20,9±6,4 |
74,3±8,0* |
|
Опытная группа агрессивных реципиентов |
7,3±2,5^ |
1,5±0,3^ |
15,6±4,4^ |
65,4±5,2^ |
Примечание. Контрольная группа агрессивных реципиентов - агрессивные реципиенты после трансплантации сингенных спленоцитов, прекультивированных без аминазина. Опытная группа агрессивных реципиентов -агрессивные реципиенты после трансплантации сингенных спленоцитов, прекультивированных с аминазином. Статистически значимые различия по сравнению с соответствующим показателем в группе интактных животных: * -p<0,05, ** - p<0,01; между соответствующими показателями в группах агрессивных мышей и агрессивных реципиентов после трансплантации сингенных спленоцитов: + - p<0,01. Результаты представлены в виде M±SD; n=10-12 в каждой группе.
Как видно из таблицы 1, формирование агрессивного поведения у мышей сопровождалось также увеличением количества сегментоядерных нейтрофилов, что наблюдается при воспалительных состояниях, в том числе связанных с хроническим стрессом [4, 33]. При этом наблюдалось и существенное нарастание в периферической крови популяции лимфоцитов, что согласуется с данными ранее опубликованных работ [3, 10].
Введение модулированных ex vivo аминазином спленоцитов от агрессивных доноров (CBA×C57Bl/6)F1 приводило у сингенных агрес- сивных реципиентов к значительному снижению количества моноцитов и лейкоцитов в периферической крови. Аналогичные данные были получены и в отношении популяции нейтрофилов. После трансплантации прекультивированных с аминазином спленоцитов корректировался также объем популяции лимфоцитов периферической крови, что может быть одним из механизмов продемонстрированного ранее снижения интенсивности гуморального иммунного ответа при указанном воздействии у агрессивных реципиентов [26, 27].
Усиление миелоидного направления дифференцировки при хроническом социальном стрессе обсуждалось ранее в зарубежных и отечественных публикациях [8, 33, 34]. У агрессивных самцов (CBA×C57Bl/6)F1 мы также наблюдали усиленный миелопоэз, что подтверждается большинством показателей.
Представленные данные могут свидетельствовать о корректирующем эффекте модулированных ex vivo аминазином спленоцитов агрессивных доноров (CBA×C57Bl/6)F1 на миелопоэз агрессивных сингенных реципиентов, что, очевидно, обусловлено продемонстрированным ранее снижением у последних уровня провоспалительных цитокинов [26, 27, 28, 29, 30]. По всей видимости, коррекция воспалительного статуса обеспечивает снижение количества гемопоэтических предшественников в костном мозге и ряда форменных элементов крови (моноцитов, лейкоцитов, нейтрофилов, лимфоцитов) [8].
Как вытекает из полученных результатов исследования, трансплантация спленоцитов, пре-культивированных без аминазина, не изменяет вышеуказанные показатели гемопоэза у агрессивных сингенных реципиентов (CBA×C57Bl/6)F1, а также не оказывает существенное влияние на показатели поведения реципиентов, функциональную активность их иммунокомпетентных клеток и цитокиновый статус в отличие от пре-культивированных с аминазином спленоцитов, как было изложено ранее в ряде опубликованных нами исследований [26, 27, 28, 29, 30, 31]. Вместе с тем изменение ex vivo аминазином функционального фенотипа иммунокомпетентных клеток селезенки агрессивных мышей придает указанным клеткам потенциал, в том числе модулирующий и гемопоэз при состоянии стресс-индуцированной агрессии.
ЗАКЛЮЧЕНИЕ
Получены данные о том, что формирование агрессивной стратегии поведения у мышей-самцов (CBA×C57Bl/6)F1 сопровождалось существенным усилением в костном мозге гранулоцитарно-макрофагального (КОЕ-ГМ) направления дифференцировки гемопоэтической стволовой клетки и нарастанием в периферической крови популяций лейкоцитов, моноцитов, сегментоядерных нейтрофилов и лимфоцитов.
Модулированные ex vivo аминазином сплено-циты агрессивных доноров (CBA×C57Bl/6)F1 после трансплантации сингеннным агрессивным реципиентам оказывали корректирующее воздействие на указанные показатели, снижая таковые практически до уровня, характерного для интактных животных.
КОНФЛИКТ ИНТЕРЕСОВ
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена за счет средств федерального бюджета РФ, выделенных на выполнение фундаментальных научных исследований в ФГБНУ «НИИ фундаментальной и клинической иммунологии», тема № 122011800324-4 (2021–2023).
СООТВЕТСТВИЕ ПРИНЦИПАМ ЭТИКИ
Исследования с животными проводились в соответствии с законодательством Российской Федерации, положениями Директивы 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, требованиями и рекомендациями Руководства по содержанию и использованию лабораторных животных и одобрены на заседании локально-этического комитета НИИФКИ (протокол № 139 от 30.05.2022 г).
Список литературы Влияние модулированных ex vivo аминазином иммунокомпетентных клеток на гемопоэз при агрессии
- Kudryavtseva N.N. Positive fighting experience, addiction-like state, and relapse: Retrospective analysis of experimental studies. Aggress. Viol. Behav. 2020 May-June;52:101403. doi: 10.1016/j.avb.2020.101403
- Kudryavtseva NN, Smagin DA, Kovalenko IL, Vishnivetskaya GB. Repeated positive fighting experience in male inbred mice. Nat Protoc. 2014 Nov;9(11):2705-17. doi: 10.1038/nprot.2014.156. Epub 2014 Oct 23. PMID: 25340443.
- Идова Г.В., Альперина Е.Л., Геворгян М.М., Жукова Е.Н. Психонейроиммуномодуляция. агрессия и иммунитет. Патогенез. 2014. Т. 12, № 3. С. 27-32.
- McKim DB, Yin W, Wang Y, Cole SW, Godbout JP, Sheridan JF. Social Stress Mobilizes Hematopoietic Stem Cells to Establish Persistent Splenic Myelopoiesis. Cell Rep. 2018 Nov 27;25(9):2552-2562.e3. doi: 10.1016/j.celrep.2018.10.102. PMID: 30485819; PMCID: PMC6342493.
- Rostène W, Kitabgi P, Parsadaniantz SM. Chemokines: a new class of neuromodulator? Nat Rev Neurosci. 2007 Nov;8(11):895-903. doi: 10.1038/nrn2255. PMID: 17948033.
- Torres-Platas SG, Cruceanu C, Chen GG, Turecki G, Mechawar N. Evidence for increased microglial priming and macrophage recruitment in the dorsal anterior cingulate white matter of depressed suicides. Brain Behav Immun. 2014 Nov;42:50-9. doi: 10.1016/j.bbi.2014.05.007. Epub 2014 May 20. PMID: 24858659.
- Wohleb ES, McKim DB, Sheridan JF, Godbout JP. Monocyte trafficking to the brain with stress and inflammation: a novel axis of immune-to-brain communication that influences mood and behavior. Front Neurosci. 2015 Jan 21;8:447. doi: 10.3389/fnins.2014.00447. PMID: 25653581; PMCID: PMC4300916.
- Reader BF, Jarrett BL, McKim DB, Wohleb ES, Godbout JP, Sheridan JF. Peripheral and central effects of repeated social defeat stress: monocyte trafficking, microglial activation, and anxiety. Neuroscience. 2015 Mar 19;289:429-42. doi: 10.1016/j.neuroscience.2015.01.001. Epub 2015 Jan 14. PMID: 25596319; PMCID: PMC4536813.
- Гоголева В.С., Друцкая М.С., Атретханы К.С.-Н. Микроглия в гомеостазе центральной нервной системы и нейровоспалении. Молекулярная биология. 2019. Т. 53, № 5. С. 790-798. doi: 10.1134/S0026898419050057
- Takahashi A, Flanigan ME, McEwen BS, Russo SJ. Aggression, Social Stress, and the Immune System in Humans and Animal Models. Front Behav Neurosci. 2018 Mar 22;12:56. doi: 10.3389/fnbeh.2018.00056. PMID: 29623033; PMCID: PMC5874490.
- Alperina E, Idova G, Zhanaeva S. Rodent modeling of aggression, elucidating the role of cytokines in the brain. In: Martin C, Preedy VR, Patel VB (eds) Handbook of Anger, Aggression, and Violence. Springer, Cham. 2023:1-20. doi: 10.1007/978-3-030-98711-4_150-1
- Tan KS, Nackley AG, Satterfield K, Maixner W, Diatchenko L, Flood PM. Beta2 adrenergic receptor activation stimulates pro-inflammatory cytokine production in macrophages via PKA- and NF-kappaB-independent mechanisms. Cell Signal. 2007 Feb;19(2):251-60. doi: 10.1016/j.cellsig.2006.06.007. PMID: 16996249.
- Montoya ER, Terburg D, Bos PA, van Honk J. Testosterone, cortisol, and serotonin as key regulators of social aggression: A review and theoretical perspective. Motiv Emot. 2012 Mar;36(1):65-73. doi: 10.1007/s11031-011-9264-3. Epub 2011 Nov 25. PMID: 22448079; PMCID: PMC3294220.
- Макушкина О.А., Гурина О.И., Голенкова В.А. Биологические основы агрессивного поведения. Неврология, нейропсихиатрия, психосоматика. 2021. Т. 13, № 5. С. 76-82. doi: 10.14412/2074-2711-2021-5-76-82
- Тощакова В.А., Вялова Н.М., Бойко А.С., Гусев С.И., Иванова С.А., Бохан Н.А. Уровень кортизола и адренокортикотропного гормона у лиц с криминальным поведением. Фундаментальные исследования. 2013. № 12-1. С. 81-84.
- Иванова С.А., Тощакова В.А., Бохан Н.А. Гормональные факторы в регуляции агрессии. Томск: «Иван Федоров», 2014. 108 с.
- Manchia M, Comai S, Pinna M, Pinna F, Fanos V, Denovan-Wright E, Carpiniello B. Biomarkers in aggression. Adv Clin Chem. 2019;93:169-237. doi: 10.1016/bs.acc.2019.07.004. Epub 2019 Sep 11. PMID: 31655730.
- Узбеков М.Г., Максимова Н.М., Бриллиантова В.В., Шихов С.Н., Москвитина Т.А., Узбекова Д.Г., Горобец Л.Н., Стрелкова И.М., Булатецкий С.В., Смолина Н.В. К вопросу о биологических маркерах эффективности терапии психических и неврологических заболеваний. Сибирский вестник психиатрии и наркологии. 2018. № 2 (99). С. 5-14. doi: 10.26617/1810-3111-2018-2(99)-5-14
- Smagin DA, Galyamina AG, Kovalenko IL, Kudryavtseva NN. Altered expression of genes associated with major neurotransmitter systems in the reward-related brain regions of mice with positive fighting experience. Int J Mol Sci. 2022 Nov 7;23(21):13644. doi: 10.3390/ijms232113644. PMID: 36362437; PMCID: PMC9655062.
- Стояк В.А., Иванова С.А. Нейромедиаторные системы в регуляции агрессивного поведения (обзор литературы). Сибирский вестник психиатрии и наркологии. 2010. № 3 (60). С. 70-76.
- Miller AH, Haroon E, Raison CL, Felger JC. Cytokine targets in the brain: impact on neurotransmitters and neurocircuits. Depress Anxiety. 2013 Apr;30(4):297-306. doi: 10.1002/da.22084. Epub 2013 Mar 6. PMID: 23468190; PMCID: PMC4141874.
- Salvador AF, de Lima KA, Kipnis J. Neuromodulation by the immune system: a focus on cytokines. Nat. Rev. Immunol. 2021; 21(8):526-541. doi: 10.1038/s41577-021-00508-z
- Ветлугина Т.П., Никитина В.Б., Лобачева О.А., Невидимова Т.И. Основы клинической психонейроиммунологии. Томск: Книго, 2014. 80 c.
- Holtmann M, Poustka L, Zepf FD, Banaschewski T, Priller J, Bölte S, Legenbauer T. Severe affective and behavioral dysregulation in youths is associated with a proinflammatory state. Z Kinder Jugendpsychiatr Psychother. 2013 Nov;41(6):393-9. doi: 10.1024/1422-4917/a000255. PMID: 24240495.
- Idova GV, Markova EV, Gevorgyan MM, Alperina EL, Zhukova EN. Changes in Production of Cytokines by C57Bl/6J Mouse Spleen during Aggression Provoked by Social Stress. Bull Exp Biol Med. 2016 Mar;160(5):679-82. doi: 10.1007/s10517-016-3248-y. Epub 2016 Mar 29. PMID: 27021091.
- Маркова Е.В. Иммунокомпетентные клетки и регуляция поведенческих реакций в норме и патологии. Красноярск, 2021. 184 с. doi: 10.12731/978-5-907208-67-4
- Markova EV, Serenko EV, Knyazheva MA. Aggressive behavior correction by the transplantation of in vitro modulated immune cells. Medical Immunology (Russia). 2021;23(4):693-698. doi: 10.15789/1563-0625-ABC-2263.
- Серенко Е.В., Маркова Е.В. Влияние трансплантации модулированных ex vivo аминазином иммунокомпетентных клеток на паттерны поведения и центральный уровень цитокинов у сингенных агрессивных реципиентов. Патогенез. 2022. № 3. С. 117-118. doi: 10.25557/2310-0435.2022.03.117-118
- Markova E, Serenko E, Knyazheva M. Aggressive phenotype editing by modulated immune cells. Eur Psychiatry. 2022 Sep 1;65(Suppl 1):S95-6. doi: 10.1192/j.eurpsy.2022.278. PMCID: PMC9564868.
- Маркова Е.В., Серенко Е.В. Цитокин-опосредованные механизмы коррекции агрессивного поведения модулированными invitroиммунокомпетентными клетками. Сибирскийвестникпсихиатрииинаркологии. 2023; 1 (118): 32-40. doi: 10.26617/1810-3111-2023-1(118)-32-40
- Маркова Е.В., Серенко Е.В. Коррекция паттернов агрессивного поведения модулированными ex vivo иммунокомпетентными клетками: экспериментальное исследование. Сибирский вестник психиатрии и наркологии. 2022. № 3 (116). С. 5-13. doi: 10.26617/1810-3111-2022-3(116)-5-13
- Maestroni GJM. Adrenergic Modulation of Hematopoiesis. J Neuroimmune Pharmacol. 2020 Mar;15(1):82-92. doi: 10.1007/s11481-019-09840-7. Epub 2019 Feb 14. PMID: 30762159.
- Orlovskaya IA, Toporkova LB, Lvova MN, Sorokina IV, Katokhin AV, Vishnivetskaya GB, Goiman EV, Kashina EV, Tolstikova TG, Mordvinov VA, Avgustinovich DF. Social defeat stress exacerbates the blood abnormalities in Opisthorchis felineus-infected mice. Exp Parasitol. 2018 Oct;193:33-44. doi: 10.1016/j.exppara.2018.08.004. Epub 2018 Aug 27. PMID: 30165039.
- Орловская И.А., Топоркова Л.Б., Савкин И.В., Княжева М.А., Серенко Е.В., Гойман Л.В., Шевченко Ю.A., Маркова Е.В. Влияние растворимых факторов макрофагов М2 фенотипа на гемопоэз при депрессивно-подобном состоянии. Медицинская иммунология. 2022. Т. 24, № 5. С. 1057-1064. doi: 10.15789/1563-0625-IOS-2516


