Влияние патологии гепатобилиарной системы матери на функциональную активность нейтрофилов периферической крови потомства (экспериментальное исследование)
Автор: Брюхин Г.В., Невзорова Н.В.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 28 (287), 2012 года.
Бесплатный доступ
В ходе исследования были изучены функциональные особенности нейтрофилов периферической крови, в том числе способность к адгезии, распластыванию, фагоцитозу, а также лизосомальная активность и интенсивность кислородзависимых метаболических процессов. В качестве объекта исследования использовалось потомство самок крыс с хроническим экспериментальным поражением печени. Было выявлено угнетение функциональной активности нейтрофилов и снижение их содержания в крови.
Нейтрофилы, кровь, мать, плод, фагоцитоз
Короткий адрес: https://sciup.org/147152979
IDR: 147152979 | УДК: 618.3-06:616.36
Текст научной статьи Влияние патологии гепатобилиарной системы матери на функциональную активность нейтрофилов периферической крови потомства (экспериментальное исследование)
Введение. Большинство фундаментальных процессов, лежащих в основе индивидуального развития, в настоящее время изучены недостаточно. В частности, под пристальным вниманием российских и зарубежных ученых находятся вопросы становления одной из важнейших систем человеческого организма – системы крови. Известно, что для нормального функционирования организма необходимо определенное соотношение клеток крови различных типов, выполняющих специфические функции и находящихся на определенных стадиях развития [2].
В частности, для обеспечения адаптационных возможностей организма важно нормальное содержание в крови нейтрофильных гранулоцитов и необходима способность этих клеток выполнять важнейшие функции, из которых основной является защитная. В основе защитной функции нейтрофила лежит его способность к фагоцитозу. Для обеспечения акта фагоцитоза необходимо наличие в клетке специфических ферментов, отвечающих за лизис чужеродного агента, способности к адгезии и распластыванию, а также высокого уровня метаболической активности [7].
В настоящее время многочисленные экспериментальные и клинические исследования указывают на нарушение у потомства матерей с хронической патологией гепатобилиарной системы становления систем жизнеобеспечения, в том числе репродуктивной, иммунной, макрофагальной [1, 2].
Применяемые в работе цитохимические методы исследования позволяют выявить связь между морфологией и биохимией клетки в норме и патологии.
В связи с этим целью настоящего исследования явился анализ роли патологии печени матери в условиях эксперимента на морфофункциональное становление гранулоцитов крови.
Методика исследования. В качестве объекта исследования в эксперименте были использованы белые лабораторные крысы (самки) линии Вистар, всего 120 животных, в том числе взрослые самки (24 животных) и их разнополое потомство – 96 животных из 24 пометов в различные сроки постнатального периода (15, 30, 45, 60-е сут). Сроки исследования согласуются с общепризнанным подразделением возрастных периодов у данной группы животных.
Исходя из цели настоящего исследования все экспериментальные животные были разделены на 2 группы. Первую группу составили животные от интактных матерей – контрольная группа – 48 животных из 10 пометов. Во вторую группу вошло потомство от самок с хроническим экспериментальным поражением печени с помощью фильтрата E.coli – экспериментальная группа – 48 животных из 14 пометов.
Работа с экспериментальными животными проводилась в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
Поражение печени моделировалось путем введения половозрелому животному (самке) в три участка печени – по одной инъекции с обеих сторон у основания мечевидного отростка и справа у края реберной дуги по срединно-ключичной линии – 0,2 мл фильтрата шестидневной культуры E.coli (штамм АТСС 25922) в разведении 1:4. Разрешающую инъекцию производили через 24 ч путем введения в хвостовую вену фильтрата шестидневной культуры E.coli из расчета 0,3 мл/кг массы тела. По данным литературы, экспериментальный гепатит, вызываемый введением фильтрата шестидневной культуры E.coli, по своим морфологическим, иммунологическим и биохимическим характеристикам рассматривается как адекватная модель вирусного гепатита А у человека [9].
Исходя из поставленных задач нами были использованы морфологические, гистологические, гистохимические, статистические методы исследования.
Выделение нейтрофилов проводили общепринятыми методами на фиколл-верографиновом градиенте плотностью 1,095. Исследования проводили в мазках и в монослое клеток [5].
Количество нейтрофилов в периферической крови исследовалось с помощью камеры Горяева. Кроме того, для оценки рецепторного аппарата нейтрофилов использовали нединамический «адгезивный тест» и тест «распластывание», основанных на их способности прикрепляться к чистой стеклянной поверхности [5].
Кислородзависимые метаболические процессы в нейтрофилах оценивали по интегральному НСТ-тесту в модификации А.Н. Маянского с соавторами в двух вариантах – спонтанном и индуцированном [6]. Оценку результатов проводили путем подсчета НСТ-положительных клеток (%).
Лизосомальную активность нейтрофилов изучали по методу И.С. Фрейндлин и др. (1976), основанному на инкубации монослоя нейтрофилов в среде с флюоресцирующим красителем – акридиновый оранжевый. При оценке результатов данного теста учитывали количество акридин-позитивных клеток и средний гистохимический показатель, отражающий лизосомальную активность [3, 10].
Изучение фагоцитарной способности нейтрофилов периферической крови проводили на модели поглощения частиц латекса диаметром 1,2 мкм. При оценке результатов определяли фагоцитарный показатель, отражающий процент макрофагов, содержащих микросферы латекса, и фагоцитарный индекс, отражающий количество частиц латекса из расчета на 1 клетку [6].
Статистический анализ полученных данных проводили с использованием лицензионного пакета прикладных программ «SPSS 17.0». При сравнительном анализе данных использовали непараметрический критерий Манна – Уитни [8].
Результаты исследований и обсуждение. Прежде всего нами было установлено достоверное снижение количества нейтрофилов в 1 мл периферической крови у подопытных животных по сравнению с контролем на 30-й и 45-й день постнатального развития (табл. 1). Это можно объяснить снижением интенсивности процессов гемопоэза, в частности, нейтрофилоцитопоэза в костном мозге. Наиболее выраженные изменения содержания нейтрофилов у экспериментальных животных имели место в период становления половой зрелости (30-е и 45-е сут) – возрастной период, сопровождающийся усилением метаболической активности, подверженности организма стрессам, адаптации к быстро меняющимся условиям внутренней среды.
Таблица 1
Количество нейтрофилов в 1 мл крови экспериментальных животных
|
Срок исследования, сут |
Количество клеток в 1 мл крови, ×106 |
|
|
Контроль |
Опыт |
|
|
15-е |
2,65 ± 0,22 |
2,11 ± 0,29 |
|
30-е |
3,21 ± 0,21 |
2,45 ± 0,14* |
|
45-е |
3,12 ± 0,22 |
2,28 ± 0,12* |
|
60-е |
2,87 ± 0,37 |
2,21 ± 0,16 |
Здесь и в рис. 1–5 * – различия статистически достоверны ( р < 0,05).
Изучая адгезивные свойства нейтрофилов, мы руководствовались положением о том, что изменение адгезивных свойств клетки тесно взаимосвязано с уровнем возбуждения фагоцита, являясь важным признаком активации [7, 10].
Большинство физиологических и патологических реакций, в которых участвует нейтрофил, совершается в тканях. В связи с этим адгезия, то есть свойство клеток прикрепляться к определенным субстратам и задерживаться на них, приобретает важное функциональное значение. Адгезивность является активной реакцией клетки на адекватное раздражение. Изменение адгезивных свойств клетки часто сопутствует другим признакам активации нейтрофила: поглощению объектов фагоцитоза, хемотаксису, дегрануляции [7].
Адгезивные свойства нейтрофилов периферической крови изучались нами в двух временных параметрах: на 30-й и 60-й мин культивирования.
Полученные результаты отражены на рис. 1 и 2. Как видно из рисунков, у подопытных крысят всех возрастных групп число адгезированных фагоцитов через 30 и 60 мин культивирования снижено по сравнению с контролем. Аналогичные результаты получены и при постановке теста распластывания фагоцитов.
Логично предположить, что такие изменения связаны с нарушением способности клеток к образованию адгезивных межклеточных контактов и дефектом рецепторов-адгезинов и свидетельствуют о депрессии функционального состояния нейтрофилов потомства самок крыс с хроническим экспериментальным поражением печени.
При оценке содержания распластанных нейтрофилов периферической крови экспериментальных животных было выявлено снижение доли распластанных клеток у потомства самок крыс с хроническим экспериментальным поражением печени. Так, на 15-е сут постнатального онтогенеза доля распластанных нейтрофилов подопытных животных составила (26,31 ± 0,25) %, на 30-е сут – (32,34 ± ± 0,27) %, на 45-е сут – (34,54 ± 0,51) % и на 60-е сутки – (34,65 ± 0,46) %, что существенно ниже содержания распластанных нейтрофилов интактных животных – (34,32 ± 0,37) %, (37,61 ± 0,24) %,
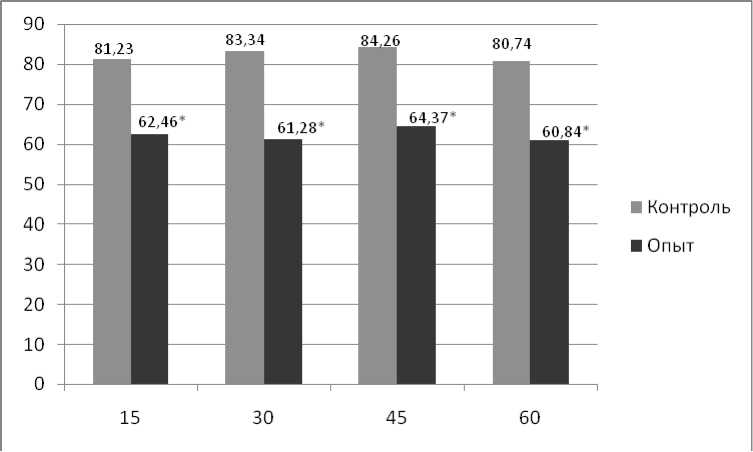
Рис. 1. Доля адгезировавшихся нейтрофилов экспериментальных животных через 30 мин инкубации, %
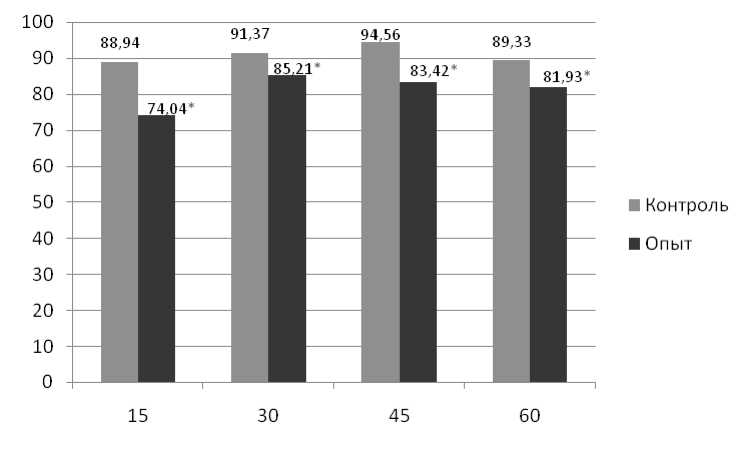
Рис. 2. Доля адгезировавшихся нейтрофилов экспериментальных животных через 60 мин инкубации, %
(39,72 ± 0,19) % и (36,14 ± 0,46) % соответственно. Различия на 15, 30 и 45-е сут постнатального развития статистически достоверны.
Логично предположить, что угнетение адгезивной способности нейтрофилов, а также их способности к распластыванию у подопытных крысят обусловлено дефектом рецепторов-адгезинов, что может быть связано, в свою очередь, с патологиями цитоскелета [10].
Известно, что прилипание к эндотелию, определяющее размер маргинального пула нейтрофилов периферической крови, напрямую зависит от адгезивных свойств нейтрофилов. Pазмер же маргинального пула, в свою очередь, отражает подготовку к необходимой миграции клеток в экстрава- зальное пространство и формирование тканевого пула. Таким образом, угнетение способности к адгезии негативно сказывается не только на фагоцитарной активности нейтрофилов, но и на возможности их «пионерного» участия в реакциях воспаления [7].
Кислородзависимые бактерицидные механизмы нейтрофилов мы оценивали с помощью интегрального теста восстановления нитросинего тет-разолия как одного из характерных и надежных показателей функциональной активности фагоцитирующих клеток [6, 7].
При этом кислородзависимые метаболические процессы в нейтрофилах периферической крови экспериментальных животных мы оценивали в двух вариантах: спонтанном и стимулированном. Анализ полученных данных позволяет сделать заключение, что у потомства самок с экспериментальным поражением печени на всех сроках исследования имеет место снижение интенсивности спонтанного НСТ-теста в нейтрофилах периферической крови (рис. 3).
Обращает на себя внимание тот факт, что у 15-дневных крысят интактной и опытной групп содержание НСТ-положительных клеток среди нейтрофилов периферической крови приблизительно одинаково. В то же время у 60-дневных опытных крысят этот показатель существенно снижен по сравнению с интактными животными.
Аналогичные изменения выявлены и при постановке индуцированного латексом НСТ-теста (рис. 4).
Из рис. 3 видно, что окислительная метаболическая активность у нейтрофилов подопытных животных снижена по сравнению с клетками интактных крысят, причем наибольшие различия наблюдаются на 60-й день онтогенеза, в то время как на 15-й день доля высокоактивных клеток практически одинакова в опыте и контроле.
Показатели индуцированного латексом НСТ-теста различаются более существенно – различия статистически достоверны на всех сроках исследования. Такие данные позволяют предположить снижение у нейтрофилов подопытных животных способности адаптировать свой кислородзависи-мый окислительный метаболизм к изменившимся условиям и адекватно реагировать на внешний раздражитель.
Эти изменения находятся в полном соответствии с таковыми коэффициентами стимуляции НСТ-теста (табл. 2). Известно, что коэффициент стимуляции характеризует способность клетки оперативно и адекватно реагировать на внешнее воздействие усилением окислительного метаболизма [7].
Как видно из табл. 2, на всех сроках исследования у подопытных крысят коэффициент сти-
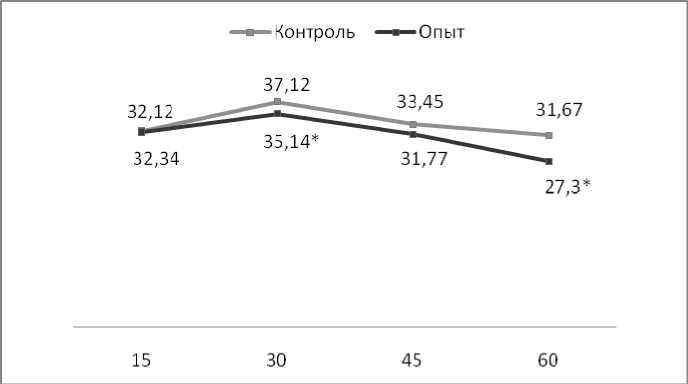
Рис. 3. Содержание НСТ-положительных нейтрофилов при спонтанном НСТ-тесте, %
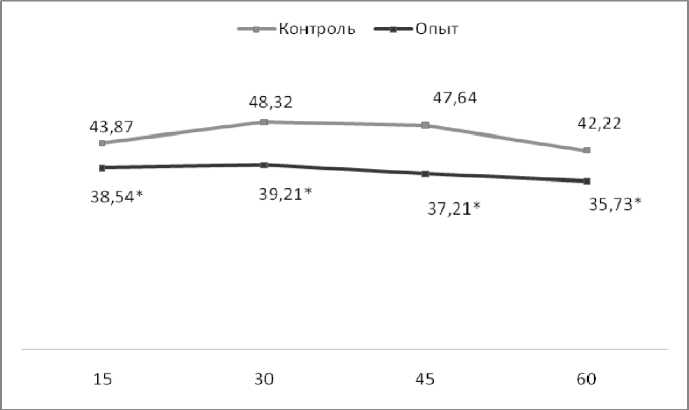
Рис. 4. Содержание НСТ-положительных клеток при постановке НСТ-стимулированного теста, %
муляции НСТ-теста оказался существенно сниженным по сравнению с таковым у интактных животных.
Для оценки лизосомальной активности нейтрофилов периферической крови эксперименальных животных нами использовался метод флюоресцентного зондирования отдельных клеток [10].
Таблица 2 Коэффициент стимуляции НСТ-теста в нейтрофилах периферической крови экспериментальных животных, %
|
Срок исследования, сут |
Коэффициент стимуляции НСТ-теста |
|
|
Контроль |
Опыт |
|
|
15-е |
135,65 |
119,98 |
|
30-е |
130,17 |
111,58 |
|
45-е |
142,42 |
117,12 |
|
60-е |
133,31 |
130,87 |
Полученные результаты отражены на рис. 5. Как видно из рисунка, число акридинпозитивных клеток у подопытных крысят на всех сроках исследования снижено по сравнению с таковыми у интактных животных. Учитывая, что лизосомальные энзимы участвуют в переваривании поглощенных веществ, в том числе микроорганизмов, выявленное нами уменьшение числа нейтрофилов с лизосомальной активностью у потомства самок крыс с хроническим поражением печени может указывать на депрессию у них этой функции [4].
Известно, что лизосомальные ферменты нейтрофила нацелены на деструктивные реакции: они участвуют во внутриклеточном пищеварении (фагоцитоз) или, будучи секретированными во внешнюю среду, способствуют умерщвлению живых объектов и разрушению макромолекул.
Образование и высвобождение преформиро-ванных биологически активных веществ составляет важнейший этап реализации эффекторного потенциала зрелого нейтрофила [7]. Соответственно, снижение лизосомальной активности нейтрофилов подопытных крысят свидетельствует о существенном уменьшении защитного потенциала этих клеток.
При исследовании фагоцитарной активности нейтрофилов было выявлено снижение всех показателей способности клеток к фагоцитозу.
Так, фагоцитарный показатель нейтрофилов подопытных животных – 37,93 ± 0,44 – на 15-й день постнатального развития, 43,77 ± 0,24 – на 30-й день, 42,64 ± 0,36 – на 45-й день и 40,86 ± 33 – на 60-й день – существенно снижен по сравнению с контролем – 45,74 ± 33, 47,21 ± 0,26, 49,53 ± 0,16 и 52,31 ± 0,43 соответственно (различия статистически достоверны).
Выявлено снижение количества активно фагоцитирующих клеток по сравнению с контролем, о чем свидетельствует изменение фагоцитарного индекса.
Фагоцитарный индекс нейтрофилов также ниже среди нейтрофилов подопытных животных: на 15-й день онтогенеза – в 2,32 раза, на 30-й день – в 2,56 раза, на 45-й день – в 3,24 раза и на 60-й день в 2,76 раза по сравнению с контролем. Таким образом, нейтрофилы потомства самок с поражением печени способны поглотить значительно меньшее количество чужеродных агентов, чем нейтрофилы здоровых животных.
Заключение. Полученные результаты позволяют сделать заключение о том, что у потомства самок крыс с экспериментальным хроническим поражением гепатобилиарной системы снижение числа нейтрофилов в циркуляции сопровождается их качественными изменениями, что проявляется в угнетении адгезивной и фагоцитарной активности,
■ Контроль ■ Опыт

Рис. 5. Содержание акридинпозитивных нейтрофилов в периферической крови экспериментальных животных, %
а также в снижении интенсивности внутриклеточных метаболических процессов. Эти данные могут свидетельствовать о незрелости либо о депрессии эфферентных функций этих клеток под влиянием нарушенного метаболического гомеостаза, обусловленного патологией печени матери.
Список литературы Влияние патологии гепатобилиарной системы матери на функциональную активность нейтрофилов периферической крови потомства (экспериментальное исследование)
- Брюхин, Г.В. Роль токсического поражения печени матери в нарушении структурно-функционального становления яичников потомства в условиях эксперимента/Г.В. Брюхин, Е.В. Вторушина//Морфологические ведомости. -2006. -№ 3-4. -С. 16-18.
- Брюхин, Г.В. Особенности клеточного иммунитета у потомства самок крыс с хроническим поражением печени/Г.В. Брюхин, А.А. Федосов//Вест. Челяб. гос. пед. ун-та. -2006. -№ 6. -С. 157-158.
- Бутенко, З.А. Цитохимия и электронная микроскопия клеток крови и кроветворных органов/З.А. Бутенко, Д.Ф. Глузман, К.П. Зак. -Киев: Наукова думка, 1974. -243 с.
- Долгушин, И.И. Нейтрофильные внеклеточные ловушки и методы оценки функционального статуса нейтрофилов/И.И. Долгушин, Ю.С. Андреева, А.Ю. Савочкина. -М.: Изд-во РАМН, 2009. -208 с.
- Иммунологические, цитохимические и биохимические методы исследования фагоцитирующих клеток: метод. рекомендации/под ред. Э.А. Имельбаевой. -Уфа: БГМИ, 1996. -85 с.
- Маянский, А.Н. Очерки о нейтрофиле и макрофаге/А.Н. Маянский, Д.Н. Маянский. -Новосибирск: Наука, 1983. -254 с.
- Маянский, А.Н. Клинические аспекты фагоцитоза/А.Н. Маянский, О.И. Пикуза. -Казань: Магариф, 1993. -200 с.
- Реброва, О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA/О.Ю. Реброва. -М.: МедиаСфера, 2002. -312 с.
- Сааков, Б.А. Моделирование воспалительного процесса в печени/Б.А. Сааков, А.И. Поляк//Моделирование, методы изучения и экспериментальная терапия патологических процессов, 1967. -С. 119-123.
- Фрейндлин, И. С. Система мононуклеарных фагоцитов/И.С. Фрейндлин. -М.: Наука, 1984. -272 с.


