Влияние полисахаридов на морфологические показатели крови крыс
Автор: Фролов В.В., Зирук И.В., Копчекчи М.Е., Кудинов А.В., Поветкин С.Н., Зирук П.В.
Статья в выпуске: 2 т.254, 2023 года.
Бесплатный доступ
В работе изучена биологическая безопасность применения полисахарида хитозан в связи с Se для организма лабораторных животных. Хитозан - это аминополисахарид, получаемый из хитиновых оболочек ракообразных, обитающих в морских водоемах. Аминополисахарид представляет достаточно богатый источник естественных пищевых волокон, связывающих жиры и выводящих их в непереваренном виде из организма. Хитозан способствует связыванию за счет связей водорода и их комбинации гидрофобных взаимодействий органических веществ, делая его прекрасным адъювантом и антиоксидантом. Животных эксперимента - крыс разделили на 4 группы: контрольная и три опытные. Изначально крыс выдерживали на карантине 21 день, они получали корма, зараженные фитотоксинами. Лабораторным животным 1-й опытной группы добавляли ежедневно полисахарид - хитозан в дозе 0,03 г/кг, животным 2-й опытной группы - хитозан (доза 0,03 г/кг) + Se и крысам 3-й только Se один раз в семь дней, согласно инструкции применения. Контрольная группа крыс не получала добавок и содержалась в общепринятых одинаковых условиях клиники. Хитозан получали однократно, утром с водой. Животные находились в опыте 45 суток, где ежедневно подвергались взвешиванию, внешнему осмотру с контролем за поведением, состоянием наружного покрова и видимых слизистых оболочек. В работе изучали морфологические и биохимические показатели крови. Полученные данные доказывают, что изучаемый полисахарид не оказывает отрицательного воздействия на организм крыс, а наоборот нормализует показатели внутреннего гомеостаза крыс.
Кровь, крысы, полисахариды, гемоглобин, эритроциты, хитозан, лабораторные животные
Короткий адрес: https://sciup.org/142237683
IDR: 142237683 | УДК: 575.854:636.92 | DOI: 10.31588/2413_4201_1883_2_254_285
Текст научной статьи Влияние полисахаридов на морфологические показатели крови крыс
Кровь является одной их важнейших тканей организма, поэтому представляет значительный научный интерес при изучении разных состояний организма животных. Морфологические и биохимические показатели крови показывают интенсивность протекания различных метаболических процессов, а также общее состояние организма в целом, которые тесно связаны с его ростом и развитием [1, 2]. Кровь выполняет огромное количество функций, являясь при этом наиболее информативной тканью организма. Разные факторы оказывают влияние на количество и качество клеток крови, к ним относят такие, как возраст, пол, физиологическое состояние животных, состав и форма рациона, условия содержания, генотип животного, сезон года и многие другие. Все морфологические и биохимические составляющие ткани достаточно емко отражают цепочки взаимодействия сред организма животного с внешней средой [3, 4].
В настоящее время достаточно часто в разных отраслях и сферах производств используют полисахариды с различными определенными свойствами. Достаточно разнообразный спектр продуцентов биополимеров и их положительные свойства делают полисахариды наиболее востребованными в медицине, в ветеринарии или промышленности. К одному из таких веществ относят хитозан, который является линейным полимером, и его структура выглядит в виде случайно связанных β-(1-4)-D-глюкозаминовых звеньев и N-ацетил-D-глюкозамина. Хитозан — это аминополисахарид, основой которого служат хитиновые оболочки ракообразных морских организмов. Последний является богатейшим источником натуральных пищевых волокон, связывающих жиры и выводящих их в непереваренном виде из организма. Хитозан достаточно хорошо связывает с помощью своих водородных связей органические вещества и комбинации гидрофобных взаимодействий, что делает полисахарид отличным адъювантом, а также антиоксидантом [5, 6].
Целью работы являлось – смоделировать изменение пищеварения у крыс и выявить какое влияние оказывают полисахариды на гомеостаз внутренней ткани организма изучаемых животных.
Материал и методы исследований.
В условиях ветеринарной клиники ФГБОУ ВО «Саратовский государственный университет генетики, биотехнологии и инженерии имени Н.И. Вавилова» проведен эксперимент на лабораторных животных – крысах. Животные были разделены на четыре группы: контрольная и три опытные. Все животные из эксперимента были выдержаны на карантине – три недели (21 день) и они в данный период получали корма, которые предварительно были заражены фитотоксинами (лабораторно подтвержденные). Лабораторным животным (крысы) 1-й опытной группы давали полисахарид – хитозан в дозе 0,03 г/кг, 2-й – хитозан (доза 0,03 г/кг) + Se, 3-й – Se. Животные контрольной группы содержались в повседневных условиях клиники и получали аналогичные корма, зараженные фитотоксинами. Крысы опытных групп получали хитозан однократно, утром с водой. Животные находились в опыте 45 суток, где ежедневно подвергались взвешиванию, внешнему осмотру с контролем за поведением, состоянием наружного покрова и видимых слизистых оболочек. Корма заражали фитотоксинами с целью смоделировать нарушение пищеварения у всех животных опыта и провести анализ, какое влияние полисахариды оказывают на процессы пищеварения у подопытных животных.
У животных для контроля за состоянием внутреннего гомеостаза отбирали кровь для изучения морфологических и биохимических показателей, утром, натощак, которую консервировали 5 % раствором цитрата натрия на водной основе. Кровь изучали в лаборатории ФГБОУ ВО «Вавиловский университет» УНТЦ «Ветеринарный госпиталь». Состояние морфологических показателей изучали на гематологическом анализаторе PCE - 90Vet, а биохимические - с помощью биохимического анализатора BioChem -SA.
Результат исследований. При проведении экспериментальной части изучали морфологические и биохимические характеристики клеток крови, ежедневно лабораторных животных взвешивали и проводили мониторинг их клинического состояния. Мониторинг клинического состояния за животными эксперимента на протяжении всего опытного периода показал, что гибели крыс и внешних признаков интоксикации не наблюдали. Все лабораторные животные были достаточно активными, их кожные покровы чистые, без каких – либо видимых нарушений. В процессе проведения исследований происходило увеличение массы как опытных, так и контрольных животных (Таблица 1).
Таблица 1 – Динамика живой массы лабораторных животных, г.
|
Возраст крыс |
Группа |
|||
|
контроль |
1-я опытная Хитозан |
2-я опытная Хитозан+Se |
3-я опытная Se |
|
|
1 неделя |
302,5±0,02 |
300,5±0,04 |
301,2±0,13 |
303,5± 0,03 |
|
2 неделя |
310,7±0,12 |
314,1±0,11* |
314,5±0,07* |
313,2±0,11 |
|
3 неделя |
318,6±0,07 |
334,5±0,04* |
331,4±0,01* |
329,5±0,12 |
|
4 неделя |
321,6±0,11 |
339,3±0,01* |
340,1±0,12* |
338,7±0,07 |
|
5 неделя |
323,0±0,05 |
345,3±0,03* |
347,3±0,03* |
339,5±0,04 |
|
6 неделя |
329,1±0,04 |
357,6±0,07* |
359,2±0,01* |
350,1±0,02 |
|
7 неделя |
332,3±0,08 |
373,2±0,06* |
373,5±0,04* |
367,6±0,08* |
Примечание: *P<0,05
В начале эксперимента живая масса у всех групп лабораторных крыс находилась на стабильно одинаковом уровне и в среднем составляла – 301,9 г. К середине эксперимента наибольший показатель живой массы был у животных 2-й опытной группы и составлял 340,1± 0,12 г, что выше контроля на – 18,5 г, а разница между 1-й и 3-й опытной группами минимальная – 1-2 г. К концу эксперимента динамика превосходства крыс, получавших полисахарид Хитозан и микроэлемент Se в комплексе, сохранилась. Живая масса крыс контрольной группы составляла – 332,3±0,08 г, в 1-й опытной группе – 373,2±0,06 г, во 2-й – 373,5±0,04 г и в 3-й – 367,6±0,08 г. Полученные данные свидетельствуют, о том, что пероральное поступление экзополисахаридов в организм лабораторных животных не оказывало негативного влияния на их рост, а наоборот, способствовало приросту наибольшей живой массы у крыс опытных групп.
В процессе проведения эксперимента у крыс опытных групп наблюдали активный прирост живой массы, начиная с 7 суток. В то же время животные контрольной группы набирали живую массу медленнее, их масса увеличивалась минимально в изучаемый период.
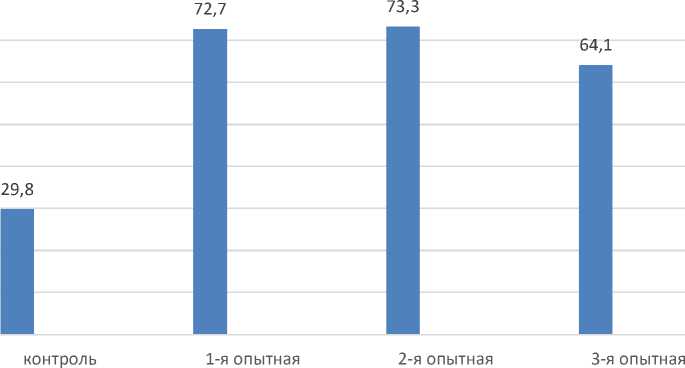
Рисунок 1 – Прирост живой массы крыс за период эксперимента, г.
Исходя из данных, представленных на рисунке 1, следует, что живая масса крыс в период с 1 по 45 сутки эксперимента увеличивалась: в контрольной на 29,8 г, у животных 1-й опытной группы – 72,7 г, во 2-й опытной – 72,3 г и у животных 3-й – 64,1 г.
Анализируя полученные данные, можно заключить, что наилучший прирост за весь период проведения эксперимента наблюдался у крыс 2-й опытной группы и составлял 373,5±0,04 (P≤0,05) г и был выше контроля на 41,2 г, данное превосходство указывает, что полисахариды способствуют более интенсивному росту и развитию изучаемых животных.
Концентрация эритроцитов у крыс всех подопытных групп в начале эксперимента находилась на относительно одинаковом уровне – 6,67*1012/л, что соответствует их возрастной и физиологической норме. Полученные данные эксперимента представлены на рисунке 2.
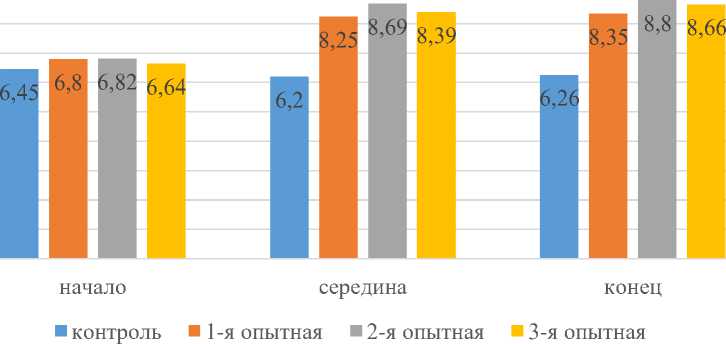
Рисунок 2 – Количество эритроцитов в крови крыс, участвующих в эксперименте, 1012/л
К середине эксперимента, анализируемый нами показатель у крыс контрольной группы равнялся – 6,20±0,04*1012/л, у крыс 1-й опытной группы – 8,25±0,02*1012/л, вo 2-й – 8,69±0,01*1012/л и в 3-й – 8,39±0,01*1012/л. Кaк видно на рисунке 2, концентрация эритроцитов в конце эксперимента у крыс 1-й опытной группы на 74,9%, вo 2-й нa – 71,1 % и 3-й нa – 72,2 % была выше по сравнению с аналогами контрольной группы.
Многие авторы утверждают, что интенсивность окислительновосстановительных процессов у животных неразрывно связана с количеством гемоглобина в их клетках крови.
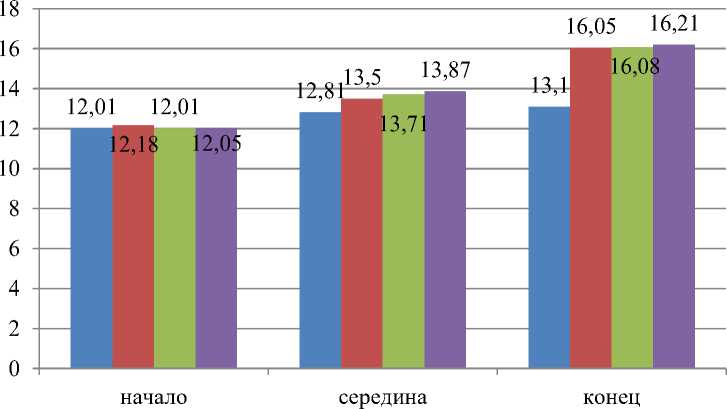
Так, уровень гемоглобина у всех изучаемых нами групп крыс в начале эксперимента находился на относительно равном уровне, составляя – 12,06 г/л. В конце эксперимента наблюдалась картина значительного превосходства у крыс 1-й, 2-й и 3-й опытных групп над аналогами контроля на: 2,95; 2,98 и 3,11 г/л соответственно (Рисунок 3).
■ контроль
■ 1-я опытн.
■ 2-я опытн.
■ 3-я опытн.
Рисунок 3 – Уровень гемоглобина у крыс, участвующих в эксперименте, г/л
Анализ данных рисунка 2, показал, что уровень обменных процессов значительно увеличился к концу опыта у опытных групп крыс.
В результате полученных данных эксперимента установлено, что концентрация гематокрита находилась на стабильно одинаковом уровне в начале эксперимента и соответствует их возрастной и физиологической норме во всех подопытных группах лабораторных животных. В конце эксперимента, картина несколько изменилась и показатель гематокрита превосходил в опытных группах: 1-я на 6,77 %, 2-я на 7,43 % и 3-я на 7,25 % аналогов контроля соответственно. Следовательно, применение хитозана не оказывает отрицательного воздействия на изучаемые нами морфологические характеристики клеток крови, а наоборот, поддерживает и нормализует внутренний гомеостаз организма крыс.
Давно известно, что лейкоциты играют одну из главнейших функций, как для специфического, так и для неспецифического иммунитета организма от различных патогенных агентов [2].
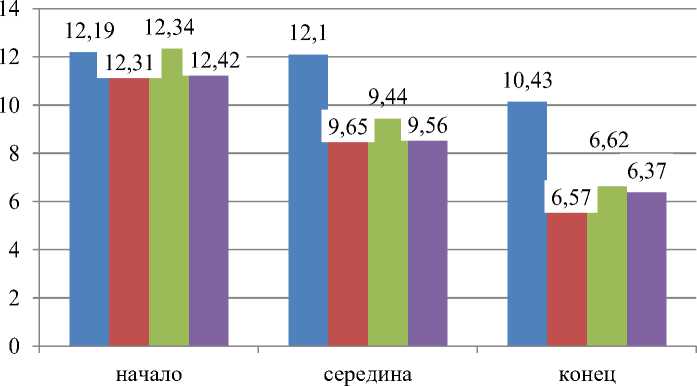
Анализируя данные рисунка 3 следует, что добавление в рационы лабораторных крыс аминополисахарида – хитозана привело к уменьшению уровня концентрации лейкоцитов, более чем на 37 %, при сравнении с аналогами контрольной группой.
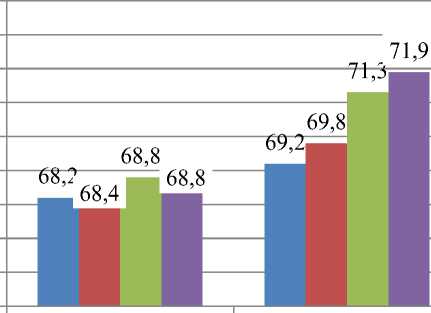
Данные диаграммы рисунка 4 указывают об изменениях концентрации лейкоцитов у лабораторных крыс, которые выглядели следующим образом. В начале эксперимента изучаемый показатель во всех группах эксперимента находился на стабильном уровне, составляя –
12,30*109/л. На протяжении всего эксперимента концентрация лейкоцитов снижалась, оставаясь в пределах их возрастной и физиологической нормы. В конце проводимого эксперимента изучаемый показатель составлял: в контроле - 10,43±0,17*109/л, у животных 1-й опытной группы – 6,57±0,19*109/л, вo 2-й – 6,62±0,12*109/л и в 3-й – 6,37±0,17*109/л соответственно. Снижение количества лейкоцитов в опытных группах крыс указывает на то, что добавляемый с водой полисахарид хитозан обладает антиоксидантной функцией, и, по нашему мнению, способствует нормализации метаболических процессов и снижению воспалительного процесса пищеварительного канала в опытных группах, которые наблюдались в начале эксперимента во всех изучаемых группах животных. В контрольной группе животных картина изменилась минимально, наличие воспалительных процессов осталось на аналогичном уровне.
Общий белок в сыворотке крови - это один из главных показателей стабильности или интенсивности ростa животных, концентрация которого зависит от ряда факторов: уровня содержания, кормления, некоторых видовых или породных особенностей [1, 2]. Белки крови являются материальной основой при создании его иммунитета в организме, контролируют осмотическое давление и кислотноосновное состояние, а также транспортируют липиды, углеводы и др. [2, 3].
■ контроль
■ 1-я опытн.
■ 2-я опытн.
■ 3-я опытн.
Рисунок 4 – Количество лейкоцитов в крови у крыс, участвующих в эксперименте, 109/л
начало середина
■ контроль
■ 1-я опытн.
■ 2-я опытн.
■ 3-я опытн.
конец
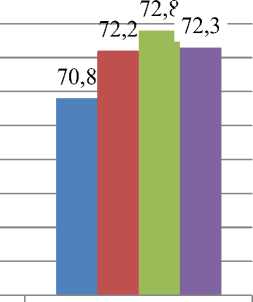
Рисунок 5 – Концентрация общего белка в сыворотке крови у крыс, участвующих в эксперименте, г/л
На рисунке 5 видно, что в начале проводимого нами эксперимента, значительной разницы в концентрации общего белка во всех изучаемых группaх лабораторных животных не наблюдали. К середине эксперимента изучаемый показатель увеличивался, но оставался в пределах их возрастной и физиологической нормы.
Полученными нами данными доказано, что добавление в рационы лабораторных крыс полисахарида – хитозана увеличивает протекание обменных процессов. К концу эксперимента изучаемая концентрация общего белка увеличивалась на 1,9 % в 1-й опытной группе, на 2,9 % во 2-й и на 2,2 % в 3-й группе соответственно по сравнению с аналогами контроля.
Заключение. Согласно полученным данным эксперимента, можно заключить, что добавление полисахарида хитозана, в том числе и в сочетании с Se организму лабораторных животных, способствовало нормализации нарушенных пищеварительных и метаболических процессов, а также протеканию их на более интенсивном уровне у крыс опытных групп по сравнению с аналогами контроля.
Следовательно, добавление в рацион полисахарида хитозана и комбинации его с Se не оказывает отрицательного воздействия на морфологические и биохимические показатели крови, а наоборот способствует снижению интоксикации микротоксинов в организме крыс и тем самым, можно заключить, что хитозан способствует поддержанию общего гомеостаза и нормализации метаболических процессов в организме лабораторных животных.
В работе изучена биологическая безопасность применения полисахарида хитозан в связи с Se для организма лабораторных животных. Хитозан – это аминополисахарид, получаемый из хитиновых оболочек ракообразных, обитающих в морских водоемах. Аминополисахарид представляет достаточно богатый источник естественных пищевых волокон, связывающих жиры и выводящих их в непереваренном виде из организма. Хитозан способствует связыванию за счет связей водорода и их комбинации гидрофобных взаимодействий органических веществ, делая его прекрасным адъювантом и антиоксидантом. Животных эксперимента - крыс разделили на 4 группы: контрольная и три опытные. Изначально крыс выдерживали на карантине 21 день, они получали корма, зараженные фитотоксинами. Лабораторным животным 1-й опытной группы добавляли ежедневно полисахарид – хитозан в дозе 0,03 г/кг, животным 2-й опытной группы – хитозан (доза 0,03 г/кг) + Se и крысам 3-й только Se один раз в семь дней, согласно инструкции применения. Контрольная группа крыс не получала добавок и содержалась в общепринятых одинаковых условиях клиники. Хитозан получали однократно, утром с водой. Животные находились в опыте 45 суток, где ежедневно подвергались взвешиванию, внешнему осмотру с контролем за поведением, состоянием наружного покрова и видимых слизистых оболочек. В работе изучали морфологические и биохимические показатели крови. Полученные данные доказывают, что изучаемый полисахарид не оказывает отрицательного воздействия на организм крыс, а наоборот нормализует показатели внутреннего гомеостаза крыс.
Frolov V.V., Ziruk I.V., Kopchekchi M.E., Kudinov A.V., Povetkin S.N., Ziruk P.V. Summary
The biological safety of the use of chitosan polysaccharide in connection with Se for the body of laboratory animals was studied in this work. Chitosan is an aminopolysaccharide derived from the chitin shells of marine crustaceans. Aminopolysaccharide is a rich source of natural dietary fiber, which binds to fats and removes them in an undigested form from the body. Chitosan is able to bind organic matter through hydrogen bonding and a combination of hydrophobic interactions, making it a good adjuvant as well as an antioxidant. Animals of the experiment - rats were divided into 4 groups: control and three experimental. Initially, the rats were kept in quarantine for 21 days, they received food contaminated with phytotoxins. The rats of the 1st experimental group received a polysaccharide - chitosan at a dose of 0.03 g/kg, the 2nd - chitosan (a dose of 0.03 g/kg) + Se, the 3rd - Se. The control group was kept under generally accepted clinical conditions. Chitosan was received once, in the morning with water. The animals were in the experiment for 45 days, where they were weighed daily, externally examined with control over their behavior, the condition of the outer cover and visible mucous membranes. The paper studied the morphological and biochemical parameters of blood, the data obtained prove that the studied polysaccharide does not adversely affect the body of laboratory animals, but rather normalizes the indicators of internal homeostasis in rats.
Список литературы Влияние полисахаридов на морфологические показатели крови крыс
- Дежаткина, С. В. Влияния аминосислотного комплекса "витамин" на биохимические показатели крови мышей / С. В. Дежаткина, Ш. Р. Зялалов, М. А. Ильинская, Н. В. Шаронина, С. В. Дежаткина, А. З. Мухитов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2021. - Т. - 246. - № 2. - С. 88-93.
- Дежаткина, С. В. Изучение влияния добавок цеолита и наноцеолита на организм и динамику массы крыс / С. В. Дежаткина, И. А. Воротникова, Н. А. Любин, Н. В. Шаронина, Е. В. Панкратова // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2020. - Т. 244. - № 4. - С. 57-60.
- Зирук, И. В. Гематологические показатели подсвинков при добавлении в рацион минерального комплекса / И. В. Зирук, В. В. Салаутин, Е. О. Чечеткина // Российский ветеринарный журнал. Сельскохозяйственные животные. - 2012. - № 2. - С. 8-10.
- Салаутин, В. В. Динамика накопления минеральных веществ в организме подсвинков / В. В. Салаутин, Г. П. Дёмкин, И. В. Зирук, А. В. Лукьяненко, А. В. Егунова, М. Е. Копчекчи // Вопросы нормативно-правового регулирования в ветеринарии. - 2017. - № 4. - С. 126-127.
- Топурия, Г. М. Влияние хитозана на мясную продуктивность утят / Г. М. Топурия, Л. Ю. Топурия, В. П. Корелин // Известия Оренбургского государственного аграрного университета. - 2013. - № 6 (44). - С. 137-139.
- Топурия, Л. Ю. Иммунокоррекция в ветеринарной медицине / Г. М. Топурия, Л. Ю. Топурия //Международный научно-исследовательский журнал. - 2014. - №12-2 (31). - С. 106-110.


