Влияние постоянной электрокардиостимуляции на клиническое течение заболеваний, сопровождающихся брадиаритмиями
Автор: Вершинина Е.О., Репин А.Н., Попов С.В., Тюкалова Л.И., Видишева О.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1-1 т.26, 2011 года.
Бесплатный доступ
Цель исследования: изучение клинической эффективности постоянной электрокардиостимуляции у пациентов с брадисистолическими нарушениями ритма сердца и проводимости. Показано, что имплантация постоянного электрокардиостимулятора у больных с брадисистолическими нарушениями ритма сердца в ранние и среднеотдаленные сроки наблюдения улучшает клиническое течение заболевания за счет уменьшения проявлений коронарной и сердечной недостаточности, улучшает качество жизни больных, снижает потребность в лекарственной терапии.
Имплантируемый электрокардиостимулятор, электрокардиостимуляция, брадикардия
Короткий адрес: https://sciup.org/14919387
IDR: 14919387 | УДК: 616.12-008.313.314
Текст научной статьи Влияние постоянной электрокардиостимуляции на клиническое течение заболеваний, сопровождающихся брадиаритмиями
Одними из основных патофизиологических механизмов смерти от сердечно-сосудистых заболеваний (около 50%) являются нарушения ритма и проводимости сердца [18]. По данным Всемирной организации здравоохране- ния, 16,7 млн человек страдают нарушениями ритма сердца [19]. Брадисистолические формы нарушений ритма и проводимости составляют значительную часть этих нарушений. Постоянная эндокардиальная электрокардиостимуляция (ЭКС) в настоящее время широко применя- ется для лечения пациентов данной категории [5, 9, 17]. В начале XXI столетия в мире ежегодно выполняется около 800 тыс. имплантаций электрокардиостимуляционных систем [4]. За период с 1982 г. в отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции НИИ кардиологии СО РАМН имплантировано более 6000 искусственных водителей ритма [10]. С момента первой имплантации ЭКС прошло уже более 50 лет, однако особенности течения заболевания на фоне имплантированного ЭКС остаются актуальной клинической проблемой [6–8]. Цель исследования: изучить клиническую эффективность постоянной электрокардиостимуляции у пациентов с брадисистолическими нарушениями ритма сердца и проводимости.
Материал и методы
Проведено проспективное исследование, в котором наблюдались 73 пациента с имплантированным постоянным ЭКС, проходившие лечение в НИИ кардиологии СО РАМН г. Томска с июня 2007 г. по июнь 2009 г. Средний возраст обследованных был 67,5±12,7 года, рост – 164,7±8,6 см, вес – 76,0±14,1 кг, из них 49% были мужчины, 51% – женщины, 88% больных страдали артериальной гипертензией. У 48 больных (66%) основным заболеванием была ишемическая болезнь сердца (ИБС), у 15 (21%) – гипертоническая болезнь, у 4 (6%) – постмио-кардитический кардиосклероз, 2 человека (3%) страдали ревматизмом, по 1 – вторичной тромбофилией, приведшей к острому инфаркту миокарда, врожденным нарушением ритма, состоянием после лучевой терапии опухоли средостения, тиреотоксическим поражением сердца. Сахарный диабет 2-го типа средней и легкой степени тяжести диагностирован у 10 человек (14%), нарушение толерантности к глюкозе – у 20 (27%). ХОБЛ фигурировала в диагнозе у 9 пациентов (12%).
Показания для имплантации постоянного ЭКС соответствовали общепринятым при брадиаритмиях [4]. У 20 больных имела место АВ блокада II–III ст., у 26 – СССУ I– II типов, у 3 – бинодальная болезнь, у 6 – эпизоды бради-систолии при хронической форме фибрилляции предсердий (ФП). У 15 пациентов ЭКС был установлен перед радиочастотной аблацией (РЧА) АВ соединения по поводу пароксизмальной формы фибрилляции предсердий. Отечественные ЭКС были имплантированы 32 пациентам (44%). У 38 пациентов (52%) проводилась стимуляция в режиме VVIR, у 5 (7%) – AAIR, у 30 (41%) – в режиме DDDR.
Пациентам исходно, через неделю, 1, 6, 12 мес. после операции имплантации постоянного ЭКС проводилось общеклиническое обследование, включавшее общий и биохимический анализ крови, коагулограмму с углубленным изучением ряда маркеров отдельных звеньев свертывающей системы, эхокардиографию, суточное мониторирование ЭКГ, перфузионную сцинтиграфию миокарда, спирометрию, тест 6-минутной ходьбы (ТШХ), оценку качества жизни с помощью опросника SF-36.
Cтатистическую обработку результатов выполняли с применением интегрированной системы статистического анализа и обработки результатов STATISTICA 6.0. фирмы Stat Soft Inc., USA, 1984 – 2001. Проверку статистичес- ких гипотез проводили с помощью непараметрических критериев Манна–Уитни и Вилкоксона. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение
У 41% обследованных больных (30 человек) наблюдались осложнения раннего послеоперационного периода. Это повышение температуры – у 28 больных (38%), из них до фебрильных цифр – у 3 пациентов (4%), местное воспаление ложа стимулятора – у 1 больного, необходимость замены электрода – у 2, гематома места имплантации – у 1, тромбоз вен руки на стороне имплантации – у 1, левосторонний пневмоторакс – у 1 пациента. Это соответствует данным литературы, согласно которым инфекционными осложнениями раннего послеоперационного периода сопровождаются от 0,02 до 12% имплантаций [12, 16].
В исследовании А.В. Ардашева с соавт. [1], включавшем 311 пациентов с брадисистолическими формами нарушения ритма сердца, общая летальность за период наблюдения 86 мес. составила 40,5%. Нами в динамике были осмотрены 62 пациента (85%); 11 человек по различным причинам выбыли из исследования. Из оставшихся под наблюдением двое больных перенесли острое нарушение мозгового кровообращения (у обоих в последующем выявлен тромбоз ушка левого предсердия). У одного больного в отдаленный послеоперационный период развился тромбоз левой плечевой вены. К 16-му мес. наблюдения умерли 3 пациента (4,8%). Сопутствующая терапия представлена в таблице 1.
Через полгода после установки постоянного ЭКС пациенты существенно реже нуждались в приеме дигоксина, однако через 16 мес. необходимость его приема возвратилась к исходному уровню. Через год после имплантации ЭКС была выявлена тенденция к снижению потребности приема мочегонных и антагонистов Са. К этому сроку только двое из наблюдаемых больных продолжали принимать пролонгированные нитраты, что было достоверно меньше исходного уровня. Описанная выше динамика приема кардиологических препаратов свидетельствует о благоприятном течении сердечной и коронарной недостаточности в наблюдаемой группе пациентов и снижении потребности в лекарственных средствах для лечения недостаточности кровообращения и стенокардии после имплантации ЭКС по сравнению с исходным состоянием, что согласуется с данными других авторов [2]. Кроме того, включение больных в группу наблюдения привело к достоверному увеличению количества пациентов, постоянно принимающих статины, что также способствовало более благоприятному течению ИБС.
При исследовании динамики показателей суточного мониторирования ЭКГ (табл. 2) было выявлено достоверное увеличение минимального числа сердечных сокращений (ЧСС) с 34,1 до 52 в минуту; р=0,0003. Существенно уменьшилось число пауз более 2 с (у 55,1% больных исходно против 15,6% через 6 и 10,4% через 16 мес.; р=0,001). Их сохранение после установки постоянного ЭКС всегда было связано с мышечным ингибированием импульса ЭКС и корригировалось уменьшением чувстви-
Таблица 1
Сопутствующая терапия
|
Сопутствующая терапия |
Исходно,% |
6 мес.,% |
16 мес.,% |
|
Аспирин и др. антиагреганты |
82 |
85 |
63 |
|
Ингибиторы АПФ |
78 |
80 |
56 |
|
β-адреноблокаторы |
29 |
50* |
38 |
|
Мочегонные |
53 |
65 |
31* |
|
Сердечные гликозиды |
14 |
2** |
4 |
|
Антагонисты Са |
44 |
33 |
23* |
|
Пролонгированные нитраты |
12 |
9 |
2** |
|
Антиаритмики |
11 |
13 |
13 |
|
Антикоагулянты |
15 |
26 |
19 |
|
Статины |
4 |
11 |
17** |
Примечание: * – р=0,1; ** – рЈ0,05 по сравнению с исходным значением.
тельности. Выявлена тенденция к увеличению количества желудочковых экстрасистол (ЖЭС) через 16 мес. после установки постоянного ЭКС (у 53% больных исходно против 94% через 16 мес.; р=0,063). При этом число больных, принимающих антиаритмические препараты, БАБ и сердечные гликозиды, существенно не изменилось. Таким образом, увеличение числа ЖЭС, вероятнее всего, обусловлено присоединением желудочковых нарушений ритма, связанных с работой ЭКС.
Выявлено существенное увеличение пройденного расстояния при проведении ТШХ через 6 и 16 мес. не только по сравнению с исходной величиной, но и через 16 мес. по сравнению с 6 мес. (274,1±105,0 м – исходно: 341,0±112,0 м – через 6 мес., 405,3±111,2 м – через 16 мес.; р ≥ 0,05), что свидетельствует об уменьшении проявлений недостаточности кровообращения на фоне постоянной ЭКС по сравнению с естественным течением брадиаритмий.
Постоянная трансвенозная ЭКС, выполненная по абсолютным показаниям при наличии клинической симптоматики, во всех случаях в целом сопровождается улучшением насосной и сократительной функции миокарда [14]. Однако при этом происходят отсроченные отрицательные изменения показателей ЭхоКГ. Через 16 мес. после имплантации ЭКС мы наблюдали достоверное увеличение ММ ЛЖ и ИММ (на 8 и 5,5% соответственно) по сравнению с исходными значениями, существенное нарастание КСИ (на 5,8%) и снижение ФВ ЛЖ (В) на 5,1%, что свидетельствует о снижении глобальной сократительной функции ЛЖ. Кроме сохраняющегося снижения величины пикового градиента на АК (на 21,6%) было выявлено расширение ФК АК (с 21,4±2,1 до 22,6±2,3 мм; р=0,001). Мы наблюдали тенденцию к увеличению СДПЖ (с 28,3±10,6 до 33,6±9,5 мм рт. ст.; р=0,079) и градиента регургитации на ТК (с 22,0±8,7 до 26,6±7,9 мм рт. ст.; р=0,097). Отмечалось нарастание дилатации обоих предсердий: объем ЛП увеличился с 25,5±8,0 до 27,0±6,8 мл; р=0,07, а ПП – с 22,2±6,3 до 24,2±5,9 мл; р=0,022. К концу срока наблюдения кроме дилатации обоих предсердий выше нормальных значений стала и среднегрупповая величина СДПЖ, чего не было исходно.
При перфузионной сцинтиграфии легких не было дефектов перфузии у 56,1% больных, обследованных исходно, у 56,6% – через 6 мес., у 60,9% – через 16 мес. Пе-
Таблица 2
Динамика нарушений ритма по данным суточного мониторирования ЭКГ после установки постоянного ЭКС
|
Нарушения ритма сердца |
Исходно (n=49), % |
6 мес. (n=45), % |
16 мес. (n=48), % |
|
ЖЭС |
53,1 |
82,2 |
93,8* |
|
Желудочковая тахикардия |
10,2 |
15,6 |
ЖТ14,6 |
|
Паузы более 2 с |
55,1 |
15,6** |
10,4** |
|
Наджелудочковая |
46,9 |
28,9 |
37,5 |
|
экстрасистолия Пробежки наджелудочковой |
26,5 |
22,2 |
18,8 |
|
тахикардии ЧСС мин |
34,1±8,3 |
53,3±9,0** |
52±4,8** |
|
ЧСС макс. |
122,2±38,0 |
119,2±31,9 |
113,5±21,5 |
|
ЧСС сред. |
- |
70±12,9 |
65,8±7,5 |
|
ФП |
30,6 |
15,6 |
31,3% |
Примечание: * – р≤0,1; ** – р≤0,05 по сравнению с исходным значением.
ред имплантацией постоянного ЭКС нарушение перфузии легких было выявлено у 43,9% больных; через 6 мес. их наличие подтвердилось у 41,5% пациентов, а через 16 мес. – у 32,6% больных. Общее число гипоперфузируе-мых сегментов до установки ЭКС было 22, через 6 мес. их стало 29,5, через 16 мес. – 12,5. Достоверного изменения числа больных с отсутствием или наличием нарушений перфузии легких, количества пораженных сегментов легких в целом в группе наблюдения выявлено не было.
При проведении спирографии через 6 и 16 мес. после установки постоянного ЭКС отмечается достоверное уменьшение индекса Генслара, мгновенной объемной скорости форсированного выдоха на уровне 25, 50, 75% форсированной жизненной емкости легких (ФЖЕЛ); МОС 25, 50, 75 в целом по группе наблюдения (табл. 3). Отсутствие при этом снижения объема форсированного выдоха за 1 с (ОФВ1) и жизненной емкости легких (ЖЕЛ) указывает на отсутствие рестриктивных нарушений и более вероятный обструктивный механизм ухудшения показателей внешнего дыхания в группе наблюдения.
В группе пациентов после имплантации постоянного ЭКС выявлена иммунологическая реакция на вмешательство в виде достоверного увеличения числа лейкоцитов с первых суток послеоперационного периода, сохранявшаяся в течение месяца после установки ЭКС (6,54±1,76 ∙ 103/mm3 исходно против 8,57±2,12 ∙ 103/mm3 через сутки и 6,66±1,78 ∙ 103/mm3 – через 1 мес.; р ≥ 0,05). Их увеличение происходило за счет достоверного нарастания палочкоядерных лейкоцитов в течение первой недели послеоперационного периода с последующей их нормализацией к концу первого месяца (0,66±1,28% исходно против 1,42±1,75% через неделю; р ≤ 0,05 и 1,18±1,45% – через 1 мес.; р ≥ 0,05) и существенным увеличением эозинофилов через месяц после операции (2,24±2,71% исходно против 3,34±3,64% через 1 мес.; р ≤ 0,05). Реакция иммунного ответа также проявилась в значимом увеличении СРБ (5,76±10,05 мг/л исходно против 12,65±28,32 мг/л через неделю; р ≤ 0,05 и 4,0±2,49 мг/л – через 1 мес.; р ≥ 0,05) и СОЭ (14,04±9,63 мм/ч исходно против 18,34±9,69 мм/ч через неделю; р ≤ 0 0,05 и 16,24±10,79 мм/ч – через 1 мес.; р ≥ 0,05) в течение пер-
Таблица 3
Динамика показателей спирографии
При анализе показателей свертывающей системы (табл. 4) было показано, что через полгода после имплантации ЭКС, кроме существенного снижения уровня фактора некроза опухоли- α (ФНО- α ) и фактора Виллебранда (ФВ), имелась также тенденция к снижению ингибитора активатора плазминогена (PAI). Через 16 мес. после имплантации ЭКС наблюдалось значимое снижение уровня общего фибриногена (ОФ), выявлена тенденция к уменьшению активированного частичного тромбопластинового времени (АЧТВ) и увеличению продолжительности агрескринового теста (АТ). Уровень D-димера был достоверно выше исходного значения через неделю после операции и сохранял свое существенное повышение в течение месяца после имплантации ЭКС. Через 6 и 16 мес. среднее значение D-димера в группе не отличалось от исходной величины. Трактовать эти изменения, на наш взгляд, можно следующим образом: имплантация ЭКС привела к уменьшению проявлений сердечной недоста-
Таблица 4
Динамика биохимических и коагуляционных показателей
|
Показатели |
Исход |
1 мес. |
6 мес. |
16 мес. |
|
PAI, нг/мл |
83,9±38,1 |
70,4±36,7 |
70,8±30,8* |
- |
|
Тканевой активатор плазминогена (t-PA), нг/мл |
8,4±6,8 |
12,7±6,0 |
6,6±5,9 |
- |
|
ФВ, Ед. /мл |
138,4±42,3 |
127,5±36,7 |
113,3±40,4** |
- |
|
ФНО-α, пкг/мл |
46,9±42,7 |
28,7±10,3 |
27,6±16,5** |
- |
|
Интерлейкин-1 (ИЛ-1), пкг/мл |
247,9±573,8 |
54,0±78,9 |
36,7±52,3 |
- |
|
D-димер, нг/мл |
294,0±508,2 |
377,1±399,8** |
227,6±176,5 |
261,1±300,2 |
|
ОФ, г/л |
3,71±1,05 |
3,52±0,99 |
3,69±1,18 |
3,31±1,04** |
|
РФМК, мг % |
6,6±3,43 |
6,20±3,78 |
5,75±3,01 |
7,27±3,96 |
|
АЧТВ, с АТ, с |
33,9±12,6 |
31,5±7,3 |
31,0±4,84* 14,6±8,4 |
30,9±3,13* 15,4±4,53* |
Примечание: * – р≤0,1; ** – р≤0,05 по сравнению с исходным значением.
диаторов воспаления и других биологически активных агентов, сопутствующих хронической сердечной недостаточности (ХСН), привело к уменьшению активации сосудисто-тромбоцитарного звена гемостаза, что проявилось достоверным уменьшением уровня ФВ, PAI в наблюдаемой группе больных, увеличению времени АТ. Снижение величины ОФ к 16 мес. наблюдения также носит благотворный характер, поскольку ОФ относится к белкам острой фазы и определяет вязкость крови и интенсивность агрегации тромбоцитов, а его повышение является фактором высокого тромбогенного риска. Активацию свертывающей системы и фибринолиза мы наблюдали в течение первого месяца после операции имплантации ЭКС в виде увеличения в крови уровня растворимых фибрин-мономерных комплексов (РФМК) и D-димера. Через 6 и 16 мес. средние значения этих показателей вернулись к исходным.
По данным И.Н. Посохова, Л.И. Тюкаловой [11], у пациентов с имплантированными ЭКС тромбоэмболия легочной артерии встречается в 14% случаев. Однако сами авторы считают, что точность данной оценки необходимо оценивать критически, так как рассматриваемая ими стандартизированная клиническая модель для определе- точности вследствие устранения брадиаритмий и нормализации сердечного ритма. Подтверждением этому служит достоверное снижение уровня про-воспалительных цитокинов (ФНО-α) через 6 мес. наблюдения. Уменьшение гипоксии тканей, эндотелия сосудов, снижение концентрации ме-
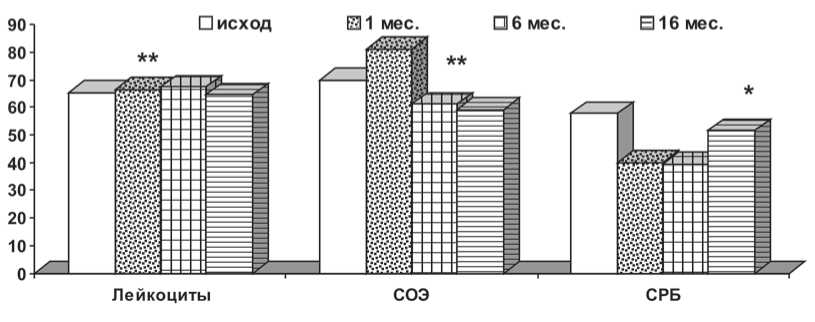
Рис. 1. Динамика показателей воспаления после имплантации постоянного ЭКС: ** – р ≤ 0,05; * – р ≤ 0,1 по сравнению с исходным значением
ния вероятности ТЭЛА может снижать свою прогностическую ценность, когда используется в иных условиях, чем те, в которых она разработана. О связи вероятности ТЭЛА с наличием имплантированного ЭКС, по мнению авторов, свидетельствует возрастание этой вероятности в течение года после имплантации ЭКС, а также большой процент больных со средней вероятностью ТЭЛА среди пациентов с VVI стимуляцией.
Нами не выявлено усиления процессов воспаления и активации гемостаза в ранний и среднеотдаленный период после имплантации ЭКС на фоне отрицательной динамики ЭхоКГ и спирографии, что вместе с данными перфузионной сцинтиграфии лег-
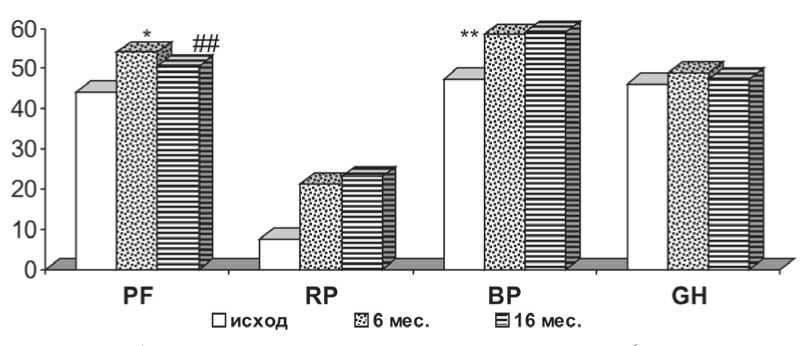
Рис. 2. Динамика физического компонента здоровья по данным опросника SF-36: ** – р ≤ 0,05; * – р ≤ 0,1 по сравнению с исходным значением; ## – р ≤ 0,05; # – р ≤ 0,1 по сравнению с 6 мес.; GH – общее состояние здоровья; PF – физическое функционирование; RP – ролевое функционирование, обусловленное физическим состоянием; BP – интенсивность боли
D исход 0 6мес. ЕИбмес.
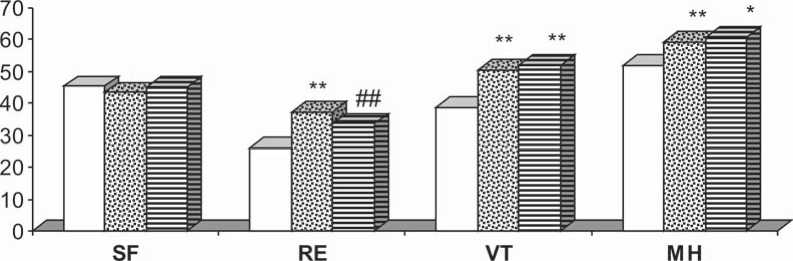
Рис. 3. Динамика психического компонента здоровья по данным опросника SF-36: ** – р ≤ 0,05; * – рd ≤ 0,1 по сравнению с исходным значением; ## – р ≤ 0,05; # – р ≤ 0,1 по сравнению с 6 мес.; SF – социальное функционирование; RE – ролевое функционирование, обусловленное эмоциональным состоянием; VT – жизненная активность; МН – психическое здоровье
ких подтверждает отсутствие статистически достоверного вклада тромбоэмболических осложнений в механизм этих нарушений у наблюдаемой нами группы пациентов. Вероятнее всего, они вызваны ухудшением биомеханики сердечных сокращений на фоне одно- и двухкамерной ЭКС. Однако это не исключает возможности наличия в рассматриваемой группе пациентов с тромбоэмболическими осложнениями, у которых выявление непосредственной роли имплантации ЭКС в генезе ТЭЛА требует дальнейших исследований.
При изучении качества жизни пациентов после имплантации постоянного ЭКС с помощью опросника SF-36 было выявлено, что улучшение физического состояния и уменьшение болевого синдрома первые полгода после имплантации ЭКС привело к улучшению ролевого эмоционального функционирования в этот же период. Устранение брадиаритмии и ощущение больными надежности сердечного ритма, уменьшение переживаний по поводу возможной остановки сердца после имплантации постоянного ЭКС достоверно улучшило показатели жизнеспособности и психического здоровья пациентов (рис. 2, 3).
Заключение
Имплантация постоянного электрокардиостимулятора у больных с брадисистолическими нарушениями ритма сердца в ранние и среднеотдаленные сроки наблюдения улучшает клиническое течение заболевания за счет уменьшения проявлений коронарной и сердечной недостаточности, улучшает качество жизни больных, снижает потребность в лекарственной терапии. Широко используемые в клинической практике одно- и двухкамерные режимы стимуляции сопровождаются некоторым ухудшением функциональных показателей работы сердца и легких, что является следствием нарушения биомеханики сердечных сокращений.
Список литературы Влияние постоянной электрокардиостимуляции на клиническое течение заболеваний, сопровождающихся брадиаритмиями
- Ардашев А.В., Джанджгава А.О., Желяков Е.Г., Кузнецов Ю.В., Волошко С.В. Клиническая эффективность постоянной электрокардиостимуляции у пациентов с брадисистолическими формами нарушений ритма сердца и проводимости//Кардиология. -2008. -№ 1. -С. 51-56.
- Баранович В.Ю., Веретенник В.Е. Постоянная электрокардиостимуляция при синдроме слабости синусового узла//Вестн. РУДН. -1999. -№ 1. -С. 81-84.
- Бокерия Л.А., Гудкова Р.Г. Состояние сердечно&сосудистой хирургии в РФ в 2004 г. -М., 2005. -С. 4-6.
- Бокерия Л.А., Оганов Р.Г., Ревишвили А.Ш. и др. Клинические рекомендации по проведению электрофизиологических исследований, катетерной аблации и применению имплантируемых антиаритмических устройств. ВНОА. -М.: Асконлайн, 2009. -237 с.
- Григоров С.С., Вотчал Ф.Б., Костылева О.В. 20-летний опыт применения постоянной эндокардиальной стимуляции сердца//Кардиология. -1987. -№ 11. -С. 26-29.
- Григоров С.С., Вотчал Ф.Б., Костылева О.В. Физиологическая электростимуляция сердца (применение различных типов имплантируемых стимуляторов, показания и противопоказания)//Кардиология. -1990. -№ 4. -С. 99-102.
- Дрогайцев А.Д., Нечаев Д.Д., Полежаев В.В. Клиническая оценка современных способов учащающей электростимуляции сердца//Тер. архив. -1990. -№ 9. -С. 55-61.
- Дрогайцев А.Д. Сравнительная оценка различных способов учащающей электростимуляции сердца при брадикардии//Кардиология. -1990. -№ 2. -С. 2.
- Егоров Д.Ф., Домашенко А.А. Опыт первых 100 операций постоянной электростимуляции сердца при синдроме слабости синусового узла: достижения, проблемы, перспективы//Тер. архив. -1989. -№ 1. -С. 61-63.
- Попов С.В., Антонченко И.В., Зенин С.А. Современные аспекты постоянной электрокардиостимуляции. -Новосибирск: Сибпринт, 2005. -190 с.
- Посохов И.Н., Тюкалова Л.И., Васильченко Е.Е., Видишева О.Н., Джураева Е.Р., Попов С.В. Вероятность тромбоэмболии легочной артерии у пациентов с имплантированными электрокардиостимуляторами по ретроспективной клинической оценке//Бюл. СО РАМН. -2005. -Т. 117, № 3. -С. 14-17.
- Ревишвили А.Ш. Quality standards of devices therapy. Surgical complications//Europace-2005. -Abstr., Prague. -2005. -667 p.
- Сердюков Д.А., Егоров Д.Ф., Юдина О.В. Тромбоэмболические осложнения постоянной электрокардиостимуляции//Вестн. аритмол. -2008. -№ 54. -С. 48-54.
- Элтаназаров М.Д. Сравнительный анализ систоло-диастолической функции сердца у больных ишемической болезнью сердца с полными атриовентрикулярными блокадами при однокамерной и двухкамерной электрокардиостимуляции: автореф. … канд. мед. наук. -СПб., 2009. -20 с.
- Bernstein A., Parsonnet V. Survey of cardiac pacing and defibrillation in the United States in 1993//Am. J. Cardiol. -1996. -Vol. 78. -Р. 187-196.
- Bernstein A.D., Parsonnet V. Survey of cardiac pacing in the United States in 1989//Am. J. Cardiol. -1992. -Vol. 69. -Р. 331.
- Connolly S., Kerr C., Gent M. For the Canadian Trial of Physiologic Pacing Investigators. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes//N. Engl. J. Med. -2000. -Vol. 342. -P. 1385-1391.
- Myerburg R.J., Castellanos A. Cardiac arrest and sudden cardiac death//Heart disease: a textbook of cardiovascular medicine/E. Braunwald, D.P. Zipes, P. Lippy (eds.). -6th ed. -Philadelphia,PA: W.B. Saunders, 2001. -P. 890-931.
- World Health Organization. Cancer pain relief. -Geneva: WHO, 1986. -846 p.


