Влияние процесса инкапсуляции на сохранение антиоксидантных свойства флавоноидов
Автор: Фаткуллин Ринат Ильгидарович, Васильев Андрей Константинович, Калинина Ирина Валерьевна, Брызгалова Анна Дмитриевна, Семиздралов Иван Александрович
Рубрика: Проектирование и моделирование новых продуктов питания
Статья в выпуске: 1 т.9, 2021 года.
Бесплатный доступ
Целью настоящего исследования стало изучение влияния технологий инкапсуляции флавоноидов на их антиоксидантные свойства. В качестве объектов исследования были выбраны наиболее изученные представители флавоноидов - таксифолин и рутин, являющиеся известными сильными антиоксидантами. Для данных соединений установлен обширный перечень фармакологических эффектов, определяющих возможность их использования в качестве функциональных пищевых ингредиентов. Вместе с тем, являясь химически лабильными веществами, таксифолин и рутин склонны к окислительной деградации и химическим превращениям в процессе пищеварения, что может привести к значительному снижению или полной потере биоактивных свойств. Возможным решением для указанных проблем может быть применение технологий инкапсуляции. В рамках исследования оценивалась возможность использования двух подходов к инкапсуляции: для рутина - комплексной коацервации с применением желатина и пектина; для таксифолина - инкапсуляции в β-циклодекстрин. Для процесса инкапсуляции применяли методы физического воздействия: инкапсуляцию таксифолина проводили при скорости 200 об/мин в течение 3 ч при температуре 40 °С, а рутина в условиях механического перемешивания при скорости 500 об/мин в течение 15 мин. Эффективность подходов оценивали по показателям общей антиоксидантной активности (DPPH метод) и расчету индекса биоактивности с применением модели переваривания in vitro. Результаты определения общей антиоксидантной активности показали, что исходные формы флавоноидов характеризуются выраженными антиоксидантными свойствами в диапазоне 65-85 %. Инкапсуляция флавоноидов привела к существенному снижению значений общей антиоксидантной активности, примерно на 19,3 % для таксифолина и на 55,4 % для рутина, возможно за счет применения разных подходов инкапсуляции. Оценка потенциальной биоактивности на модели in vitro показало целесообразность использования инкапсуляции для защиты флавоноидов в процессе пищеварения и обеспечения сохранности их антиоксидантных свойств. Значения индексов биоактивности для инкапсулированных форм составили 72,4 и 80,0 % для таксифолина и рутина соответственно, против 51,2 и 41,5 % для исходных форм таксифолина и рутина.
Таксифолин, рутин, инкапсуляция, метод коацервации, β-циклодекстрин, антиоксидантная активность, индекс биоактивности
Короткий адрес: https://sciup.org/147234332
IDR: 147234332 | УДК: 661.124+664 | DOI: 10.14529/food210105
Текст научной статьи Влияние процесса инкапсуляции на сохранение антиоксидантных свойства флавоноидов
Растительные биологически активные вещества (БАВ) в клинических исследованиях доказали многочисленные фармакологические эффекты для здоровья человека. Многие из них можно использовать для немедикаментозной коррекции неинфекционных заболеваний, таких как сердечно-сосудистые, метаболические заболевания, а также некоторые формы онкологических заболеваний. Однако многие природные БАВ химически нестабильны и подвержены окислительной деградации, что может приводить не только к их разрушению, но и к появлению недопустимых характеристик самого обогащенного продукта и отрицательно повлиять на стабильность продукта при хранении [1–4].
Зачастую применение чистых БАВ (например, флавоноидов) в составе биологически активных добавок или в составе пищевых продуктов весьма ограничено в силу их особенностей, например, низкой растворимости, плохой биодоступности, а также легкого разрушения под действием внешних факторов [5, 6, 10, 11].
По этой причине для обеспечения сохранения положительных свойств биологически активных соединений или улучшения их тех- нологической пригодности для пищевых производств, а также увеличения биодоступности и биоактивности для организма человека требуется разработка новых технологических решений.
Одним из таких решений могут быть технологии инкапсуляции, среди которых мик роинкапсуляция и наноинкапсуляция. П од инкапсуляцией понимают процесс, при котором БАВ защищается материалом носителя при образовании частиц или капсул в микро-метровом или нанометровом масштабе [2].
Технологии инкапсуляции широко применяются в пищевой и фармацевтической промышленности для повышения эффективности полифенолов, микроэлементов, ферментов и др., позволяя создавать защитные барьеры от воздействия света, кислорода, pH, влаги, температурного воздействия и других стрессорных факторов внешней среды. На наш взгляд, микроинкапсуляция и наноинкапсуляция имеют реальные перспективы к масштабированию в промышленных объемах.
Основной задачей инкапсуляции является увеличение биодоступности, контролируемое высвобождение БАВ в организме человека и точность концентрации активного компонента. Поэтому одним из основных факторов успешного процесса инкапсуляции Б АВ является выбор подходящего инкапсулирующего агента. При этом важно учитывать некоторые особенности подбора агентов для инкапсуляции:
-
– с точки зрения безопасности инкапсулирующие агенты должны быть одобрены как биоразлагаемые и безопасные (в странах ЕС «общепризнанные безопасные вещества» имеют маркировку GRAS) материалы для пищевых продуктов;
-
– с точки зрения функциональности инкапсулирующие вещества должны обладать способностью защищать биоактивные соединения при различных условиях обработки;
-
– они должны иметь приемлемые технологические свойства, а это, как правило, низкая вязкость при высокой концентрации, хорошая эмульгирующая способность и растворимость [2, 3–6, 16, 17].
Идеально, если инкапсулирующие вещества способны обеспечить «адресную доставку», преодолевая кислотное и ферментативное состояние желудочно-кишечного тракта, а также увеличить проникающую способность БАВ.
Наиболее широко для инкапсуляции БАВ используются природные биополимеры, среди которых белки, углеводы и жиры. Они, как правило, биоразлагаемы и нетоксичны для организма человека. В частности, из углеводов широко используются полисахариды – крахмал, циклодекстрины, пектины; из белков – желатин, зеин, глиадин, сывороточные белки. Липиды наиболее применимы в технологии получения эмульсий, для которых используются растительные масла и различные поверхностно-активные вещества [1, 2, 4, 9–11].
Среди БАВ антиоксидантного действия достаточно известны и широко используются в качестве антиокислителей в пищевой индустрии таксифолин и рутин. При размещении в систему пищевого продукта данные вещества могут значительно утрачивать свои свойства и не проявлять в полной мере свои технологические функции.
Целью настоящего исследования стала разработка инкапсулированных комплексов таксифолина и рутина с применение технологии конъюгации (с использованием β-цикло-декстрина) и коацервации (с применением желатина и пектина) и оценка влияния технологии инкапсуляции на сохранение свойства биологически активного вещества.
Материалы и методы
В рамках настоящего исследования в качестве БАВ были выбраны флавоноиды – рутин и таксифолин, как наиболее изученные растительные антиоксиданты, перспективные для использования в качестве функциональных пищевых ингредиентов при производстве функциональных, обогащенных и специализированных пищевых продуктов. Общая характеристика и молекулярная структура которых представлены на рис. 1 и в таблице соответственно.
Рутин (кверцетин-3-рутинозид (3', 4', 5, 7-тетрагидроксифлавон-3β- d- рутинозид)) представляет собой фенольное соединение с хорошо изученным терапевтическим потенциалом и высокой степенью безопасности. Рутин обладает рядом потенциально полезных эффектов для организма человека, среди которых антирадикальное действие, противовоспалительное, противоопухолевое действие и свойства укрепления кровеносных капилляров [12].
Таксифолин – это флаванонол, который занимает лидирующие позиции среди известных антиоксидантов, включая витамины С, Е и
β-каротин, превосходя их по шкале ORAC. За последние несколько десятилетий таксифолин достаточно интенсивно изучался благодаря уникальным плейотропным биологическим свойствам. Для него установлены такие фармакологические эффекты как противовосполи-тельное действие, гепатопротекторное, капилляропротекторное, антиоксидантное, дезин-токсикационное и др. Как часть фенольных соединений таксифолин был обнаружен во многих растениях, различных ягодах, фруктах, овощах, пищевых маслах, орехах, лекарственных травах и растениях [1, 2, 10, 11].
Физико-химические свойства рутина и таксифолина [7]
|
Свойство |
Значение |
|
|
Рутин |
Таксифо-лин |
|
|
Растворимость в воде, г/л |
12,8 |
1,16 |
|
log P |
–0,54 |
1,07 |
|
Физиологический заряд |
–1 |
0 |
|
Количество акцепторов водорода |
21 |
7 |
|
Количество доноров водорода |
13 |
5 |
|
Площадь полярной поверхности, Å2 |
344,67 |
127,45 |
|
Преломление, м³·моль–1 |
172,56 |
74,61 |
|
Поляризуемость, Å3 |
73,13 |
29,03 |
|
Количество бензойных колец |
6 |
3 |
Объектами исследования были определены порошкообразные формы флавоноидов:
таксифолин , изготовитель ООО «Такси-фолия», Белгород. Свидетельство о государственной регистрации № RU 77.99.003 Е.018404.05.11 от 6 мая 2011 г. Чистота 98– 99 %;
рутин , изготовитель Now Foods (США), источник – цветы Сафоры японской).
В качестве вспомогательных веществ для инкапсуляции использовали:
β-циклодекстрин (βCD) пищевой (Е459), был приобретен в ООО «Кемикал Лайн», использовали для инкапсуляции таксифолина;
желатин говяжий, изготовитель
пектин цитрусовый, изготовитель Valde.
а)
б)
Рис. 1. Пространственная структура молекул рутина (а) и таксифолина (б) [7]
Условия инкапсуляции
Инкапсуляцию таксифолина в βCD проводили при соотношении компонентов 3:1 по молярной массе. Навески соответствующих количеств таксифолина и βCD растворяли в установленном количестве растворителя (40 % водно-этанольный раствор) и вымешивали при скорости 200 об/мин в течение 3 ч при температуре 40 °С.
Инкапсуляцию рутина проводили путем его внесения в установленном количестве в предварительно подготовленный водный раствор желатина (2 мас. %/об.) в условиях механического перемешивания при скорости 500 об/мин в течение 15 мин. Затем в полученную суспензию был внесен водный раствор пектина (2 мас. %/об.) и созданы условия для коацервации путем изменения значения рН с применением 0,5н раствора HCl.
Методы исследования
Полученные в ходе инкапсуляции суспензии таксифолина и рутина оценивали в сопоставлении с исходным видом, по следующим показателям при использовании описанных методов:
Морфология инкапсулированных комплексов изучалась путем приготовления неокра- шенных препаратов раздавленная капля с использованием просвечивающей микроскопии при увеличении *640.
Общая антиоксидантная (антиради-кальная) активность определялась методом DPPH (%) по модификации [14]. Использовали метанольный раствор DPPH 60 мкМ, 1 мл которого смешивали с 1 мл исследуемого раствора, инкубировали в темноте в течение 30 мин. Поглощение измеряли спектрофотометрически при 515 нм.
АОА рассчитывали по формуле:
2-я фаза - фаза тонкого кишечника (рН 6,5-7, ферменты панкреатин и липаза, температура 37 °C, 2 ч), затем смесь центрифугируется (8000 об/мин, 10 мин), фильтруется через мембранный ацетат-целлюлозный фильтр (0,45 мкм).
В полученном фильтрате определяется количество ДГК и АОА (DPPH, %).
Индекс биоактивности (ИБА, %), рассчитываемый по формуле:
И БА =
ЛПЛ 1 - ( D i - D j )
АОА =------- j—
АОАконц АОА исх
Х 100,
D c
х 100,
где D i - оптическая плотность исследуемого раствора; D j - оптическая плотность контрольного раствора DPPH с метанолом; D c -оптическая плотность раствора DPPH.
Потенциальная биоактивность - на основе определения индекса биоактивности (ИБА) по методике [13].
Использование моделирования процесса переваривания in vitro проходило последовательно в две фазы:
где АОАконц - АОА (DPPH, %) БАВ после процесса переваривания in vitro ; АОАисх -АОА (DPPH, %) БАВ в исследуемом растворе
до процесса переваривания.
Результаты исследования и их обсуждение
Результаты исследования морфологических характеристик (рис. 2) исходных форм флавоноидов - таксифолина и рутина и их инкапсулированных комплексов показывают, что технологии инкапсуляции в значительной степени изменяет морфологию БАВ. Если исходные формы флавоноидов представляют собой кристаллы неправильной формы и раз-
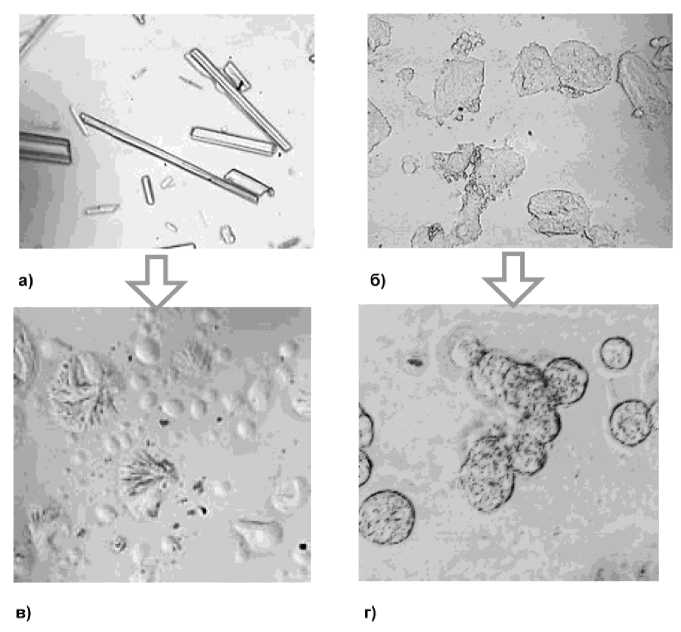
Рис. 2. Результаты микроскопии флавоноидов (препарат – раздавленная капля, увеличение х640 ): исходных форм (а – таксифолин; б – рутин) и инкапсулированных комплексов (в – таксифолин-βCD; г – коацерват рутина)
ного размера (см. рис. 2а и 2б), то после проведения инкапсуляции (см. рис. 2в и 2г) четко видны комплексы включения флавоноидов в соответствующую «систему доставки».
Вместе с тем, для оценки эффективности выбранных технологий инкапсуляции необходима оценка их влияния на биологическую активность БАВ. Поэтому в рамках настоящих исследований была предпринята попытка изучить роль технологий инкапсуляции для сохранении антиоксидантных свойств флавоноидов в процессе их пищеварения.
Исследования показали, что процесс инкапсуляции оказывает влияние на антиоксидантные свойства БАВ (рис. 3). Значения показателя общей АОА (DPPH, %) инкапсулированного таксифолина снизились на 19,3 % по отношению к исходному образцу. Это может быть объяснено экранировкой части OH-групп таксифолина при формировании конъюгата, которые не приняли участия в реализации антиоксидантного эффекта.
Ранее проведенные исследования показали, что наиболее вероятным при формировании конъюгатов таксифолина и βCD является взаимодействие, экранирующее две OH-группы фенильного заместителя таксифолина [1, 2, 10, 11].
Снижение АОА для рутина, инкапсулированного методом коацервации, составило 55,4 % по отношению к АОА исходного рутина. Данные результаты могут быть обусловлены тем, что комплексная защитная оболочка из желатина и пектина при коацервации полностью покрывает биологически активное вещество, не позволяя ему вступать в реакцию с DPPH-реактивом. АОА коацервата (30,2 %), вероятно, сформирована за счет рутина, оставшегося неинкапсулированным. Согласно имеющихся в литературе данных, эффективность инкапсуляции при использовании комплексной коацервации составляет в среднем 60–80 % и в значительной степени зависит от правильно подобранных условий проведения процесса инкапсуляции, в первую очередь, значений рН.
На следующем этапе исследований была определена потенциальная биодоступность исходных флавоноидов и их инкапсулированных комплексов с использованием модели переваривания in vitro . Результаты определения индексов биоактивности представлены на рис. 4.
Рассматривая процессы инкапсуляции с точки зрения их влияния на биологические эффекты образующихся комплексов, большинство исследований доказывают, что технологии инкапсуляции способствует сохранности флавоноидов в процессе пищеварения, обеспечивая более эффективную их доставку в организм человека. Согласно данным литературы снижение антиоксидантной активности в результате in vitro переваривания в первую очередь зависит от класса фенольного соединения, его устойчивости к воздействию рН, ферментов и склонности к структурным превращениям, которые приводят к метаболитам с различными химическими свойствами и, как правило, с более низкой биоактивностью [5, 6, 9, 15].
Проведенные авторами научные исследования показали, что после процедуры переваривания in vitro потенциальная биоактивность (выраженная индексом биоактивности) исходных форм флавоноидов снизилась на 51,2 и 41,5 % для таксифолина и рутина соответственно. Вместе с тем, инкапсуляция таксифо-лина в βCD позволила в значительной степени обеспечить сохранность антиоксидантных свойств БАВ, И БА составил 72,4 %. Наибольшую же эффективность с точки зрения сохранения потенциальной биоактивности показала технология коацервации, которая позволила обеспечить значения ИБА для рутина более 80 %, а значит предотвратить процессы окислительной деградации БАВ при пищеварении, снизить уровень его атакуемости ферментами. Это, в свою очередь, обеспечивает большее остаточное количество действующего вещества после процедуры переваривания в модели in vitro , что согласуется и с результатами исследований, представленными в доступной литературе [4, 12, 16, 17].
Заключение
Таким образом, представленные материалы и исследования продемонстрировали эффективность и целесообразность использования подходов получения конъюгатов таксифо-лина и коацерватов рутина для обеспечения сохранности антиоксидантных свойств данных флавоноидов и возможность более эффективной их доставки в системы организма человека.
Несмотря на неспособность модели переваривания in vitro полностью имитировать физиологические условия, возникающие при реальном пищеварении человека, такие модели целесообразно использовать в качестве прогностической оценки биоактивности как от-
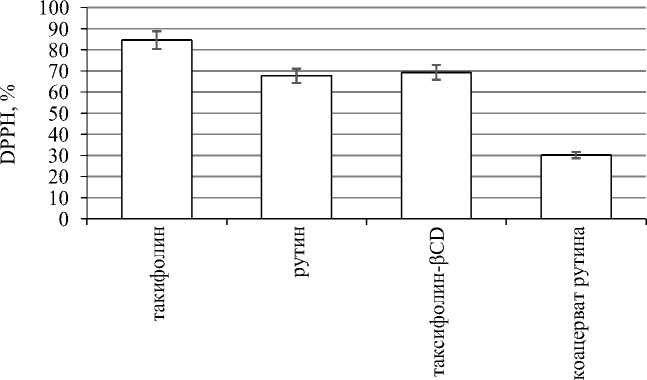
Рис. 3. АОА (DPPH, %) водных растворов (0,01 %) исходных и инкапсулированных флавоноидов
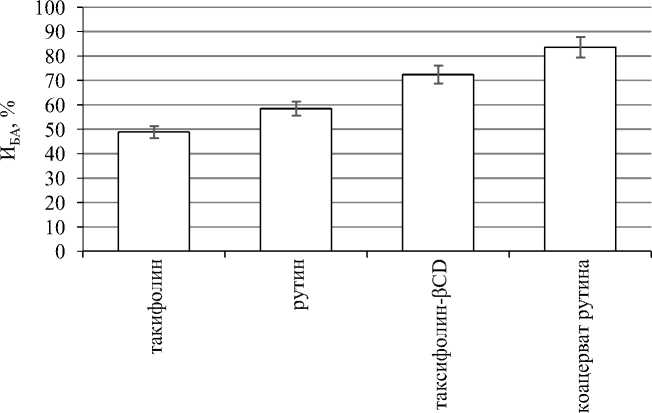
Рис. 4. Потенциальная биоактивность водных растворов (0,01 %) исходных и инкапсулированных флавоноидов (И БА )
дельных пищевых ингредиентов, так и готовых пищевых продуктов [8].
Вместе с тем, для оценки эффективности рассматриваемых подходов инкапсуляции требуется расширение исследований, в том числе в направлении оценки уровня загрузки капсульных систем, их дисперсного состава, влияния технологий инкапсуляции на уровень биодоступности БАВ и т. д.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011, при финансовой поддержке гранта Президента РФ для молодых ученых для государственной поддержки молодых российских ученых - кандидатов наук МК-3690.2021.5.
Список литературы Влияние процесса инкапсуляции на сохранение антиоксидантных свойства флавоноидов
- Калинина, И.В. Повышение биоактивности дигидрокверцетина на основе ультразвуковой микронизации / И.В. Калинина, И.Ю. Потороко, Р.И. Фаткуллин, Д. Иванова, Й. Канева-Киселова, Ш. Сонавэйн // Технология и товароведение инновационных пищевых продуктов. - 2019. - № 1(54). - С. 27-33.
- Калинина, И.В. Исследование стабильности наноэмульсий с дигидрокверцетином, полученных на основе ультразвукового воздействия /И.В. Калинина // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». - 2019. -Т. 7, № 3. - С. 52-58. DOI: 10.14529/ food190306
- Клышев, Л.К. Флавоноиды растений (распространение, физико-химические свойства, методы исследования) / Л.К. Клышев, В.А. Бандюкова, Л.С. Алюкина. - Алма-Ата: Наука, 1978. - 220 с.
- Шипилов, Д.А. Новые производные в-циклодекстрина как потенциальные носители лекарственных средств. Особенности синтеза и фармакологического действия: дис. ... канд. хим. наук: 02.00.03 / Шипилов Дмитрий Алексеевич. - М., 2018. - 174 с.
- Bouayed, J. Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestionvs, their native patterns / J. Bouayed, H. Deufier, L. Hoffmann, T. Bohn // Food Chemistry. - 2012. - Vol. 131(4). - Р. 1466-1472.
- Chen, G.-L. Total phenolic, flavonoid and antioxidant activity of 23 edible flowers subjected to in vitro digestion / G.-L. Chen, S.-G. Chen, Y.-Q. Xie, F. Chen, Y.-Y. Zhao et al. // Journal of Functional Foods. - 2015. - Vol. 17. -Р. 243-259.
- FooDB [Electronic resource]. - URL: http://foodb.ca.
- Hur, S. J. In vitro human digestion models for food applications / S. J. Hur, B. O. Lim, E. A. Decker, D. J. McClements // Food Chemistry. -2011. - Vol. 125(1). - Р. 1-12.
- Lorrain, B. Dietary iron-initiated lipid oxidation and its inhibition by polyphenols in gastric conditions / B. Lorrain, O. Dangles, M. Loonis, M. Armand, C. Dufour // Journal of Agricultural and Food Chemistry. - 2012. - Vol. 60. - Р. 9074-9081.
- Potoroko I.Yu., Kalinina I.V., Naumenko N.V., Fatkullin R.I., Nenasheva A.V., Uskova D.G., Sonawane S.H., Ivanova D.G., Velyamov M.T. Sonochemical Micronization of Taxifolin Aimed at Improving Its Bioavailability in Drinks for Athletes // Человек. Спорт. Медицина. -2018. - Т. 18, № 3. - С. 90-100. DOI: 10.14529/hsm180309
- Potoroko I.U., Kalinina I.V., Naumenko N.V., Fatkullin R.I., Shaik S., Sonawane S.H., Ivanova D., Kiselova-Kaneva Y., Tolstykh O., Paymulina A.V. Possibilities of Regulating Antioxidant Activity of Medicinal Plant Extracts // Человек. Спорт. Медицина. - 2017. - Т. 17, № 4. - С. 77-90. DOI: 10.14529/hsm170409
- Ravi, G.S. Mathias Nano-lipid complex of rutin: Development, characterisation and in vivo investigation of hepatoprotective, antioxidant activity and bioavailability study in rats / G.S. Ravi, R.N. Charyulu, A. Dubey, P. Prabhu, S. Hebbar, A.C. // AAPS PharmSciTech, 19 (2018), P. 3631-3649.
- Rodríguez-Roque, M. J. Impact of food matrix and processing on the in vitro bioaccessibility of vitamin C, phenolic compounds, and hydrophilic antioxidant activity from fruit juice-based beverages / M. J. Rodríguez-Roque, B. de Ancos, C. Sánchez-Moreno, M. P. Cano, P. Elez-Martínez et al. // Journal of Functional Foods. - 2015. - Vol. 14. - P. 33-43.
- Sui, X. Changes in the color, chemical stability and antioxidant capacityof thermally treated anthocyanin aqueous solution over storage /X. Sui, S. Bary, W. Zhou // Food Chemistry. - 2016. - Vol. 192. - Р. 516-524.
- Svendsen, A. Lipase protein engineering / A. Svendsen //Biochimica et Biophysica Acta. -2000. - Vol. 1543, iss. 2. - Р. 223-228.
- Yada, R. Y. Engineered nanoscale food ingredients: evaluation of current knowledge on material characteristics relevant to uptake from the gastrointestinal tract / R. Y. Yada, N. Buck, R. Canady, C. DeMerlis, T. Duncan et al. // Comprehensive Reviews in Food Science and Food Safety. - 2014. - Vol. 13. - Р. 730-744.
- Yang, L.-J. Host-guest system of nimbin and в-cyclodextrin or its derivatives: Preparation, characterization, inclusion mode, and solubilization /L.-J. Yang, B. Yang, W. Chen, R. Huang, S. J. Yan, J. Lin // Journal of Agricultural and Food Chemistry. - 2010. - Vol. 58. -P. 8545-8552.


