Влияние протеазы и фитазы на физиологическое состояние спиртовых дрожжей при культивировании
Автор: Ковалева Т.С., Агафонов Г.В., Яковлев А.Н., Яковлева С.Ф.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (82), 2019 года.
Бесплатный доступ
В производстве этилового спирта применяются дрожжи Saccharomyces cerevisiae. Основные требования, предъявляемые к дрожжам, используемым в производстве этилового спирта из крахмалсодержащего сырья: спиртовые дрожжи, применяемые при переработке крахмалистого сырья, должны иметь высокую бродильную активность; полную сбраживаемость сахаров, устойчивость к продуктам метаболизма, устойчивость к развитию посторонней микрофлоры. В качестве источника протеазы использовали протеолитический ферментный препарат Пролайв BS Ликвид. В качестве источника фитазы применяли ферментный препарат Кингфос. Изучали влияние ферментных препаратов нейтральной протеазы Пролайв BS Ликвид и фитазы Кингфос на бродильную активность спиртовых дрожжей Saccharomyces cerevisiae расы XII. Максимальной бродильной активностью обладают дрожжи, культивируемые на сусле, полученном с использованием протеазы и фитазы. Продолжительность фазы экспоненциального роста в опыте составляет 14-16 часов, в контроле 18-20 ч...
Осахаривание, ферментные препараты, глюкоамилаза, разваренная масса, величина рн, температура, ячменное сусло, гидролих крахмала, мультиэнзимный комплекс
Короткий адрес: https://sciup.org/140248284
IDR: 140248284 | УДК: 640 | DOI: 10.20914/2310-1202-2019-4-98-102
Текст научной статьи Влияние протеазы и фитазы на физиологическое состояние спиртовых дрожжей при культивировании
В производстве этилового спирта применяются дрожжи Saccharomyces cerevisiae , которые являются одноклеточными микроорганизмами. Дрожжи Saccharomyces cerevisiae являются
факультативными анаэробами, по типу питания – хемоорганогетеротрофами; по отношению к активной кислотности среды – ацидофилами [1–4].
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Основные требования, предъявляемые к дрожжам, используемым в производстве этилового спирта из крахмалсодержащего сырья: спиртовые дрожжи, применяемые при переработке крахмалистого сырья, должны иметь высокую бродильную активность, полную сбраживаемость сахаров, устойчивость к продуктам метаболизма (особенно к спирту), к развитию посторонней микрофлоры.
Для нормального метаболизма дрожжевых клеток необходимо содержание в питательной среде всех веществ, а также необходимы условия, исключающие стрессовые воздействия, вызываемые температурами, высокими концентрациями углеводов и этанола [5, 6].
Совокупность характеристик, отражающих потребности дрожжевых организмов в определенных физико-химических условиях среды, относят к физиологическим признакам. Одним из основных признаков является способность к сбраживанию сахаров до этанола и углекислого газа. Способность дрожжей сбраживать определенное количество сахара за единицу времени называют бродильной активностью, которая определяется по количеству выделившегося диоксида углерода в единицу времени. Одновременно определяют процесс размножения дрожжей и накопление в клетках гликогена [7–11].
Повышение бродильной активности дрожжей может быть достигнуто применением сбалансированного состава питательной среды.
Материалы и методы
В качестве источника протеазы использовали протеолитический ферментный препарат Пролайв BS Ликвид. Ферментный препарат нейтральной протеазы Пролайв BS Ликвид получают путём глубинного культивирования бактериального штамма Bac. subtilis . Представляет собой сиропообразную жидкость светлокоричневого цвета удельной плотностью 1,25 г./см 3 и обладает высокой протеолитической активностью. Пролайв BS Ликвид – это эндофермент, гидролизующий пептидные связи в белках с образованием растворимых пептидов и аминокислот, что способствует обогащению среды дополнительным азотистым питанием для дрожжей. Активность ферментного препарата 600–750 ед. ПС/см³. Оптимальные условия действия препарата: рН 5,5–7,5; температура 50–55 °С.
В качестве источника фитазы применяли ферментный препарат Кингфос. Ферментный препарат Кингфос (Kingphos) содержит фитазу (Мiо inоsitоll hехарhоsрhаtе рhоsрhо hуdrоlаsе ЕС Nо.: 3.1.3.8) с активностью не менее 10000 ед./г (10%). Продуцент – Pichia pastoris . По внешнему виду ферментный препарат Кингфос представляет собой порошок белого или желтоватого цвета. Оптимальные условия действия препарата: рН 5,5–6,5; температура 40–45 °С.
Для подсчета клеток дрожжей применяли камеру Горяева. Для определения процентного содержания нежизнеспособных клеток на предметном стекле каплю дрожжей Saccharomyces cerevisiae смешивали с каплей метиленового синего. Приготовленный препарат просматривали в 10 полях зрения. Определяли процентное содержание нежизнеспособных клеток по отношению к общему числу клеток, наблюдаемых в поле зрения. Хорошие засевные дрожжи содержат не более 1% мертвых клеток.
Количество почкующихся клеток характеризует способность дрожжей к размножению: активные дрожжи содержат 50–70% клеток с почками. Из дрожжевой суспензии готовят препарат «раздавленная капля» и определяют процентное содержание почкующихся клеток по отношению к суммарному количеству дрожжей с почками и без них.
Изучали влияние ферментных препаратов нейтральной протеазы Пролайв BS Ликвид и фитазы Кингфос на бродильную активность спиртовых дрожжей Saccharomyces cerevisiae расы XII. При приготовлении дрожжевого сусла в него вносили ферментный препарат Пролайв BS Ликвид при дозировке 0,3 ед. ПС/г крахмала и ферментный препарат фитазы Кингфос при дозировке 0,5 ед. ФС/г крахмала. В контроле дополнительные ферментные препараты при приготовлении дрожжевого сусла не вносили. В сусло при температуре 30 °С вносили дрожжи в количестве 10% от объема сусла. Процесс дрожжеге-нерации проводили 18–20 ч при температуре 28–30 °С в колбах на 750 см 3 . Ежечасно весовым методом определяли количество выделенного углекислого газа.
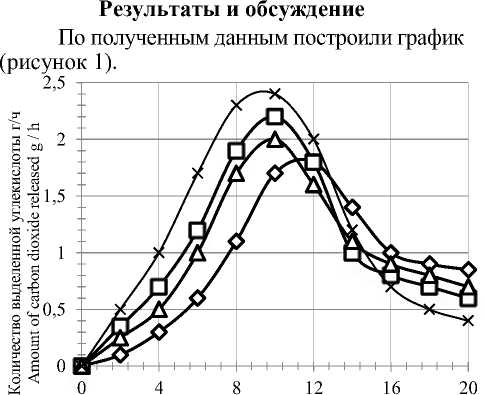
Продолжительность культивирования,ч
Duration of cultivation, h 1234
Рисунок 1. Влияние ферментных препаратов на бродильную активность спиртовых дрожжей: 1 – контроль; 2 – протеаза 0,2 ед. ПС/г крахмала; 3 – фитаза 0,5 ед. ФС/г крахмала; 4 – протеаза 0,2 ед. ПС/г крахмала, фитаза 0,5 ед. ФС/г крахмала
Figure 1. The effect of enzyme preparations on the fermentation activity of alcoholic yeast: 1 – control; 2 – protease 0,2 ed. PS/g starch; 3 – phytase 0.5 ed. FS/g starch; 4 – protease 0.2 unit’s PS/g starch, phytase 0.5 ed. FS/g starch
Из рисунка 1 видно, что максимальной бродильной активностью обладают дрожжи, культивируемые на сусле, полученном с использованием протеазы и фитазы. Кроме того, максимальная бродильная активность спиртовых дрожжей в контроле наблюдается к 12 ч роста, а в опытных образцах – к 10 ч роста. Прямая ассимиляция аминокислот обеспечивает не только интенсификацию синтеза белка, но и активирует содержащиеся в дрожжевой клетке ферменты, на что указывает высокая бродильная активность. Микроэлементы, такие как кальций, цинк, магний, получаемые при гидролизе фитина, также способствуют повышению бродильной активности дрожжей.
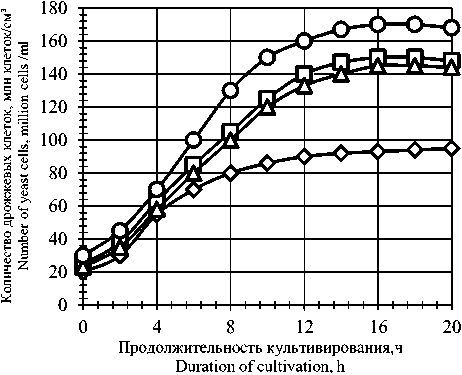
Рисунок 2. Влияние ферментных препаратов на динамику накопление биомассы дрожжей: 1 – контроль; 2 – протеаза 0,2 ед. ПС/г крахмала; 3 – фитаза 0,5 ед. ФС/г крахмала; 4 – протеаза 0,2 ед. ПС/г крахмала, фитаза 0,5 ед. ФС/г крахмала
Figure 2. Influence of enzyme preparations on dynamics of yeast biomass accumulation: 1 – control; 2 – protease 0,2 PS/g starch; 3 – phytase 0,5 PS/g starch; 4 – protease 0,2 PS/g starch, phytase 0,5 FS/g starch
Из рисунка 2 видно, что дрожжевой клетке присущи 4 фазы жизнедеятельности, которые характеризуются различным приростом дрожжевых клеток.
-
1. Лаг-фаза. Характеризуется очень сложным ферментативным процессом, чрезвычайно чувствительными к составу среды, ее температуре, активной кислотности. В этой фазе незначительно увеличивается объем дрожжевых клеток, синтезируются нуклеиновые кислоты, и аккумулируется энергия для дальнейшего активного накопления биомассы. Продолжительность лаг-фазы для дрожжей в опыте 1–2 ч, а в контроле 2–3 ч.
-
2. Логарифмическая фаза или фаза экспоненциального роста. Характеризуется высокой активностью размножения клеток. Количество почкующихся клеток быстро увеличивается, достигая 45–50%. Биомасса дрожжей при этом постепенно повышается вследствие образования новых дочерних клеток, которые, вырастая до материнской клетки, начинают почковаться, образуя новую генерацию. В этой фазе наблюдается максимальная скорость роста дрожжевых клеток. Продолжительность периода в опыте составляет 14–16 ч, в контроле 18–20 ч. Экспоненциальная фаза описывается уравнением Моно:
-
3. Стационарная фаза. Характеризуется постепенным замедлением темпа роста. Образование новых клеток практически прекращается, заканчивается их почкование, т. к. истощается питательная среда, образуются продукты метаболизма, которые тормозят рост и размножение клеток. Для поддержания жизнедеятельности клетки используют оставшиеся в культуральной среде питательные вещества. Клетки увеличиваются в размере, масса их также возрастает. Прирост биомассы в этой фазе может составить 5–10% от массы дрожжей, накопленных в логарифмической фазе. В этот период происходят внутриклеточные биосинтетические процессы, которые формируют зрелость дрожжевой клетки. Ферментные системы дрожжевой клетки перестраиваются с активного синтеза биомассы на процессы обмена, поддерживающие их жизнедеятельность. Воспроизводство новых замедляется. Наступает фаза спада.
-
4. Фаза затухания (отмирания). В среде в значительном количестве накапливаются продукты метаболизма. Фаза характеризуется
Ковалева Т.С. и др. Вестник ВГУИТ, 2019, Т. 81, №. 4, С. 98-102 отсутствием роста и размножения клеток. Масса клеток уменьшается, т. к. все питательные вещества культуральной среды использованы в предыдущей фазе. Идет постепенное отмирание клеток. Для поддержания жизнедеятельности клеток начинают использовать собственные запасы. Наблюдается автолиз клеток.
Мt = М0·еkt , где Мt – количество дрожжей за время t, кг; М0 – начальное, засевное количество дрожжей, кг; e – основание натурального логарифма; k – удельная скорость роста или коэффициент образования биомассы (зависит от расы дрожжей, концентрации питательной среды и ее состава, аэрации и других факторов); t – время размножения дрожжей.
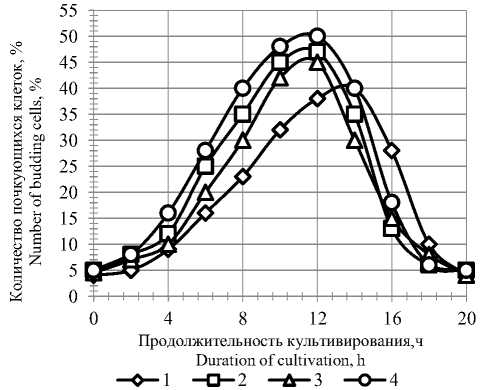
Рисунок 3. Влияние ферментных препаратов на динамику размножения дрожжей: 1 – контроль; 2 – протеаза 0,2 ед. ПС/г крахмала; 3 – фитаза 0,5 ед. ФС/г крахмала; 4 – протеаза 0,2 ед. ПС/г крахмала, фитаза 0,5 ед. ФС/г крахмала
Figure 3. The effect of enzyme preparations on the dynamics of yeast reproduction: 1 – control; 2 – protease 0.2 unit’s PS/g starch; 3 – phytase 0.5 units FS/g starch; 4 – protease 0.2 unit’s PS/g starch, phytase 0.5 units FS / g starch
Дрожжи в опыте по сравнению с дрожжами в контроле размножаются более интенсивно и к 14–16 ч роста накапливают в культуральной среде около 170 млн дрожжевых клеток, а дрожжи в контроле около 95 млн дрожжевых клеток к 18–20 ч роста. Таким образом, процесс культивирования дрожжей при использовании дополнительных ферментных препаратов можно ограничить 14–16 ч роста, и при этом дрожжевых клеток накапливается почти в 2 раза больше, чем в контроле. Все это позволяет уменьшит количество засевных дрожжей, вносимых в бродильный аппарат, что приводит к уменьшению потерь сбраживаемых углеводов на ( накопление биомассы дрожжей и увеличению выхода спирта.
Более высокий уровень почкования дрожжевых клеток (рисунок 3) в опыте достигался к 12 ч, а в контроле – к 14 ч, что соответствует примерно середине логарифмической фазы и составляет 50% в опыте и 40% – в контроле.
Быстро возникающее энергичное брожение угнетает процесс дыхания и вследствие этого приостанавливает почкование и размножение клеток, также происходит быстрое обеднение субстрата питательными веществами, что, в свою очередь, создает неблагоприятные условия для почкования. В конце культивирования дрожжевые клетки потребляли свои резервные вещества, такие как гликоген, и количество почкующихся клеток достигало 4–5%.
Весьма характерным показателем является скорость роста культуры дрожжей. Мы пользовались удельной скоростью роста, которую определяли по приросту количества клеток ( за определенный отрезок времени.
о S
У
И -а 2 8
В ° s 8
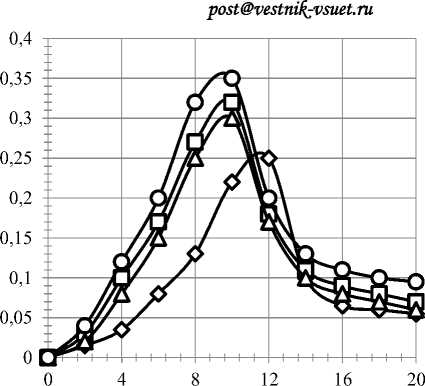
Продолжительность культивирования,ч Duration of cultivation, h
Рисунок 4. Влияние ферментных препаратов на скорость размножения дрожжей: 1 – контроль; 2 – протеаза 0,2 ед. ПС/г крахмала; 3 – фитаза 0,5 ед. ФС/г крахмала; 4 – протеаза 0,2 ед. ПС/г крахмала, фитаза 0,5 ед. ФС/г крахмала
Figure 4. Effect of enzyme preparations yeast reproduction rate: 1 – control; 2 – protease 0.2 ed. PS/g starch; 3 – phytase 0.5 ed. FS/g starch; 4 – protease 0.2 unit’s PS/g starch, phytase 0.5 ed. FS/g starch
Удельная скорость роста была максимальна в логарифмической фазе (рисунок 4), когда брожение протекает слабо и составила 0,35 млн клеток/см3·ч в опытных образцах и 0,25 млн клеток/см3·ч – в контроле.
Заключение
Исследовано влияние различных источников дополнительного питания и ферментных препаратов протеазы и фитазы на процесс культивирования дрожжей в спиртовом производстве.
Установлено, что максимальное накопление дрожжевых клеток наблюдается при внесении в сусло ферментного препарата нейтральной протеазы Пролайв BS Ликвид дозировкой 0,2 ед. ПС/г крахмала и ферментного препарата фитазы Кингфос дозировкой 0,5 ед. ФС/г крахмала, содержание дрожжевых клеток в зрелых дрожжах достигает 170 млн клеток/см3 к 16–18 ч культивирования, дрожжи имеют высокую бродильную активность.
Список литературы Влияние протеазы и фитазы на физиологическое состояние спиртовых дрожжей при культивировании
- Яковлев А.Н., Агафонов Г.В., Яковлева С.Ф., Алексеева Н.И. и др. Влияние мультиэнзимной композиции на процесс брожения ржаного сусла // Производство спирта и ликероводочных изделий. 2013. № 3. С 26-28.
- Яковлева С.Ф., Яковлев А.Н., Корнеева О.С. Получение этилового спирта из ржи с использованием мультиэнзимной композиции // Биотехнология. 2011. № 6. С. 63-69.
- Mikulski D., K?osowski G., Rolbiecka A. Influence of phytase and supportive enzymes applied during high gravity mash preparation on the improvement of technological indicators of the alcoholic fermentation process // Biomass and Bioenergy. 2015. V. 80. P. 191-202.
- Son C.K. Impacts of liquefaction time and enzymes on ethanol yield of very high gravity processfor beverage ethanol production // Vietnam Journal of Science and Technology. 2016. V. 54. № 4А. P. 242.
- Фараджева Е.Д., Федоров В.А., Агафонов Г.В. Общая технология бродильных производств. Воронеж: ИПЦ "Научная книга". 2012. 728 с.
- Polyakov V.A., Serba E.M., Overchenko M.B., Ignatova N.I. et al. The effect of a complex phytase-containing enzyme preparation on the process of rye wort fermentation // Food and Raw Materials. 2019. V. 7. P. № 2. P. 221-228.
- Fang L., Wang T., Lamsal B. Use of surfactant and enzymes in dry-grind corn ethanol fermentation improves yield of ethanol and distillers corn oil // Industrial crops and products. 2018. № 111. P. 329-335.
- Yuan Z., Li G., Hegg, E.L. Enhancement of sugar recovery and ethanol production from wheat straw through alkaline pre-extraction followed by steam pretreatment // Bioresource technology. 2018. № 266. P. 194-202.
- Xu Y., Zhang M., Roozeboom K., Wang, D. Integrated bioethanol production to boost low-concentrated cellulosic ethanol without sacrificing ethanol yield // Bioresource technology. 2018. № 250. P. 299-305.
- Franco J.H., Minteer S.D., de Andrade A.R. Product analysis of operating an ethanol/O2 biofuel cell shows the synergy between enzymes within an enzymatic cascade // Journal of The Electrochemical Society. 2018. V. 165. № 9. P. H575-H579.
- ?ukajtis R., Kucharska K., Ho?owacz I., Rybarczyk P. et al. Comparison and optimization of saccharification conditions of alkaline pre-treated triticale straw for acid and enzymatic hydrolysis followed by ethanol fermentation // Energies. 2018. V. 11. № 3. P. 639.


