Влияние различных видов ионизирующего излучения* и длительности культивирования на уровень генетической изменчивости сомаклонов сои
Автор: Фисенко П.П., Бабикова А.В., Ефремова О.С.
Статья в выпуске: 1 (142-143), 2010 года.
Бесплатный доступ
Методом маркирования межмикросателлитных последовательностей изучено генетическое разнооб-разие и взаимоотношения между растениями сорта Ходсон, мутантных популяций, полученных после обра-ботки семян различными видами излучения (Ходсон-L и Ходсон-γ) и их сомаклонами. Использование 12 праймеров позволило проследить вариабельность 183 ISSR-фрагментов, из них 89,61 % были полиморфными. Мутантные популяции Ходсон-L и Ходсон-γ характеризуются повышенным генетическим разнообразием по сравнению с популяциями сорта Ходсон. У сомаклонов, полученных из семядольных узлов растений мутант-ных популяций, уровень генетической изменчивости снижается и приближается к уровню изменчивости сорта Ходсон. Однако среди этих сомаклонов отмечены регенерантные линии, характеризующиеся более высоким содержанием белка, гистидина, линолевой и олеиновой кислот, а также в меньшей степени поражающиеся церкоспорозом и септориозом, чем растения их исходных форм. Длительность культивирования первичных эксплантов на питательной среде не влияет на уровень генетической изменчивости сомаклонов.
Соя, сомаклоны, уровень генетической изменчивости, виды ионизирующего излучения
Короткий адрес: https://sciup.org/142150939
IDR: 142150939
Текст научной статьи Влияние различных видов ионизирующего излучения* и длительности культивирования на уровень генетической изменчивости сомаклонов сои
Введение. Новая возможность расширения генетического разнообразия в селекции открылась с организацией биотехнологических методов исследований. Полученные на искусственных питательных средах в условиях in vitro растения-регенеранты, как правило, в той или иной степени отличаются от исходных форм и могут являться исходным материалом для традиционной селекции данной культуры, поскольку они представляют собой сомаклональные варианты [1].
Использование сомаклональной изменчивости в сочетании с отбором позволило О.А. Рожан-ской создать ценный селекционный материал сои, ярового рапса, нута, эспарцета, люцерны с признаками скороспелости, повышенной семенной и кормовой продуктивности, улучшенного химического состава, устойчивости к неблагоприятным гидротермическим условиям и патогенам [2].
В Казахстане группой ученых (С.В. Дидоренко, Ю.Г. Карягиным и Б.М. Жанысбаевым) сомакло-нальная изменчивость применяется как источник генетического разнообразия в создании новых форм сои [3].
В Приморском НИИСХ коллективом двух лабораторий: биотехнологии и селекции сои – с использованием метода культуры тканей создан первый в России сорт сои Приморская 81, который с 2004 г. районирован [4].
Важным моментом в технологии регенерации путем органогенеза являются условия, способствующие возникновению генетических изменений в рекомбинантах. По данным M.S. Wright и др. [5], дополнительные почки в пазухах семядольного узла сои закладываются de novo под влиянием 6-бензиламинопурина (БАП). R.A. Graybosch, M.E. Edge и X. Delannay [6] стимулировали побегообразование из вновь образовавшихся и ранее существовавших меристематических участков проводящей ткани семядольного узла на среде с БАП. Среди полученных линий исследователи наблюдали вариабильность по урожайности и другим признакам. A.H. Freytag с коллегами [7] изучали процесс регенерации растений сои из семядольного узла эксплантов эпикотиля. Авторы выявили генотипы, в потомстве регенерантов у которых отклонения от нормы появлялись чаще.
По мнению Рожанской [8], изоляция семядольных узлов на стадии развития проростка нарушает контролирующее влияние организма, приводит к неорганизованной пролиферации ткани и способствует возникновению генетических изменений у адвентивных почек, формирующихся в семядольных пазухах изолированных узлов.
Величины вариабельности признаков у регенерантов сои недостаточно высокие, поэтому с целью повышения генетического разнообразия мы использовали в качестве исходных эксплантов ткани мутантов. Существует много приёмов получения индуцированных мутаций. В основе их лежит воздействие на организм различными физическими и химическими факторами, называемыми мутагенами.
Действуя ими на растения, можно резко повысить их мутационную изменчивость. В селекционной работе используются любые виды ионизирующих излучений. Наиболее широко применяют рентгеновское, гамма- и нейтронное излучения. [9].
Наряду с этим существует вопрос о влиянии длительности культивирования на уровень генетической изменчивости сомаклонов сои. Как считают некоторые исследователи, уровень изменчивости со-маклонов повышается при более продолжительном культивировании ткани. Рядом авторов [10, 11] определено, что чем длительнее эксплант находится на питательной среде, тем больше вероятность получить регенеранты, отличающиеся от исходных форм.
Однако по данным M.S. Wright и др. [5], проводивших гистологический анализ пазух семядольного узла у исследуемых ими растений сои, через 6 дней после прорастания семян на среде с БАП базальные участки эпикотиля и семядолей, примыкающие к придаточным почкам, становятся меристематическими зонами. В эпидермальных и субэпидермальных тканях формируются проре-генеративные очаги, способные к морфогенезу, возникают новообразования – дополнительные адвентивные почки.
На основании вышеизложенных результатов и мнений ученых, нами была поставлена задача выяснить, оказывают ли влияние различные виды ионизирующего излучения и длительность культивирования на уровень генетической изменчивости сомаклонов сои.
Материалы и методы. Исследования проводились в лаборатории биотехнологии Приморского НИИСХ, в качестве исходных форм использовали сорт Ходсон и его мутанты. Для получения мутантов сухие семена обрабатывали в Институте цитологии и генетики СО РАН следующими электромагнитными излучениями: красным когерентным светом оптического квантового гелий-неонового генератора (лазера) с длиной волны 632,8 нм при плотности потока мощностью 0,08 мВт/см2 в течение 15 мин; γ-излучением кобальтовой пушки в дозе 50 грей.
В качестве первичных эксплантов использовали семядольные узлы стерильных микрорастений. Для получения последних зрелые семена стерилизовали в разделительной воронке концентрированной серной кислотой (H 2 SO 4 ) в течение 2-х мин, с последующей многократной отмывкой стерильной дистиллированной водой согласно методике, предложенной А.М. Смирновым, в изложении В.А. Тильбы [12].
Семядольные узлы культивировали на питательной среде 1/2MS + БАП (1,13 и 0,23 мг/л) до 60 дней. Адвентивные побеги, образовавшиеся de novo через 7-14 дней (R 0 -1) и через 31-60 дней (R 0 -2), снимали и помещали на среду 1/2MS+ИМК (0,5 мг/л), не содержащую БАП, для дальнейшего роста и развития.
Степень поражения (%) грибными патогенами: септориозом (Septoria glycines), церкоспорозом (Сercospora sojina), пероноспорозом (Peronospora manshurica) – определяли при искусственном заражении листовой поверхности на жестком инфекционном фоне совместно с сотрудниками лаборатории селекции сои ПримНИИСХ по методике ВИР [13] и согласно Международному классификатору [14].
Биохимический состав семян исходных форм и регенерантных линий проведен во ВНИИ сои на ИК-сканере Nir-42 по следующим показателям: аминокислоты (аргинин, валин, пролин, глютамин, лизин, гистидин, фенилаланин, тирозин, лейцин, изолейцин, аланин+глицин, треанин, серин, аспарагиновая кислота), жирные кислоты (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая), минеральные элементы (К, Са, Р, Мg), белок, масло. Оценка сомаклонов по химическому составу дана на основании классификатора [14].
Регенеранты третьего поколения выращивали в полевых условиях в соответствии с принятой для Приморского края агротехникой.
Статистическая обработка материала проведена методом дисперсионного анализа в изложении Б.А. Доспехова [15].
Для проведения генетического анализа все исследуемые образцы были разделены на три группы, каждая из которых была представлена растениями исходной формы и ее сомаклонами. Первая группа – сорт Ходсон и сомаклоны R 0 -1-690, R 0 -1-691, R 0 -1-699, R 0 -1-717, R 0 -1-722 и R 0 -2617. Вторая группа – популяция Ходсон- L , растения которой получены из облученных лазером семян, и сомаклоны R0-1-731, R0-2-616 и R0-2-623. Третья группа – популяция Ходсон-γ, растения которой получены из облученных γ-излучением семян, и сомаклоны R 0 -1-651, R 0 -1-688, R 0 -1-715 и R 0 -2-615.
Выделение ДНК и полимеразную цепную реакцию (ПЦР) проводили в БПИ ДВО РАН, как было описано нами ранее [16]. Для анализа полиморфизма межмикросателлитных последовательностей ДНК 52 образцов использовали 12 праймеров, комплементарных к микросателлитным повторам (табл. 1). При оценке электрофореграмм учитывали только четко видимые и воспроизводимые в повторных экспериментах фрагменты (ампликоны). Для каждого из праймеров были составлены бинарные матрицы, в которых присутствие или отсутствие в спектре фрагментов с одинаковыми молекулярными массами обозначали как "1" или "0". Разная интенсивность полос одинаковых по размеру ампликонов у сравниваемых образцов не учитывалась. Для определения длины фрагментов использовали маркер молекулярных масс – EcoRI + HindIII-рестрикты ДНК фага лямбда (Fermentas, Литва).
Таблица 1 – Праймеры, используемые в данной работе
|
Код праймера |
Нуклеотидная последовательность (5’–3’) |
Код праймера |
Нуклеотидная последовательность (5’–3’) |
|
пр812 |
(GA) 8 T |
прC1 |
(AGC) 6 T |
|
пр825 |
(AC) 8 T |
прC3 |
(AGC) 6 C |
|
пр840 |
(GA) 8 (CT) T |
прC4 |
(AGC)6G |
|
пр842 |
(GA) 8 (CT)G |
прC5 |
(TCG) 6 G |
|
пр888 |
(CGT) (ACT) (CGT) (CA) 7 |
прS1 |
(CA) 8 TG |
|
пр889 |
(AGT) (CGT) (AGT) (AC) 7 |
прS10 |
(GA) 8 TC |
Объединенная бинарная матрица была использована для расчета частот фрагментов, доли полиморфных локусов ( P ), генного разнообразия ( H ) и индекса Шеннона ( SI ) с помощью пакета программ POPGENE [17]. Для определения генетических расстояний Нея-Ли (D N ) и построения дендрограммы генетических взаимоотношений между отдельными растениями на основе значений D N посредством невзвешенного парно-группового метода кластерного анализа (UPGMA) с бутст-рэпными оценками степени надежности порядка ветвления (1000 реплик) использовали пакет программ TREECON [18, 19].
Результаты и обсуждения . В результате ISSR-анализа выявлено 183 фрагмента, из них 164 были полиморфными. Популяция Ходсон-γ характеризовалась наибольшим уровнем полиморфизма и значениями генного разнообразия и индекса Шеннона, чем все другие исследуемые популяции исходных форм (табл. 2).
Таблица 2 – Основные показатели генетической изменчивости исходных форм сои
|
Сорт/популяция |
Доля полиморфных локусов ( P, %) |
Генное разнообразие ( H ) |
Индекс Шеннона ( SI ) |
|
Ходсон |
12,57 |
0,041 |
0,062 |
|
Ходсон- L |
10,93 |
0,040 |
0,062 |
|
Ходсон-γ |
18,03 |
0,063 |
0,099 |
Генетические дистанции (DN) между парами анализируемых образцов (популяций) варьировали, достигая 10-кратного различия (табл. 3). Наименьшее значение D N (0,0642) отмечено между исходными популяциями Ходсон-γ и Ходсон- L , наибольшее (0,6043) – между сомаклоном R0-2616 популяции Ходсон- L и сомаклоном R0-1-691 сорта Ходсон.
Таблица 3 – Матрица значений генетических различий (D N ) между исследуемыми образцами сои, рассчитанных по 183 ISSR-фрагментам
|
Образец (популяция) |
Ходсон (n=10) |
R 0 -1690 (Ходсон) |
R 0 -1691 (Ходсон) |
R 0 -1699 (Ходсон) |
R 0 -1717 (Ходсон) |
R 0 -1722 (Ходсон) |
R 0 -2617 (Ходсон) |
Ходсон L (n=13) |
R 0 -1731 (Ход-сон-L) |
R 0 -2616 (Ход-сон-L) |
R 0 -2623 (Ход-сон-L) |
Ходсон γ (n=16) |
R 0 -1651 (Ход-сон-γ) |
R 0 -1688 (Ход-сон-γ) |
R 0 -1715 (Ход-сон-γ) |
R 0 -2615 (Ход-сон-γ) |
|
Ходсон (n=10) |
***** |
|||||||||||||||
|
R 0 -1-690 (Ходсон) |
0,179 |
***** |
||||||||||||||
|
R 0 -1-691 (Ходсон) |
0,545 |
0,447 |
***** |
|||||||||||||
|
R 0 -1-699 (Ходсон) |
0,337 |
0,261 |
0,381 |
***** |
||||||||||||
|
R 0 -1-717 (Ходсон) |
0,211 |
0,141 |
0,465 |
0,206 |
***** |
|||||||||||
|
R 0 -1-722 (Ходсон) |
0,165 |
0,092 |
0,414 |
0,247 |
0,116 |
***** |
||||||||||
|
R 0 -2-617 (Ходсон) |
0,199 |
0,141 |
0,518 |
0,319 |
0,166 |
0,153 |
***** |
|||||||||
|
Ходсон L (n=13) |
0,531 |
0,469 |
0,569 |
0,319 |
0,443 |
0,477 |
0,564 |
***** |
||||||||
|
R 0 -1-731 (Ходсон-L) |
0,210 |
0,172 |
0,509 |
0,254 |
0,134 |
0,160 |
0,186 |
0,439 |
***** |
|||||||
|
R 0 -2-616 (Ходсон-L) |
0,264 |
0,212 |
0,604 |
0,312 |
0,172 |
0,212 |
0,186 |
0,534 |
0,141 |
***** |
||||||
|
R 0 -2-623 (Ходсон-L) |
0,225 |
0,206 |
0,594 |
0,365 |
0,219 |
0,192 |
0,179 |
0,524 |
0,172 |
0,086 |
***** |
|||||
|
Ходсон γ (n=16) |
0,548 |
0,524 |
0,594 |
0,332 |
0,455 |
0,508 |
0,590 |
0,064 |
0,455 |
0,560 |
0,557 |
***** |
||||
|
R 0 -1-651 (Ходсон-γ) |
0,272 |
0,172 |
0,358 |
0,199 |
0,147 |
0,147 |
0,226 |
0,365 |
0,166 |
0,247 |
0,268 |
0,374 |
***** |
|||
|
R 0 -1-688 (Ходсон-γ) |
0,217 |
0,128 |
0,334 |
0,179 |
0,116 |
0,104 |
0,206 |
0,446 |
0,160 |
0,240 |
0,275 |
0,459 |
0,110 |
***** |
||
|
R 0 -1-715 (Ходсон-γ) |
0,295 |
0,186 |
0,456 |
0,268 |
0,147 |
0,1725 |
0,240 |
0,339 |
0,166 |
0,219 |
0,254 |
0,368 |
0,141 |
0,160 |
***** |
|
|
R 0 -2-615 (Ходсон-γ) |
0,257 |
0,172 |
0,509 |
0,297 |
0,199 |
0,199 |
0,212 |
0,536 |
0,166 |
0,166 |
0,226 |
0,565 |
0,261 |
0,212 |
0,247 |
***** |
Наибольшими генетическими отличиями от исходной формы характеризуются сомаклоны R 0 -1-691 и R 0 -1-699 в первой группе, R 0 -2-616 и R 0 -2-623 – во второй и R 0 -2-615 – в третьей (табл. 4). Однако уровень генетической изменчивости исследованных сомаклонов не зависит от длительности культивирования первичных эксплантов на питательной среде.
Таблица 4 – Значения генетических дистанций между сомаклонами и выборками их исходных форм и длительность культивирования сомаклонов in vitro
|
Сомаклон |
Длительность культивирования in vitro, сут. |
Генетические дистанции ( D N) |
||
|
Ходсон |
Ходсон- L |
Ходсон-γ |
||
|
R 0 -1-690 (Ходсон) |
7-14 |
0,1789 |
0,4695 |
0,5235 |
|
R 0 -1-691 (Ходсон) |
7-14 |
0,5451 |
0,5694 |
0,5937 |
|
R 0 -1-699 (Ходсон) |
7-14 |
0,3369 |
0,3188 |
0,3324 |
|
R 0 -1-717 (Ходсон) |
7-14 |
0,2108 |
0,4433 |
0,4547 |
|
R 0 -1-722 (Ходсон) |
7-14 |
0,1646 |
0,4772 |
0,5084 |
|
R 0 -2-617 (Ходсон) |
32 |
0,1993 |
0,5645 |
0,5904 |
|
R 0 -1-731 (Ходсон- L ) |
7-14 |
0,2098 |
0,4393 |
0,4550 |
|
R 0 -2-616 (Ходсон- L ) |
48 |
0,2643 |
0,5340 |
0,5596 |
|
R 0 -2-623 (Ходсон- L ) |
57 |
0,2249 |
0,5245 |
0,5571 |
|
R 0 -1-651 (Ходсон-γ) |
7-14 |
0,2722 |
0,3650 |
0,3735 |
|
R 0 -1-688 (Ходсон-γ) |
7-14 |
0,2173 |
0,4456 |
0,4589 |
|
R 0 -1-715 (Ходсон-γ) |
7-14 |
0,2952 |
0,3392 |
0,3678 |
|
R 0 -2-615 (Ходсон-γ) |
31 |
0,2566 |
0,5355 |
0,5646 |
Длительность культивирования семядольных узлов сорта Ходсон не влияет на генетическую изменчивость его сомаклонов. В то время, как для возникновения генетической дифференциации сомаклонов популяций Ходсон- L и Ходсон-γ от их исходных форм, вероятно, необходимо более длительное культивирование (см. табл. 4).
К третьему поколению из числа изучаемых нами сомаклонов были исключены стерильные, слабофертильные формы с нежизнеспособными семенами, а также непродуктивные и характеризующиеся другими отрицательными признаками (R 0 -1-691, R 0 -1-699, R 0 -1-690, R 0 -2-617, R 0 -1-651 и R 0 -1-688). Среди оставшихся сомаклонов по биохимическим показателям (содержание белка, гистидина, линолевой и олеиновой кислот) исходную форму превышали: сомаклон R617 первой группы ( D N 0,1993), все сома-клональные линии второй группы и регенерант R615 третьей группы ( D N 0,5646) (табл. 5).
Кроме того, сомаклон R623 второй группы ( D N 0,5245) обладал высоким уровнем устойчивости к церкоспорозу, а регенерант R715 третьей группы ( D N 0,3678) характеризовался высоким уровнем устойчивости к пероноспорозу и церкоспорозу.
Таблица 5 – Сомаклональные линии сои третьего поколения, имеющие преимущество перед исходными формами по некоторым признакам
|
Исходная форма (и.ф.), выделившаяся сомаклональ-ная линия (R) |
Продук-тив-ность, г/раст. |
Содержание в семенах масла, % |
Содержание кислоты, % от общего количества масла в семенах |
Содержание белка в семенах, % |
Содержание гистидина, от общего количества аминокислот, % |
Степень поражения патогенами листовой поверхности, % |
||||
|
лино левая |
линоленовая |
олеи новая |
септо-риоз |
церко-спо-роз |
перо-но-спороз |
|||||
|
Ходсон (и.ф.) |
7,6 |
20,2 |
51,5 |
4,9 |
6,5 |
38,5 |
8,3 |
62,5 |
68,8 |
82,5 |
|
R 617 |
9,5* |
20,5 |
52,6* |
3,7 |
10,4* |
38,4 |
10,2* |
43,8 |
52,5 |
57,5 |
|
Ходсон-L (и.ф.) |
7,5 |
21,2 |
51,9 |
4,8 |
4,5 |
37,4 |
10,7 |
50,0 |
57,5 |
70,0 |
|
R 616 |
6,3 |
21,6 |
52,3 |
5,0 |
4,8 |
39,3* |
11,9* |
41,3 |
29,8* |
56,3 |
|
R 623 |
6,1 |
20,0 |
52,4 |
4,4 |
8,6 |
39,2* |
10,3 |
35,0* |
24,8* |
57,5 |
|
R 731 |
8,2 |
21,5 |
51,9 |
5,4 |
4,3 |
37,6 |
11,9* |
41,3 |
37,5 |
71,3 |
|
Ходсон-γ (и.ф.) |
7,7 |
20,5 |
52,2 |
5,5 |
9,0 |
37,7 |
10,3 |
41,3 |
52,5 |
58,8 |
|
R615 |
6,6 |
20,0 |
52,7 |
3,4* |
10,7* |
38,1* |
9,6 |
40,0 |
47,5 |
58,8 |
|
R 715 |
6,9 |
20,3 |
51,7 |
4,7 |
6,5 |
38,1* |
10,9 |
42,5 |
33,8* |
50,0* |
Примечание: * – достоверно превосходит исходную форму на 5% -ном уровне
Следует отметить, что регенерантные формы, имеющие наибольшие генетические отличия от исходных форм, не всегда выделяются по биохимическим показателям, тогда как сомаклоны со средним (R715) и низким (R617) уровнем генетической изменчивости могут превышать исходную форму по селекционным признакам. В результате исследований в третьем поколении были выделены сомаклоны: R616, R623 и R617, которые рекомендованы селекционерам в качестве исходного материала для селекции сои в Приморском крае.
На рисунке представлена некорневая дендрограмма генетических взаимоотношений между исследуемыми образцами. Анализируемые растения распределились в два кластера: первый объединяет с высокой степенью достоверности (индекс бутстрепа 100 %) все растения популяций Ход-сон- L и Ходсон-γ, которые группируются соответственно их происхождению; второй объединяет все растения исходного сорта Ходсон (индекс бутстрепа 100 %) и все исследуемые сомаклоны, за исключением двух (R0-1-691 и R0-1-699). Эти два сомаклона сорта Ходсон имеют наибольшие генетические отличия как от исходной формы, так и от всех других.
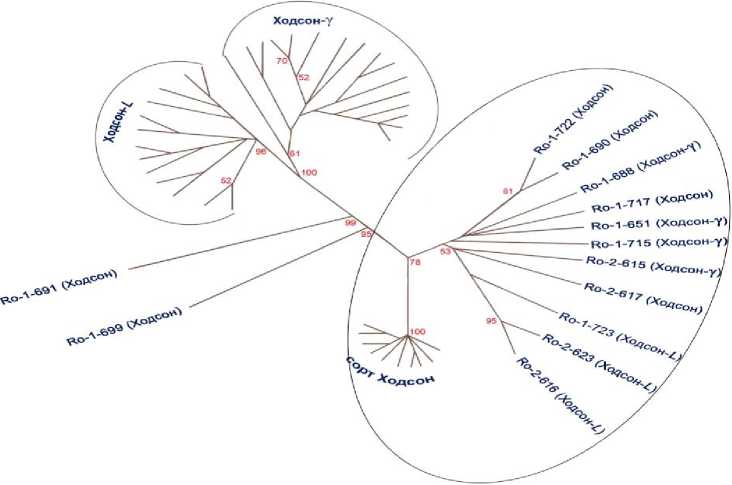
Рисунок – Некорневая дендрограмма генетических взаимоотношений между растениями сорта Ходсон, популяций Ходсон-γ и Ходсон- L и их сомаклонами.
Выводы. В результате проведенных исследований выявлено, что растения, выращенные из ткани обработанных различными видами облучения семян сорта Ходсон, генетически значительно отличаются от растений, выращенных из необработанных семян. Среди сомаклонов популяций Ходсон-γ и Ходсон- L выделены регенеранты, характеризующиеся повышенным содержанием белка, гистидина, линолевой и олеиновой кислот, а также более высокой устойчивостью к церкоспорозу и септориозу по сравнению с их исходными формами. Уровень генетической изменчивости сомаклонов не зависит от длительности культивирования первичных эксплантов на питательной среде.
Работа выполнена при финансовой поддержке гранта ДВО РАН №05-II-CХ-06-002C "Методы биотехнологии в селекции сои и риса".


