Влияние тритона Х-100 на выделение и свойства холинэстеразы из ганглиев кальмаров
Автор: Ковалев Н.Н., Михеев Е.В., Позднякова Ю.М.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология переработки
Статья в выпуске: 10, 2014 года.
Бесплатный доступ
Исследовано влияние детергента тритона Х-100 на экстрактивность холинэстеразы из мороженых и сублимированных ганглиев кальмаров. Определена молекулярная масса препарата фермента холинэстеразы.
Тритон х-100, холинэстераза, субстратная специфичность
Короткий адрес: https://sciup.org/14083369
IDR: 14083369 | УДК: 664.951.014:577.15
Текст научной статьи Влияние тритона Х-100 на выделение и свойства холинэстеразы из ганглиев кальмаров
Введение. Экстракция мембраносвязанных белков с помощью детергентов – один из широко распространенных приемов в практической биохимии и биотехнологии. В состав детергентов входят липофильные цепи, которые, взаимодействуя с гидрофобными поверхностями молекулы белка, вытесняют его из комплекса с мембраной. Одним из наиболее широко применяемых детергентов являются тритоны (в частности, тритон Х-100). Тритоны в большинстве своем неионные детергенты на основе полиэтиленгликоля. Детергенты способны вытеснять белок, прочно связанный с мембраной гидрофобными взаимодействиями, благодаря тому, что они, во-первых, растворяют мембрану и, во-вторых, замещают компоненты мембраны алифатическими или ароматическими цепями, которые составляют липофильную часть детергента [1].
В литературе есть данные об использовании тритона Х-100 для выделения холинэстеразы (ХЭ) из различных источников [2, 3]. Так, было показано, что обработка осадка голов мух после водной экстракции тритоном Х-100 в концентрациях 0,1 и 1,0 % приводила к переходу в раствор дополнительно от 6 до 10 % общей активности ХЭ [3]. Было установлено, что в концентрации 1 % тритон Х-100 повышает значения V m для гидролиза АТХ [4]. Также тритон Х-100 в концентрации 1% применялся для солюбилизации ХЭ различного происхождения [5–8].
Цель работы . Исследование влияния детергента тритона Х-100 на экстрактивность холинэстеразы из ганглиев кальмаров, а также влияния тритона Х-100 на свойства препарата фермента ХЭ (активность, чувствительность к фосфорорганическим ингибиторам и субстратную специфичность), полученного с его использованием.
Материалы и методы. В качестве источников фермента использовали сублимированные и мороженые ганглии тихоокеанского кальмара Todarodes pacificus и кальмара Бартрама Ommastrephes bartramii .
В качестве субстратов холинэстераз использовали тиохолиновые эфиры карбоновых кислот – ацетил-, пропионил- и бутирилтиохолин иодиды (ICN, США).
Скорость холинэстеразного гидролиза определяли методом Эллмана [9]. Кинетические параметры ферментативного гидролиза (V m и K M ) – графически по методу Лайнуивера-Берка [10].
В качестве ингибиторов использовали: диизопропилфторфосфат (ДФФ) – [(CH 3 ) 2 CHO] 2 P(O)F; О-этил-S-(β-этилмеркаптоэтил) метилтиофосфанат (ГД-42) – С 2 H 5 O(CH 3 )P(O)SC 2 H 4 S+(CH 3 )C 2 H 5 . Исследованные фосфорорганические соединения (ФОС) синтезированы в Институте элементорганических соединений им. А.Н. Несмеянова РАН [11]. Бимолекулярную константу скорости взаимодействия ХЭ с ФОС рассчитывали по уравнению [12].
Ультрафильтрацию проводили на колонках с мембранами волоконного типа, с пределом пропускания пор 100 кДа (GE Healthcare, США).
Электрофорез ферментных препаратов проводили в 10 %-м (С = 3,2) полиакриламидном геле (ПААГ) [13]. Для выявления ХЭ-активности в гелях использовали тиохолиновый метод [14].
Результаты и обсуждение . Исследования по выделению фермента из различных источников показали, что большинство ХЭ не переходит в раствор без разрушения ткани детергентами или солюбилизирующими агентами.
В связи с этим проведено исследование влияния детергента тритона Х-100 в концентрации 1-3 % от массы сырья на экстрактивность ХЭ из мороженых и сублимированных ганглиев различных видов кальмаров.
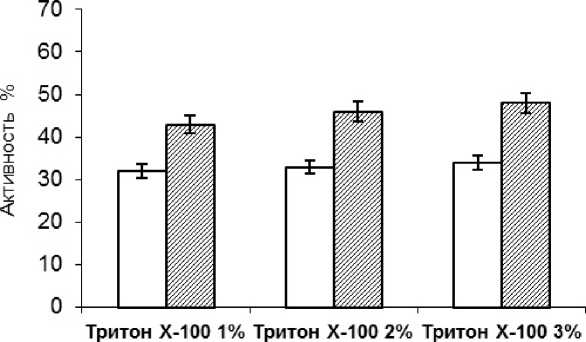
Установлено, что обработка 3 %-м тритоном Х-100 мороженых ганглиев тихоокеанского кальмара приводила к переходу в раствор 34 % общей активности в гомогенате ткани, при этом экстракция водой приводила к переходу в раствор 27 % общей активности в гомогенате (рис. 1).
□ Кальмар тихоокеанский
□ Кальмар Бартрама
Рис. 1. Влияние различных концентраций тритона Х-100 на экстрактивность ХЭ из мороженых ганглиев кальмаров (за 100 % принята активность в гомогенате) (р < 0,05)
В случае кальмара Бартрама экстракция 3 %-м тритоном приводила к переходу в раствор 48 % активности (при использовании тритона в концентрации 1 и 2 % в раствор переходило соответственно 43 и 46 % активности), при этом экстракция водой приводила к переходу в раствор 32 % общей активности фермента.
Таким образом, концентрации тритона Х-100 в интервале 1-3 % для различных видов кальмаров приводили к переходу в раствор от 32 до 48 % активности. По сравнению с водной экстракцией наибольший прирост экстрактивности ХЭ из мороженых ганглиев (16 %) характерен для кальмара Бартрама, наименьший (7 %) - для тихоокеанского кальмара.
В опытах на сублимированных ганглиях тихоокеанского кальмара показано, что тритон Х-100 в концентрациях 0,5 и 1,0 % способствует переходу в раствор 57-60 % активности ХЭ. Увеличение выхода фермента в раствор следует признать незначительным, поскольку при экстракции водой в раствор переходит 50 % активности ХЭ, содержащейся в сырье (рис. 2).
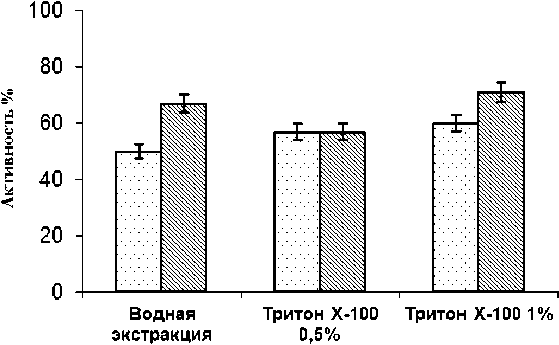
□ Сублимированные ганглии
□ Сублимированные ганглии обработанные смесью органических растворителей
Рис. 2. Влияние различных концентраций тритона Х-100 на экстрактивность ХЭ из сублимированных ганглиев тихоокеанского кальмара (за 100 % принята активность в гомогенате) (р < 0,05)
Ранее, на примере сублимированных ганглиев тихоокенскаго кальмара, было показано, что обработка сырья смесью органических растворителей приводит к повышению выхода фермента в раствор при водной экстракции на 17 % [14]. Представляло интерес исследование влияния на экстрактивность ХЭ различных концентраций тритона Х-100 (из обработанных смесью органических растворителей ганглиев кальмаров).
Солюбилизация ХЭ из сублимированных, обработанных органическими растворителями ганглиев кальмара 0,5 %-м тритоном Х-100, как и в случае сублимированных необработанных ганглиев, не приводила к значительному увеличению степени солюбилизации фермента. Обработка сублимированных ганглиев органическими растворителями и последующая экстракция 1 %-м тритоном Х-100 приводит к повышению на 20 % активности фермента в экстракте по сравнению с водной экстракцией из сублимированных ганглиев (рис. 3).
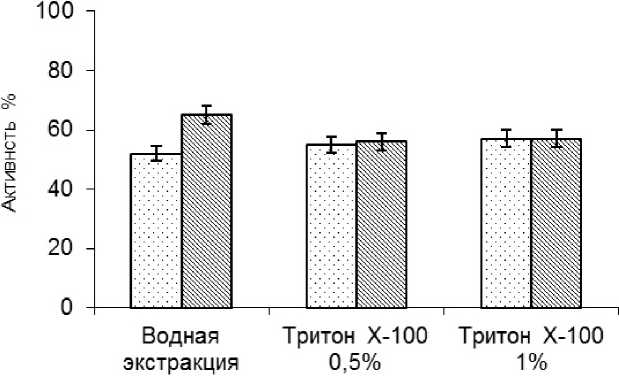
□ Сублимированные ганглии
□ Сублимированные ганглии обработанные смесью органических растворителей
Рис. 3. Влияние тритона Х-100 на экстрактивность ХЭ из сублимированных ганглиев кальмара Бартрама. Гидромодуль 3 : 1, время экстракции 15 ч, t – 20±2 0С, рН – 6,8 (за 100 % принята активность в гомогенате) (р ≤ 0,05)
Обработка 1 %-м раствором тритона сублимированных ганглиев кальмара Бартрама (рис. 4) приводила к переходу в раствор 57 % активности как сублимированных ганглиев необработанных, так и сублимированных, обработанных смесью органических растворителей. При этом водная экстракция необработанных ганглиев без добавления детергента приводила к переходу в раствор 52 % активности, а водная экстракция сублимированных обработанных ганглиев кальмара Бартрама - 65 % общей активности.
Исследования зависимости экстракции ХЭ тритоном Х-100 из сублимированного сырья показали, что экстракция 0,5 %-м детергентом не оказывала существенного влияния на экстрактивность ХЭ из сублимированных ганглиев (как обработанных, так и необработанных) исследованных видов кальмаров. Использование тритона в 1,0 %-й концентрации при экстракции ХЭ из сублимированных, обработанных смесью органических растворителей ганглиев тихоокеанского кальмара позволило перевести в раствор 71 % общей активности в сырье (солюбилизация ХЭ смесью органических растворителей приводила к переходу в экстракт 67 % активности фермента). В то же время увеличение концентрации детергента не приводило к улучшению экстрактивности фермента из ганглиев кальмара Бартрама различных способов обработки. Исследования по влиянию тритона Х-100 на экстрактивность ХЭ из мороженых ганглиев кальмаров показали, что в раствор переходит не более 48 % общей ферментативной активности (в случае кальмара Бартрама).
Основываясь на описанных выше параметрах процессов, был получен препарат фермента холинэстеразы из сублимированных ганглиев тихоокеанского кальмара путем обработки смесью органических растворителей (бутанол : гексан 1,5 : 1,0) с последующей обработкой тритоном Х-100 (1 % массы сырья) и дальнейшей очисткой ультрафильтрацией.
Экстракцию ХЭ из сырья, обработанного смесью органических растворителей, после добавления тритона Х-100 проводили при 18±2 оС при соотношении сырье : вода - 3 : 1.
По окончании процесса экстракции очистку центрифугата от тритона Х-100 проводили с помощью ультрафильтрации на мембранах с пределом пропускания пор 100 кДа, при добавлении 0,1 М NaCl.
В концентрате производили отмывку низкомолекулярных компонентов. Полученный препарат был характеризован по величине удельной активности и чувствительности к ФОС (табл.).
Свойства препарата ХЭ из сублимированных ганглиев тихоокеанского кальмара, обработанных смесью органических растворителей и тритоном Х-100
|
Субстрат |
V m (отн),% |
Удельная активность, мМ АТХ/мин/мг белка |
Выход, % от экстракта |
ГД-42 к II .109, М мин-1 |
ДФФ, к II .107 М мин-1 |
|
АТХ |
100 |
11,60±0,03 |
18 |
1,90±0,01 |
1,20±0,01 |
|
ПТХ |
77 |
||||
|
БТХ |
78 |
Полученный препарат ХЭ катализировал гидролиз всех изученных субстратов, скорость гидролиза уменьшалась при увеличении концентрации субстрата (рис. 4).
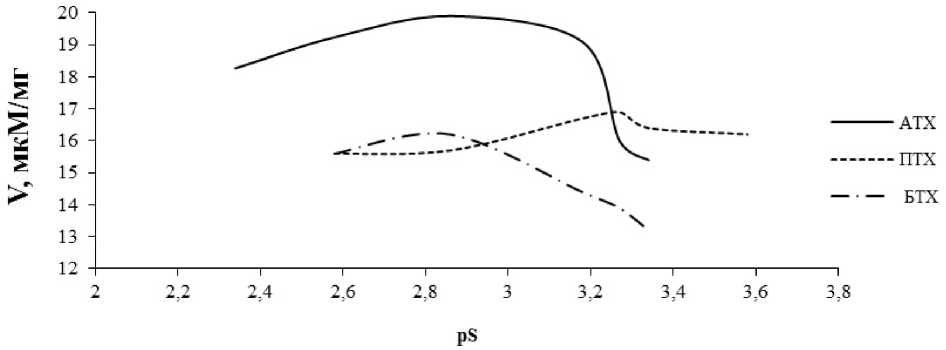
Рис. 4. Зависимость скорости гидролиза (мкМ/мг навески) субстратов от их концентрации (pS) под действием препарата ХЭ из сублимированных ганглиев тихоокеанского кальмара, полученного с использованием тритона Х-100
Фермент, полученный с использованием детергента, с наибольшей скоростью гидролизовал АТХ. При этом скорость гидролиза ПТХ и БТХ была одинаковой. Удельная активность препарата составляла 11,6 Е/мг белка, выход препарата – 18 % от активности в сырье (сублимированные ганглии) (см. табл.).
С целью определения фракционного состава и молекулярной массы компонентов препарата был проведен SDS-электрофорез в полиакриламидном геле (рис. 5).
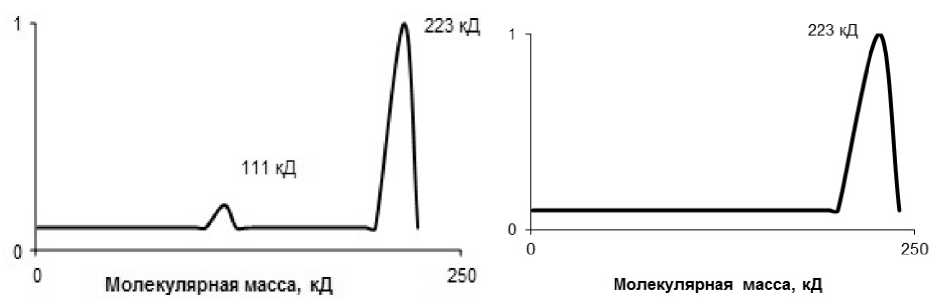
А
Б
Рис. 5. Денситограммы препарата ХЭ из сублимированных ганглиев тихоокеанского кальмара, полученного обработкой смесью органических растворителей и последующей экстракцией 1 %-м тритоном Х-100: А – окраска кумасси; Б – окраска по Карновскому
Как видно на рисунке 5, в препарате присутствует два белковых компонента с молекулярной массой 117 и 217 кДа. Специфическая окраска по Карновскому показала, что холинэстеразной активностью обладает белковая фракция с молекулярной массой 223 кДа.
Выводы. Таким образом, проведенное исследование показало возможность получения гомогенного фермента при использовании органических растворителей и 1 %-го тритона Х-100 из сублимированных ганглиев тихоокеанского кальмара, с удельной активностью 11,6 Е/мг белка. Выход по активности составил 18 % от сублимированного сырья.


