Влияние условий культивирования и противогрибковых средств на продукцию артроконидий грибами Trichophyton verrucosum
Автор: Скворцов Е.В., Мусин Р.Р., Титова В.Ю., Мухаммадиев риН.С., Тремасова А.М.
Статья в выпуске: 1 т.253, 2023 года.
Бесплатный доступ
Целью исследования было изучение состава среды и противогрибковых препаратов, влияющих на выработку артроконидий грибами Trichophyton verrucosum. Продуцирование T. verrucosum артроконидий изучали на различных средах и при разных температурах, рН и концентрации CO2 в газовой среде. Образование артроконидий T. verrucosum оптимально происходило на агаре Сабуро при 8 % содержании CO2, 36 °C, рН 7,5 и было максимальным через 12 дней. При 42 °С и в среде с добавлением 3 % или более NaCl, рост гриба не происходил. В низких, не ингибирующих рост концентрациях гризеофульвин и клотримазол индуцируют образование артроконидий, а тербинафин снижает. Этот результат указывает на важную роль факторов окружающей среды и противогрибковых препаратов в формировании артроконидий. Кроме того, этот результат является клинически значимым, так как, если достаточные концентрации фунгицида не достигаются в некоторых областях поражения, сами противогрибковые средства могут усиливать превращение гиф в артроконидии.
Trichophyton verrucosum, артроконидии, оптимизация культуральной среды, оптимизация газовой среды, гризеофульвин, клотримазол, тербинафин
Короткий адрес: https://sciup.org/142237403
IDR: 142237403 | УДК: 619:636.085:579.8 | DOI: 10.31588/2413_4201_1883_1_253_235
Текст научной статьи Влияние условий культивирования и противогрибковых средств на продукцию артроконидий грибами Trichophyton verrucosum
Дерматофитоз – это микотическая артроконидии могут быть дремлющей инфекция, которая поражает формой, ответственной за сохранение поверхностный ороговевший слой (кожу, хронической рецидивирующей формы волосы) человека [1] и животных [9]. Грибы инфекции. Несмотря на быстрое
Trichophyton verrucosum являются наиболее улучшение лечения в течение последнего распространенными возбудителями десятилетия, многие аспекты дерматофитозов у крупного [5] и мелкого дерматофитных инфекций остаются
-
[2] рогатого скота. Споры в поражениях малоизученными [8]. Существует разница
кожи и инфицированных волосах при между восприимчивостью к дерматофитозе считаются основной артроконидиям и микроконидиям, и это причиной инфекции кожи у людей и может быть одной из причин животных [10]. Инфекция, вызываемая терапевтических неудач и различного этими паразитическими спорами, является уровня резистентности к антибиотикам.
важной проблемой общественного Coelho и соавт. [4] показали, что здравоохранения и ветеринарии, которая до артроконидии более устойчивы к сих пор не решена. флуконазолу, гризеофульвину и
В некоторых условиях итраконазолу, чем микроконидии.
T. verrucosum продуцирует споры путем Возможными причинами терапевтических деления неспециализированных неудач является именно развитие вегетативных гифов на цилиндрические устойчивости к противогрибковым или сферические клетки, которые препаратам [12]. Артроконидии часто называются артроконидиями. По- обнаруживаются при поражении видимому, они играют важную роль в стригущим лишаем. Рост в роговом слое патогенезе заболевания. Образование кожи и волосах происходит в виде гифов, артроконидий характерно для которые затем могут образовывать дерматофитной инфекции кожи и волос артроконидии. Duek и соавт. [6] показали,
-
[14] . Артроконидии устойчивы к что грибковые элементы проникают между
неблагоприятным условиям окружающей слоями рогового слоя и разделяют их.
среды, поэтому одной из наиболее важных Между тем, проведенный нами проблем, связанных с лечением анализ литературных данных показал, что в дерматофитных инфекций, является настоящее время мало информации о сохранение артроконидий в окружающей продуцировании артроконидий грибами среде, что может быть причиной T. verrucosum.
повторного заражения [11]. Возможно, что В этой статье мы описываем изучение влияния окружающей и культуральной сред, а также некоторых противогрибковых средств, на образование артроконидий in vitro грибами T. verrucosum.
Материал и методы исследований. В общей сложности были использованы 6 изолятов дерматофитов T. verrucosum из очагов поражения кожи 6 бычков и коров частного сектора Высокогорского района республики Татарстан в 2022 году. Культуры поддерживали при 27 °C и ежемесячно пересевали на агаре Сабуро, приготовленном на дистиллированной воде.
Для получения артроконидий использовали обычный для агара Сабуро рН 5,6; другие значения рН были получены добавлением гидроксида натрия или хлористоводородной кислоты (HCL). Также использовался агар Сабуро с добавками 1, 2, 3, 4, 5 и 10 % NaCl. Для изучения влияния противогрибковых препаратов на образование артроконидий мы добавляли к агару Сабуро тербинафин, гризеофульвин и клотримазол, применяемые при терапии дерматофитии [13]. Все противогрибковые препараты растворяли в диметил сульфоксиде (ДМСО), и ДМСО в той же концентрации использовали в контроле. Культуры инкубировали в чашках Петри в течение 14 дней в различных условиях. Варьировались температура, концентрация CO2 в газовой среде, а также проводилось инкубирование в аэробных условиях. Через 14 дней роста в чашку Петри на поверхность агара наливали небольшое количество фосфатного буфера (PBS) и собирали, удаляли образовавшийся нарост, осторожно соскабливая поверхность агара стеклянной палочкой. Собранные культуры T. verrucosum ресуспендировали в PBS и промывали, осторожно перемешивая. Надосадочную жидкость отделяли и фильтровали через фильтр с размером пор 12 мкм (Millipore). Фильтрат исследовали микроскопированием при 40-кратном увеличении, количество артроконидий считали в четырех случайно выбранных полях зрения и усредняли. Артроконидии определялись как любой гиф-компартмент длиной менее 4 мкм или любая сферическая клетка диаметром менее 4 мкм, которая по форме явно отличается от микроконидий.
Результат исследований.
Результаты влияния температуры на образование артроконидий у 6 изолятов T. verrucosum , использованных в нашем исследовании, при инкубировании в 8 % концентрации CO 2 на среде агар Сабуро через 12 дней приведены на рисунке 1. Было определено, что температура заметно влияет на образование артроконидий. Для оптимального размножения артроконидий T. verrucosum температура должна составлять 36 °C, что выше, чем температура поверхности тела, обычно от 32 °C до 34 °C. Не наблюдалось роста гриба при 42 °C. Так как наибольшее образование артроконидий наблюдалось при 36 °C, эти условия были использованы в качестве стандарта при сравнении влияния различных факторов на продукцию артроконидий. Оптимальная продолжительность продуцирования артроконидий составила 12 дней (Рисунок 2). Оптимальная концентрация CO 2 8 %. В аэробных условиях образования артроконидий не происходило (Рисунок 3). Проведенное исследование показало, что повышенное содержание в газовой среде CO 2 , 8 %, которое является оптимальным, имеет важное значение для образования артроконидий in vitro у T. verrucosum . Но между тем, является ли стимуляция образования артроконидий следствием присутствия самого CO 2 или пониженного содержания кислорода было предметом некоторых споров [3]. CO 2 физиологически диффундирует из нормальной кожи. Под лечебной повязкой на поверхности кожи концентрация CO 2 достигает значений от 5 % до 8 %. Такие концентрации также обнаруживаются, когда кожа повреждена инфекцией или травмой, а как показали результаты нашего исследования, возникновение повышенного содержания CO 2 может стимулировать трансформацию гифов дерматофитов в цепи артроконидий.
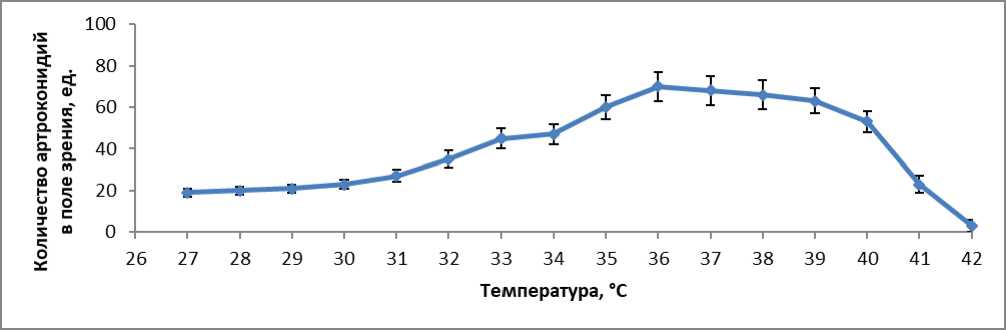
Рисунок 1 - Влияние температуры на образование T. verrucosum артроконидий через 12 дней на агаре Сабуро. Показаны средние значения (n = 6)
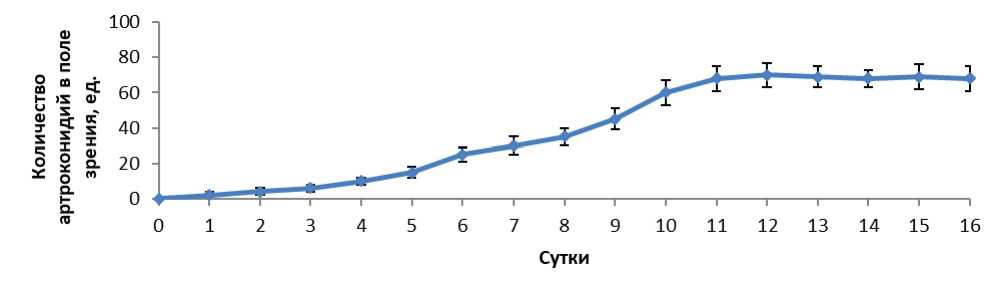
Рисунок 2 – Влияние времени инкубации на образование T. verrucosum артроконидий на агаре Сабуро при 36°C. Показаны средние значения (n = 6)
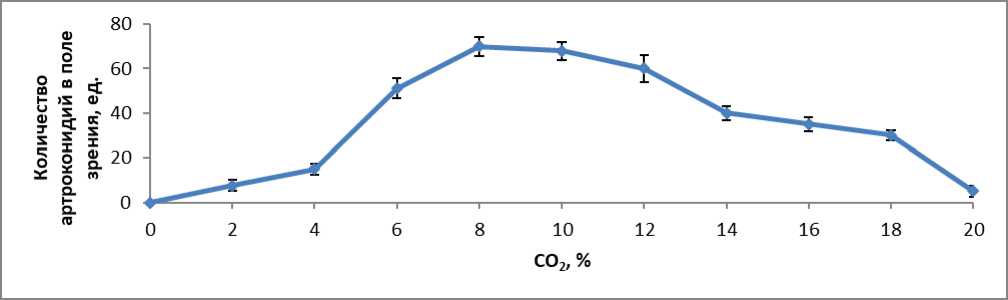
Рисунок 3 – Влияние концентрации CO 2 на образование T. verrucosum артроконидий через 12 дней на агаре Сабуро при 36 °C. Показаны средние значения (n = 6)
Таблица 1 – Влияние содержания NaCl в среде на образование T. verrucosum артроконидий
|
Количество артроконидий в поле зрения |
|||
|
Агар Сабуро |
Агар Сабуро + 1 % NaCl |
Агар Сабуро + 2 % NaCl |
Агар Сабуро + 3 % NaCl |
|
70,2 ± 7,5 |
62,5±9,6 |
21,4±3,5 |
2,2 ± 0,5 |
Показаны средние значения (n = 6)
NaCl ингибировал рост T. verrucosum и как следствие снижал количество артроконидий. При 3 % NaCl роста не наблюдалось (Таблица 1).
Исследовалось влияние на образование артроконидий противогрибковых веществ в низких, не ингибирующих рост концентрациях.
Исследованы гризеофульвин, клотримазол и тербинафин в качестве добавки в агар
Сабуро при 8 % концентрации CO 2 и 36 °C (Таблица 2).
Таблица 2 – Влияние добавки противогрибковых веществ в агар Сабуро на образование T.
verrucosum артроконидий
|
Противогрибковое вещество |
Концентрация, мкг/мл |
Количество артроконидий в поле зрения |
|
Гризеофульвин |
0,25 |
92,4±5,9 |
|
0,5 |
92,6±5,2 |
|
|
Клотримазол |
0,25 |
86,8±5,8 |
|
0,5 |
92,6±4,9 |
|
|
Тербинафин |
0,25 |
22,8±2,8 |
|
0,5 |
20,4±2,6 |
|
|
Контроль агар Сабуро |
Нет |
71,8±5,8 |
|
Контроль агар Сабуро+ДМСО |
Нет |
73,3±5,7 |
Показаны средние значения (n = 6)
Таблица 3 – Влияние pH на образование T. verrucosum артроконидий через 12 дней на агаре Сабуро при 36°C
|
рН |
Количество артроконидий в поле зрения |
|
4,5 |
6,4±0,9 |
|
5,0 |
7,5±0,7 |
|
5,5 |
14,8±1,3 |
|
6,0 |
21,8±2,3 |
|
6,5 |
63,8±6,6 |
|
7,0 |
68,8±6,3 |
|
7,5 |
70,2±7,2 |
|
8,0 |
60,8±6,6 |
|
8,5 |
34,8±3,2 |
|
9,0 |
30,8±2,8 |
|
9,5 |
25,3±2,7 |
Показаны средние значения (n = 6)
Наши исследования показали, что гризеофульвин (0,25-0,5 мкг/мл) и клотримазол (0,25-0,5 мкг/мл) стимулировали образование артроконидий у T. verrucosum. Интересно, что тербинафин (0,25-0,5 мкг/мл) уменьшал образование артроконидий. Между тем, все они являются эффективными и быстродействующими средствами лечения дерматофитии [15]. Полученные нами результаты являются клинически значимыми, так как показывают, что, если в некоторых областях поражения не достигается достаточная концентрация фунгицида, противогрибковое средство может стимулировать трансформацию гиф в артроконидии. Это явление может объяснить случаи неудачного лечения и рецидивов, которые происходят при использовании доступных в настоящее время терапевтических средств. Спящие артроконидии устойчивы к обычным противогрибковым препаратам, таким как клотримазол, миконазол, нистатин и гризеофульвин. Толстые стенки артроконидий могут сопротивляться их действию, для того, чтобы прорасти после прекращения лечения.
В результате проведенных нами исследований было определено, что оптимальный рН для образования артроконидий составляет 7,5 (Таблица 3).
Таким образом, вероятно рН кожи является важным фактором в образовании артроконидий [7].
Заключение. В ходе проведенного нами исследования были определены факторы, которые либо ингибировали, либо стимулировали образование артроконидий T. verrucosum , включая температуру, содержание CO 2 в газовой среде, параметры культуральной среды и противогрибковые препараты. Образование артроконидий оптимально происходило на агаре Сабуро при 8 % содержании CO 2 , 36 °C и рН 7.5 и было максимальным через 12 дней. Рост гриба при 42 °C прекращался. NaCl ингибировал рост T. verrucosum , и при 3 % NaCl роста не наблюдалось. Гризеофульвин и клотримазол индуцируют образование артроконидий, а тербинафин снижает. Полученные нами результаты являются клинически значимыми, так как показывают, что, если в некоторых областях поражения не достигается достаточная концентрация фунгицида, противогрибковое средство может стимулировать трансформацию гиф в артроконидии и сохранение инфекции.
Список литературы Влияние условий культивирования и противогрибковых средств на продукцию артроконидий грибами Trichophyton verrucosum
- Хисматуллина, З. Р. К вопросу о клиническом многообразии зооантропофильной трихофитии волосистой части головы / З. Р. Хисматуллина, М. С. Альхашаш Субхи // Современные проблемы науки и образования. – 2020. – № 3. – С. 1-5.
- Юшкова, А. Ф. Лечение трихофитоза у коз / А. Ф. Юшкова, Ч. Р. Галиева // Международный студенческий научный вестник. – 2017. – № 6. – С. 1-3.
- Berrera, C. R. Formation and germination of fungal arthroconidia / C. R. Berrera // CRC Critic. Rev. Microbiol. – 1986. – № 2. – Р. 271-292.
- Coelho, L. M. In vitro antifungal drug susceptibilities of dermatophytes microconidia and arthroconidia / L. M. Coelho, R. Aquino-Ferreira, C. M. L. Maffei, N. M. Martinze-Rossi // J. Antimicrob. Chemother. – 2008. – № 62. – Р. 758-761
- Courtellemont, L. Epidemiology of Trichophyton verrucosum infection in Rennes University Hospital, France: a 12-year retrospective study / L. Courtellemont, S. Chevrier, B. Degeilh, S. Belaz, J. P. Gangneux, F. Robert-Gangneux // Medical mycology: official publication of the International Society for Human and Animal Mycology. – 2017. – № 55(7). – Р. 1-13.
- Duek, L. The pathogenesis of dermatophyte infections in human skin sections / L. Duek, G. Kaufman, Y. Ulman, I. Berdicevsky // J. Infect. – 2004. – № 48. – Р. 175-180
- El-Tras, F. W. Mixed rearing correlates with the existence of Trichophyton verrucosum pathogens in humans / F. W. El-Tras, А. А. Tayel, M. A. Radi, D. M. El-Kordy, N. N. El-Kady, A. Samir // Dermatologica Sinica. – 2015. – № 33 (3) – Р. 130-133.
- Evans, E. G. V. Causative pathogen in onychomycosis and the possibility of treatment resistance: A review / E. G. V Evans // J. Am. Acad. Dermatol. – 1999. – № 38. – Р. 32-35
- Evans, E. G. V. Subungual dermatophytoma complicating dermatophyte onychomycosis / E. G. V. Evans, D. T. Roberts // Br. J. Dermatol. – 1989. – № 138. – Р. 189-190.
- Gupta, A. K. Arthroconidial formation in Trichophyton raubitschekii / A. K. Gupta, I. Ahmad, M. Porretta, R. C. Summerbell // Mycoses. – 2003. – № 46. – Р. 322-328.
- Gupta, A. K. Comparative efficacies of commonly used disinfectants and antifungal pharmaceutical spray preparations against dermatophytic fungi / A. K. Gupta, I. Ahmad, M. Porretta, R. C. Summerbell // Med. Mycol. – 2001. – № 39. – Р. 321-328.
- Łagowski, D. Comparison of in vitro activities of 11 antifungal agents against Trichophyton verrucosum isolates associated with a variety hosts and geographic origin // D. Łagowski, S. Gnat, A. Nowakiewicz, M. Osińska // Mycoses. – 2019. – № 1. – Р. 1-11.
- O'Gorman, S. M. An uncommon dermatophyte infection: two cases of cutaneous infection with Trichophyton verrucosum / S. M. O'Gorman, D. Britton, P. Collins // Clinical and Experimental Dermatology. – 2015. – № 40(4). – Р. 395-398.
- Rashid, A. Arthroconidia as vectors of dermatophytosis / A. Rashid, // Cutis. – 2001. – № 67. – Р. 23-23.
- Roberts, D. T. Onychomycosis: Current treatment and future challenges / D. T. Roberts // Br. J. Dermatol. – 1999. – № 141. – Р. 1-4.


