Влияние условий произрастания на активность аскорбинатоксидазы и полифенолоксидазы в листьях древесных растений
Автор: Кузьмина Айгуль Мухаметнагимовна
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 2 (52), 2024 года.
Бесплатный доступ
В работе представлены исследования по выявлению видовых особенностей у аборигенных видов древесных растений, произрастающих в насаждениях с различной интенсивностью антропогенного стресса. Показано влияние локальных условий произрастания на активность ферментов аскорбинатоксидазы и полифенолоксидазы. Объектами исследования являлись аборигенные виды Acer platanoides L., Betula pendula Roth. Для определения особенностей динамики активности исследуемых ферментов с учетом уровня загрязнения окружающей среды и локальных условий места произрастания были определены пробные площади 1 и 2, которые отличались по микрорельефу и, как следствие, абиотическим параметрам условий произрастания растений. Пробные площади на возвышенных, хорошо продуваемых участках, имеющих выровненную поверхность, были обозначены "пробная площадь 1". Пробные площади в пределах каждого типа насаждений на участках, имеющих понижение рельефа, были обозначены "пробная площадь 2". Более высокие значения по относительной влажности воздуха и более низкие температуры почвы и атмосферного воздуха наблюдались на пробной площади 2. Активности аскорбинатоксидазы и полифенолоксидазы не одинаково реагируют на различный уровень загрязнения среды обитания и локальные условия произрастания в пределах типа насаждений. Активность аскорбинатоксидазы была видоспецифичной. У B. pendula в насаждениях контроля на пробной площади 2 активность аскорбинатоксидазы достоверно выше, чем на пробной площади 1. У A. platanoides характер активности фермента менялся в течение вегетации в пределах пробных площадей. В насаждениях санитарно-защитных зон и магистральных посадках, наоборот, более высокие значения отмечены на пробной площади 1. В городских насаждениях активность полифенолоксидазы в листьях изучаемых видов древесных растений к августу имела достоверно более высокие значения по сравнению с контрольными насаждениями. Активность полифенолоксидазы у исследуемых деревьев имела общие черты.
Аскорбинатоксидаза, полифенолоксидаза, acer platanoides l, betula pendula roth, локальные условия произрастания
Короткий адрес: https://sciup.org/147243771
IDR: 147243771 | УДК: 581.5 | DOI: 10.15393/j1.art.2024.14602
Текст научной статьи Влияние условий произрастания на активность аскорбинатоксидазы и полифенолоксидазы в листьях древесных растений
На сегодняшний день наблюдается возрастание степени антропогенного воздействия на живые системы. Крупные городские агломерации характеризуются комплексом неблагоприятных факторов среды обитания для живых организмов, включая древесные растения. Неравномерное распределение негативных факторов в пространстве способствует формированию локальных условий места произрастания, которые представлены особенностями рельефа, температурным режимом атмосферного воздуха, температурой поверхности почвы, параметрами отно- сительной влажности воздуха (Никерова и др., 2021; Samancioglu et al., 2016).
Растения в городской среде применяют разнообразные механизмы адаптации к негативным условиям внешней среды (Саму-сик и др., 2022; Kamath et al., 2015).
В научном сообществе сохраняется интерес к изучению особенностей адаптации древесных растений на молекулярном уровне к негативным стресс-факторам городской среды. Механизмы адаптации растений и формирование устойчивости древесных растений к разнообразным стрессам антропогенной среды изучались отечественными и зарубежными исследователями (Иванова и др., 2021; Робакидзе и др., 2021; Лубянова и др., 2021; Hyder et al., 2020).
Важным для жизнедеятельности клетки и всего растительного организма является медьсодержащий фермент класса оксидоредуктаз – полифенолоксидаза, которая выполняет функцию окисления фенольных соединений и участвует в дыхании. Полифе-нолоксидаза принимает участие в приспособительных реакциях к негативным факторам окружающей среды. Она относится к классу терминальных оксидаз растительной клетки, которая локализована в цитоплазме. Данный фермент принимает активное участие в дыхании растительных клеток за счет обратимого окисления полифенолов (Саут-кина, 2022; Nunes et al., 2019).
Другим важным ферментом, участвующим в формировании адаптивных реакций к антропогенным стрессам, является аскор-бинатоксидаза, которая принимает участие в ликвидации активных форм кислорода и защитных реакциях организма в борьбе с окислительным стрессом растительного организма. Аскорбинатоксидаза локализована в клеточной стенке и принадлежит суперсемейству мультимедных оксидаз (Garcia et al., 2016).
В научных исследованиях не достаточно полно изучено влияние локальных условий произрастания на формирование механизма адаптации на молекулярном уровне у древесных растений в городской среде. В связи с этим в условиях г. Набережные Челны изучение экофизиологических особенностей защитных древесных насаждений и древесных пород, связанных с синтезом веществ с антиоксидантной активностью, является актуальным.
Целью исследования являлось изучение влияния локальных условий места произрастания на активность аскорбинатоксидазы и полифенолоксидазы в листьях древесных растений, произрастающих в различных типах насаждений (на примере г. Набережные Челны).
Материалы
Исследования были проведены в период с 2015 по 2022 г. Объектами выступали аборигенные древесные растения клен остролистный ( Acer platanoides L.) и береза повислая ( Betula pendula Roth.). Объем выборки составлял 30 деревьев каждого вида с каждой пробной площади. Выбранные объекты произрастали в насаждениях разных экологических категорий: зона условного контроля – Челнинское лесничество, санитарно-защитные зоны – завод кузнечный ПАО «Камаз», магистральные насаждения проспекта Казанский (рис. 1).
Методы
На исследуемых территориях закладывались пробные площади размером не менее 0.25 га, в пределах которых произрастали выбранные древесные растения.
С целью определения особенностей динамики активности исследуемых ферментов с учетом уровня загрязнения окружающей среды и локальных условий места произрастания были определены два типа биотопов, которые отличались по микрорельефу и, как следствие, по абиотическим параметрам условий произрастания растений. Пробные площади на возвышенных, хорошо продуваемых участках, имеющих выровненную поверхность, были обозначены «биотоп 1». Пробные площади в пределах каждого типа насаждений на участках, имеющих понижение рельефа, были обозначены как «биотоп 2». Более высокие значения по относительной влажности воздуха и более низкие температуры почвы и атмосферного воздуха наблюдались в биотопе 2.
Для выделения локальных условий произрастания в каждой категории насаждений закладывались две пробные площади, которые отличались друг от друга по ряду параметров: степень увлажнения, температурный режим поверхности почвы, относительная влажность воздуха, особенности рельефа. Параметры условий отмечались в сухую и теплую погоду с целью фиксации максимальных отличий. Оценка гидротермического режима атмосферного воздуха проводилась на высоте 2 метров, с этой же высоты был осуществлен сбор листьев для последующего лабораторного анализа. Все наблюдения и сбор растительного матери-
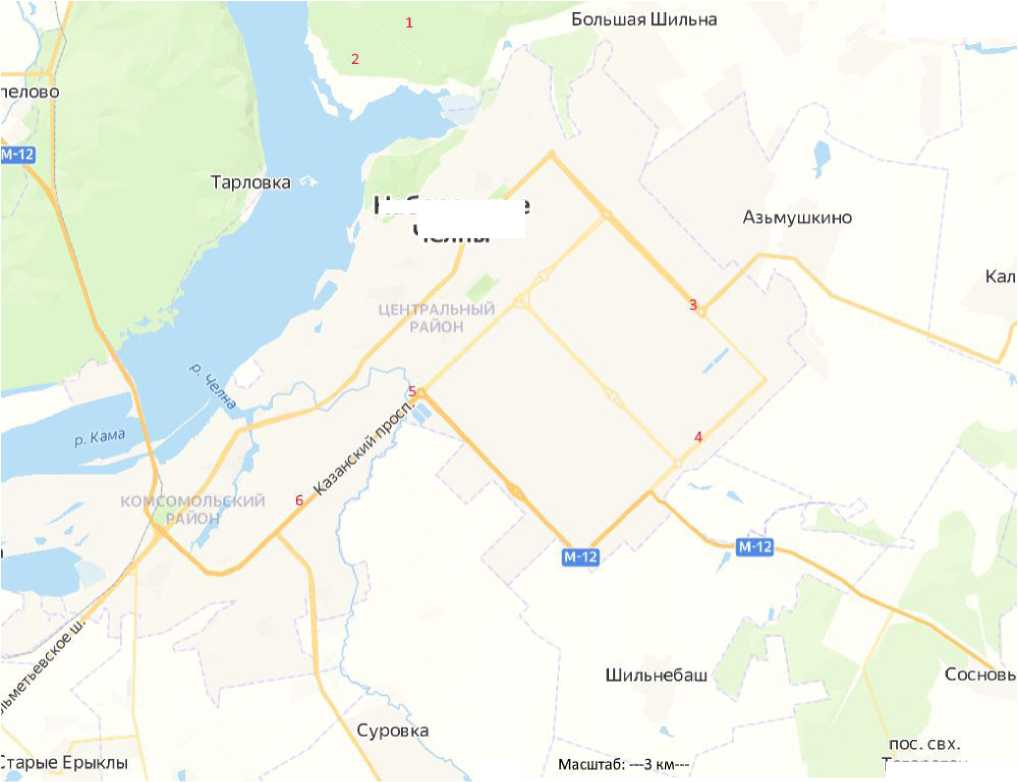
Набережные Челны
Татарстан
Рис. 1. Карта-схема расположения пробных площадей: 1 – зона условного контроля Челнинское лесничество (биотоп 1); 2 – зона условного контроля Челнинское лесничество (биотоп 2); 3 – кузнечный завод (биотоп 1); 4 – кузнечный завод (биотоп 2); 5 – Казанский проспект (биотоп 1); 6 – Казанский проспект (биотоп 2)
Fig 1. The scetch map of the sample plots: 1 – conditional control zone of the Chelny forestry (biotope 1); 2 – conditional control zone of the Chelny forestry (biotope 2); 3 – blacksmith factory (biotope 1); 4 – blacksmith factory (biotope 2); 5 – Kazansky Prospekt (biotope 1); 6 – Kazansky Prospekt (biotope 2)
ала проводили в дневные часы, с 11 до 13 часов. Температуру поверхности почвы замеряли в 10 точках в непосредственной близости к растению в трехкратной повторности в течение дня (утром с 7 до 8 часов), в обед (с 12 до 14 часов) и вечером (с 17 до 18 часов), затем вычисляли среднюю арифметическую полученных трех значений (Методы..., 2014).
Суммарный показатель загрязнения почв Z рассчитывался с учетом коэффициентов концентрации загрязняющих веществ и числа загрязнителей n по формуле (СанПиН 1.2.3685-21).
Z=WW - ( n - !) ■
В зависимости от величины Z устанавливают следующие ранги загрязнения почв: допустимый (Z ≤ 16); умеренно опасный (Z = 16–32); опасный (Z = 32–128); чрезвычайно опасный (Z ≥ 128).
Индекс загрязнения атмосферы рассчитывался по формуле:
ИЗАi = (Сi/ПДКi)кi, где Сi – средняя концентрация i вещества. ПДК - среднесуточная предельно допустимая концентрация i вещества, ki - показатель степени, учитывающий класс опасности вещества - для веществ 1-го класса опасности – 1.5; 2-го – 1.3; 3-го – 1.0; 4-го – 0.85 (РД 52.04.667-2005).
Сбор растительного материала осуществлялся в летние месяцы, с учетных особей собирали по 30 листьев средней формации на годичном вегетативном побеге. Побеги располагались в нижней части кроны южной экспозиции. Определение активности медьсодержащих ферментов в листьях проводили в динамике в июне, июле и августе спектрофотометрически.
Активность аскорбинатоксидазы определяли по методу, предложенному Д. К. Аса-мовым и С. Т. Рахимовой (1987), который основан на свойстве аскорбиновой кислоты поглощать свет с максимумом при длине волны 265 нм. Об активности фермента судили по уменьшению величины оптической плотности, учитывая, что степень окисления аскорбиновой кислоты пропорциональна количеству фермента. Активность полифе-нолоксидазы определяли спектрофотометрическим методом, основанным на измерении оптической плотности продуктов реакции, которые образуются при окислении пирокатехина за определенный промежуток времени (Ермаков и др., 1987).
Математическую обработку осуществляли с использованием статистического пакета Microsoft Windows «Statistica 10». Распределение данных определяли с помощью построения ящичных диаграмм. В описательной статистике осуществляли проверку подгрупп на нормальность. Далее были построены частотные гистограммы (тест K-S, Shapiro-Wilk). С целью анализа полученных данных использовали методы дисперсионного многофакторного анализа ANOVA (при последующей оценке различий методом TuKey HSD test и Scheffe test). В процессе сравнения и анализа полученных результатов использовали уровень значимости (при p < 0.05).
Результаты
В пределах выделенных пробных площадей учитывались следующие параметры: степень увлажнения, температурный режим поверхности почвы, относительная влажность воздуха, особенности рельефа. Параметры условий отмечались в сухую и теплую погоду с целью фиксации максимальных отличий.
В насаждениях зоны контроля преобладают дерново-подзолистные почвы, суммарный показатель загрязнения почвы составил 8. Завод кузнечный в городе Набережные Челны имеет не полностью сформированную санитарно-защитную зону, которая большей частью расположена на юго-востоке города. Загрязнение почвы составляет 24 единицы. На данной территории фиксируются стабильно высокие значения атмосферного воздуха, индекс загрязнения атмосферного воздуха составляет 10.3 единицы. Казанский проспект является самой оживленной магистралью города Набережные Челны с высоким уровнем загрязнения атмосферного воздуха (ИЗА = 12.3). Суммарный показатель загрязнения почвы составляет 30–32. Среди приоритетных загрязнителей санитарно-защитных зон и магистральных посадок можно выделить следующие: формальдегид, фенол, оксиды азота и серы, бенз(а)пирен.
В ходе исследования была выявлена различная активность медьсодержащих ферментов на различный уровень загрязнения среды обитания и локальные условия места произрастания в пределах типа насаждений.
Дисперсионный многофакторный анализ результатов исследований выявил существенное влияние видовых особенностей (уровень значимости p < 10-5), типа насаждения ( p < 10-5), локальных условий места произрастания ( p < 10-5), сроков вегетации ( p < 10-5), а также взаимодействия этих факторов ( p < 10-5) на активность аскобинатоксидазы и полифенолоксидазы в листьях древесных растений (табл. 1).
Обсуждение
Результаты проведенных исследований показали, что у березы повислой в контрольных насаждениях растения в биотопе 2 имели достоверно более высокие показатели активности фермента в листьях по сравнению с растениями биотопа 1: в июне на 0.42 ед. акт., в июле – на 0.34, в августе – на 0.52, при НСР05= 0.02.
В насаждениях санитарно-защитных зон промышленных предприятий у растений на пробной площади 2, наоборот, активность аскорбинатоксидазы в листьях была ниже, чем у растений биотопа 1.
В примагистральных посадках у березы повислой в биотопе 2 в июне и июле активность фермента в листьях была выше на 0.12 и 0.20 ед. акт. по сравнению с показателями биотопа 1, в августе ниже на 0.09 ед. акт. по сравнению с растениями биотопа 1.
У клена остролистного, произрастающего в насаждениях зоны условного контроля в биотопе 2, активность фермента в листьях в июне была ниже на 0.03 ед. акт., чем у растений в биотопе 1, а в августе выше на 0.10 ед. акт. В насаждениях санзон промышленных предприятий и примагистральных посадках у растений биотопа 2 по сравнению с биотопом 1 в начале наблюдений активность аскорбинатоксидазы в листьях была выше на 0.13 и 0.18 ед. акт. соответственно. К концу периода вегетации у растений биотопа 2 в насаждениях санитарно-защитных зон исследуемый показатель имел более низкие значения по сравнению с биотопом 1: в июле
Таблица 1. Результаты дисперсионного анализа по активности аскорбинатоксидазы в листьях древесных растений
|
df |
df |
|||||
|
Факторы |
Effect |
MS Effect |
Error |
MS Error |
F |
p -level |
|
1* |
4 |
35.91434 |
720 |
0.013327 |
2694.886 |
Р < 10-5 |
|
2 |
2 |
28.07945 |
720 |
0.013327 |
2106.9832 |
Р < 10-5 |
|
3 |
3 |
0.313938 |
720 |
0.013327 |
23.556828 |
Р < 10-5 |
|
4 |
2 |
15.39037 |
720 |
0.013327 |
1154.8389 |
Р < 10-5 |
|
12 |
8 |
8.644543 |
720 |
0.013327 |
648.65601 |
Р < 10-5 |
|
13 |
12 |
0.277375 |
720 |
0.013327 |
20.813242 |
Р < 10-5 |
|
14 |
8 |
7.983537 |
720 |
0.013327 |
599.05652 |
Р < 10-5 |
|
24 |
4 |
26.48736 |
720 |
0.013327 |
1987.5186 |
Р < 10-5 |
|
34 |
6 |
0.069637 |
720 |
0.013327 |
5.2252893 |
Р < 10-5 |
|
124 |
16 |
5.537092 |
720 |
0.013327 |
415.48389 |
Р < 10-5 |
|
134 |
24 |
0.11779 |
720 |
0.013327 |
8.8385468 |
Р < 10-5 |
Примечание. * 1 – вид растения; 2 – тип насаждения; 3 – локальные условия произрастания; 4 – срок вегетации.
Таблица 2. Результаты дисперсионного анализа по активности полифенолоксидазы в листьях древесных растений
|
df |
df |
|||||
|
Факторы |
Effect |
MS Effect |
Error |
MS Error |
F |
p -level |
|
1 |
4 |
20.48512 |
180 |
0.079447 |
257.8463 |
Р < 10-5 |
|
2 |
2 |
37.52496 |
180 |
0.079447 |
472.3267 |
Р < 10-5 |
|
3 |
3 |
0.110002 |
180 |
0.079447 |
1.384593 |
0.004 |
|
4 |
2 |
227.2249 |
180 |
0.079447 |
2860.08 |
Р < 10-5 |
|
12 |
8 |
0.460347 |
180 |
0.079447 |
5.794383 |
Р < 10-5 |
|
13 |
12 |
0.155704 |
180 |
0.079447 |
1.959843 |
0.030 |
|
14 |
8 |
6.081296 |
180 |
0.079447 |
76.54528 |
Р < 10-5 |
|
24 |
4 |
7.762559 |
180 |
0.079447 |
97.70734 |
Р < 10-5 |
|
34 |
6 |
0.142807 |
180 |
0.079447 |
1.797517 |
0.002 |
|
124 |
16 |
0.58235 |
180 |
0.079447 |
7.330036 |
Р < 10-5 |
|
134 |
24 |
0.133702 |
180 |
0.079447 |
1.682911 |
0.030 |
– на 0.41, в августе – на 0.18. ед. акт. У растений биотопа 2 в примагистральных посадках, наоборот, показатели активности фермента были выше, чем в биотопе 1: в июле – на 0.49, в августе – на 0.15 ед. акт. В насаждениях санитарно-защитных зон различия наблюдались лишь в июле: активность аскорбинатоксидазы у растений в биотопе 2 была достоверно выше на 0.03 ед. акт., чем в биотопе 1.
В результате сравнения достоверных результатов было отмечено, что общей закономерности в реакции и изменении активности аскорбинатоксидазы в листьях изучаемых древесных растений на комплексное влияние уровня загрязнения и локальных условий произрастания выявить не удалось. Береза повислая и клен остролистный про- являли видовую специфику в активности аскорбинатоксидазы в листьях.
В результате проведенного сравнительного анализа активности полифенолоксидазы были отмечены различия у растений, произрастающих в условиях пробных площадей. Во всех типах насаждений у всех особей, произрастающих в биотопе 2, в течение всего периода наблюдений была зафиксирована достоверно (НСР05 = 0.04 ед. акт.) более высокая активность полифенолоксидазы в листьях по сравнению с биотопом 1: в контрольных насаждениях в июне – на 0.22, июле – на 0.10, а в августе – на 0.16 ед. акт.; в насаждениях санитарно-защитных зон в июне – на 0.14, в июле – на 0.11, в августе – на 0.11 ед. акт.; в примагистральных по-
|
Таблица 3. Активность медьсодержащих ферментов в листьях древесных растений г. Набережные |
|||||
|
Челны, для проб из n = 30 |
|||||
|
Вид |
Тип насаждений |
Месяц |
Биотоп |
Активность |
Активность |
|
растения |
аскорбинатоксидазы |
полифенолоксидазы |
|||
|
Июнь |
1 |
3.13 ± 0.51 |
1.31 ± 0.09 |
||
|
2 |
3.55 ± 0.14 |
1.36 ± 0.13 |
|||
|
Зона условного |
Июль |
1 |
3.48 ± 0.36 |
3.48 ± 0.38 |
|
|
контроля |
2 |
3.82 ± 0.34 |
3.76 ± 0.41 |
||
|
Август |
1 |
4.21 ± 0.26 |
1.76 ± 0.11 |
||
|
2 |
4.73 ± 0.17 |
1.96 ± 0.18 |
|||
|
Июнь |
1 |
3.38 ± 0.22 |
1.22 ± 0.07 |
||
|
2 |
3.08 ± 0.17 |
1.31 ± 0.09 |
|||
|
B. pendula |
Санитарно- |
Июль |
1 |
3.15 ± 0.33 |
2.47 ± 0.14 |
|
защитные насаждения |
2 |
2.86 ± 0.32 |
2.57 ± 0.17 |
||
|
Август |
1 |
2.60 ± 0.27 |
3.85 ± 0.28 |
||
|
2 |
2.61 ± 0.19 |
4.03 ± 0.37 |
|||
|
Июнь |
1 |
3.00 ± 0.31 |
1.26 ± 0.09 |
||
|
2 |
3.12 ± 0.23 |
1.39 ± 0.14 |
|||
|
Магистральные |
Июль |
1 |
2.53 ± 0.17 |
2.54 ± 0.24 |
|
|
посадки |
2 |
2.73 ± 0.21 |
2.53 ± 0.27 |
||
|
Август |
1 |
2.01 ± 0.12 |
3.96 ± 0.31 |
||
|
2 |
1.92 ± 0.09 |
4.07 ± 0.42 |
|||
|
Июнь |
1 |
3.45 ± 0.26 |
0.90 ± 0.13 |
||
|
2 |
3.42 ± 0.35 |
0.98 ± 0.17 |
|||
|
Зона условного |
Июль |
1 |
3.97 ± 0.29 |
2.96 ± 0.26 |
|
|
контроля |
2 |
3.98 ± 0.41 |
3.08 ± 0.36 |
||
|
Август |
1 |
4.56 ± 0.39 |
1.76 ± 0.09 |
||
|
2 |
4.66 ± 0.42 |
1.87 ± 0.16 |
|||
|
Июнь |
1 |
3.76 ± 0.27 |
1.03 ± 0.09 |
||
|
2 |
3.89 ± 0.36 |
1.36 ± 0.11 |
|||
|
A. |
Санитарно- |
Июль |
1 |
3.29 ± 0.31 |
3.01 ± 0.32 |
|
platanoides |
защитные насаждения |
2 |
2.88 ± 0.11 |
3.34 ± 0.36 |
|
|
Август |
1 |
2.48 ± 0.27 |
3.41 ± 0.38 |
||
|
2 |
2.30 ± 0.19 |
3.66 ± 0.33 |
|||
|
Июнь |
1 |
3.77 ± 0.36 |
1.02 ± 0.12 |
||
|
2 |
3.95 ± 0.39 |
1.32 ± 0.21 |
|||
|
Магистральные |
Июль |
1 |
2.93 ± 0.26 |
3.30 ± 0.28 |
|
|
посадки |
2 |
3.42 ± 0.31 |
3.67 ± 0.42 |
||
|
Август |
1 |
2.51 ± 0.18 |
4.79 ± 0.47 |
||
|
2 |
2.66 ± 0.25 |
5.07 ± 0.31 |
|||
|
НСРП5 |
0.02 |
0.04 |
|||
У березы повислой и клена остролистного независимо от типа насаждения и периода наблюдений особи в биотопе 2 имели достоверно более высокие показатели активности полифенолоксидазы в листьях по сравнению с биотопом 1.
На сегодняшний день активность поли-фенолоксидазы в листьях древесных растений слабо освещена в научной литературе. Встречаются сведения о ее роли в антиокси- дантной системе защиты растений, а также в участии в процессах вторичного метаболизма, подчеркивается специфическая линия защиты с выполнением особых функций в окислительном процессе растения (Vatankhah et al., 2010; Guo et al., 2014). В работах отмечается тенденция к возрастанию активности полифенолоксидазы в листьях древесных растений, произрастающих в условиях антропогенной среды, к концу периода вегетации (Заплатин, 2008), что подтверждается и в наших исследованиях, при этом уделяется мало внимания роли локальных условий произрастания.
Заключение
Активность фермента полифенолоксида-зы в листьях изучаемых видов древесных растений в августе имела достоверно более высокие значения в городских насаждениях в отличие от контрольных. По активности аскорбинатоксидазы реакция исследуемых видов специфична. Общей закономерности в реакции и изменении активности аскор-бинатоксидазы в листьях изучаемых аборигенных видов древесных растений на комплексное влияние уровня загрязнения и локальных условий произрастания выявить не удалось, а по показателю активности поли-фенолоксидазы реакция у березы повислой и клена остролистного схожая.
Список литературы Влияние условий произрастания на активность аскорбинатоксидазы и полифенолоксидазы в листьях древесных растений
- Ермаков А. И., Арасимович В. В., Ярош Н. П. и др. Определение активности полифенолоксидазы и аскорбинатоксидазы // Методы биохимического исследования растений. Л., 1987. С. 48–51.
- Заплатин Б. П. Биотестирование атмосферных загрязнений по содержанию хлорофилла и активности полифенолоксидазы // Известия Пензенского государственного педагогического университета им. В. Г. Белинского. 2008. № 14. С. 82–87.
- Иванов О. А., Домаш В. И., Канделинская О. Л. Биохимические механизмы адаптации древесных растений к техногенному загрязнению (на примере Солигорского промышленного района) // Ботаника. Исследования. 2021. № 50. С. 306–321.
- Лубянова А. Р., Безрукова М. В., Шакирова Ф. М. Взаимодействие сигнальных путей при формировании защитных реакций растений в ответ на стрессовые факторы окружающей среды // Физиология растений. 2021. Т. 68, № 6. С. 563–578. DOI: 10.31857/S0015330321060129
- Методы полевых экологических исследований: Учеб. пособие / О. Н. Артаев (и др.); Под ред. А. Б. Ручина (и др.). Саранск: Изд-во Мордов. ун-та, 2014. 412 с.
- Никерова К. М., Галибина Н. А., Чирва О. В., Климова (Успенская) А. В. Активные формы кислорода и компоненты антиоксидантной системы – участники метаболизма растений. Взаимосвязь с фенольным и углеводным обменом // Труды Карельского научного центра Российской академии наук. 2021. № 3. С. 5–20. DOI: 10.17076/eb1312
- Робакидзе Е. А., Торлопова Н. В., Бобкова К. С., Наймушина С. И. Мониторинг состояния древесных растений в сосняках черничных при загрязнении выбросами Сыктывкарского лесопромышленного комплекса (Республика Коми) // Растительные ресурсы. 2021. Т. 57, № 3. С. 260–274. DOI: 10.31857/S0033994621030067
- РД 52.04.667-2005 Документы о состоянии загрязнения атмосферы в городах для информирования государственных органов, общественности и населения. Общие требования к разработке, построению, изложению и содержанию. . М., 2016. 37 с.
- СанПиН 1.2.3685-21. Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания: постановление главного государственного санитарного врача РФ от 28.01.2021 г. № 2. . М., 2021. 635 с.
- Сауткина М. Ю. Анализ биохимического разнообразия вегетативной сферы дуба черешчатого лесостепной зоны // Самарский научный вестник. 2022. Т. 11, № 1. С. 114–118. DOI: 10.55355/snv2022111114
- Самусик Е. А., Марчик Т. П., Головатый С. Е. Интенсивность окислительных процессов и активность антиоксидантной системы в листьях древесных растений, произрастающих в условиях техногенного загрязнения // Социально-экологические технологии. 2022. Т. 12, № 4. С. 418–438. DOI: 10.31862/2500-2961-2022-12-4-418-438
- Garcia D. E., Glasser W. G., Pizzi A., Paczkowski S. P., Laborie M. P. Modification of condensed tannins: from polyphenol chemistry to materials engineering // New Jornal of Chemistry. 2016. Vol. 1. P. 234–242.
- Garchery C., Gest N., Do P. T. et al. Altered stomatal dynamics in ascorbate oxidase over-expressing tobacco plants suggest a role for dehydroascorbate signalling // Journal of Experimental Botany. 2008. Vol. 59. P. 729–737.
- Garchery C., Gest N., Do P. T et al. Diminution in ascorbate oxidase activity affects carbon allocation and improves yield in tomato under water deficit // Plant Cell Environ. 2013. Vol. 36 (1). P. 159–175. DOI: 10.1111/j.1365-3040.2012.02564.x
- Guo H., Sun Y., Li Y., Liu X., Zhang W., Ge F. Elevated CO2 decreases the response of the ethylene signaling pathway in Medicago truncatula and increases the abundance of the pea aphid // New Phytologist. 2014. Vol. 201, № 1. P. 279–291. DOI: 10.1111/nph.12484
- Kamath S. D., Arunkumar D., Avinash N. G. et al. Determination of total phenolic content and total antioxidant activity in locally consumed food stuffs in Moodbidri, Karnataka, India // Adv. Appl. Sci. Res. 2015. Vol. 6, № 6. P. 99–102.
- Nunes M. H., Both S., Bongalov B., et al. Changes in leaf functional traits of rainforest canopy trees associated with an El Niño event in Borneo // Environ. Res. Lett. 2019. № 14. Р. 2–14.
- Samancioglu A., Sat I. G., Yildirim E. et al. Total phenolic and vitamin C content and antiradical activity evaluation of traditionally consumed wild edible vegetables from Turkey // Indian J. of Traditional Knowledge. 2016. Vol. 15, № 2. P. 208–213.
- Hyder P. W., Fredrickson E. L., Estell R. E. et al. Distribution and concentration of total phenolics, condensed tannins, and nordihydroguaiaretic acid (NDGA) in creosotebush (Larreatridentata) // Biochemical Systematics and Ecology. 2020. № 30. Р. 905–912.
- Vatankhah E., Niknam V., Ebrahimzadeh H. Activity of antioxidant enzyme during in vitro organogenesis in Crocus sativus // Biol. Plantarum. 2010. Vol. 54, № 3. P. 509–514. DOI: 10.1007/s10535-010-0089-9


