Внутри-видовой полиморфизм Plasmopara halstedii, выявляемый SNP-маркерами
Автор: Рамазанова С.А., Антонова Т.С., Ивебор М.В., Стрельников Е.А., Гучетль С.З.
Рубрика: Защита растений и иммунология
Статья в выпуске: 2 (148-149), 2011 года.
Бесплатный доступ
Изучен полиморфизм SNP-локусов Pfa6, Pha54, Pha56, Pfa82 и Pfa99 для изолятов возбудителя лож-ной мучнистой росы Plasmopara halstedii (Farl.) Berl. et de Toni. из разных стран. Показано, что все изоляты разных рас из Краснодарского края РФ идентичны по локусам Pfa6, Pfa56, Pfa82 и Pfa99, имея один и тот же аллель. Выявлен полиморфизм у изолятов из Краснодарского края по локусу Pfa54. Расы 330, 730 и 100 от-личаются по аллельному состоянию этого локуса от остальных изученных рас.
Ложная мучнистая роса, раса, молекулярные маркеры, пцр
Короткий адрес: https://sciup.org/142151007
IDR: 142151007 | УДК: 633.72:632.11:581.1
Текст научной статьи Внутри-видовой полиморфизм Plasmopara halstedii, выявляемый SNP-маркерами
SNP-маркеры (Single Nucleotide Polymorphism) представляют собой новейшее поколение молекулярных маркеров. Интерес к этому типу маркеров появился в ходе реали-
зации проектов по определению полной нуклеотидной последовательности генома ряда модельных организмов. Благодаря высокой частоте встречаемости SNP-маркеры широко используют в различных направлениях исследований генов и геномов, в частности, для идентификации организмов [1; 2].
Грибной патоген Plasmopara halstedii (Farl.) Berl. et de Toni является одним из самых вредоносных на подсолнечнике. В настоящее время идентифицировано 36 патотипов патогена [3], описанных с помощью трёхзначной номенклатуры, принятой в 2000 г. [4]. Для идентификации рас патогена и в целях выявления структуры популяций возбудителя болезни в 2008 г. французскими учеными была проведена работа по поиску SNP-маркеров [5]. На основе экспрессирующихся последовательностей ДНК EST (Expressed Simplе Tages) этими авторами были разработаны более удобные в применении SNP-маркеры, выявляющие однонуклеотидные замены в геномной ДНК Plasmopara halstedii. Ими было дифференцировано 14 рас патогена, собранных в разных областях Франции [6].
Целью нашей работы было изучение внутривидового полиморфизма P. halstedii , поражающей подсолнечник в Краснодарском крае, с применением пяти SNP-маркеров.
Материалы и методы . Материалом для исследований послужили полевые изоляты шести рас P. halstedii , собранных с пораженных растений подсолнечника в Краснодарском крае, и 16 образцов ДНК разных рас патогена, любезно предоставленных нам французскими коллегами (INRA, UMR santé Vegtale (INRA-ENITA). Расовый состав изо-лятов гриба определяли в соответствии с общепринятой номенклатурой [4]. Искусственное заражение линий-дифференциаторов подсолнечника осуществляли по известной методике, погружением корней проростков в инокулюм зооспор [7].
Материал был собран с проростков восприимчивого сорта подсолнечника ВНИИМК 8883, искусственно зараженных зооспорами каждого изолята отдельно. ДНК выделяли из конидиального спороношения P. halstedii и из тканей пораженных семядольных листьев проростков подсолнечника с применением модифицированного CTAB-метода [8].
Для реакции амплификации были использованы праймеры, фланкирующие участок ДНК с единичной нуклеотидной заменой
(SNP-полиморфизм) (табл. 1). ПЦР выполняли в реакционной смеси (25 мкл) следующего состава: 67 мМ Трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5-3,0 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК-полимеразы («ГосНИИ-генетика», Россия). Реакции проводили в амплификаторе «Терцик» («АО ДНК-технология», Россия) при следующих температурных режимах: начальная денатурация при 96 °С в течении 4 минут, далее 38 циклов с последовательной сменой температур.
CAPS-анализ проводили с использованием следующих эндонуклеаз рестрикции фирмы Fermentas: Tsp45I, FauI, OliI, BspMI, BsrDI.
Рестриктную обработку продуктов амплификации в количестве 10 мкл проводили в буферах и согласно инструкций, прилагаемых фирмой производителем к каждой эндонуклеазе рестрикции. Время инкубации для всех рестриктаз – 3 часа при температуре 37 °С. Для выявления фрагментов ДНК, использовали электрофорез продуктов рестрикции в 2 %-ном агарозном геле на основе ТАЕ буфера при напряжении 90-100 V и силе тока 50 А в течение 1,5 часа. Гели окрашивали бромистым этидием. Визуализацию проводили с использованием гель-документирующей системы Bio-Print.
Результаты и обсуждение . В настоящее время применяется много методик выявления (детекции) аллельных вариантов SNP [2; 9]. В своей работе Giresse с соавторами использовали для выявления SNPs полиморфизма P. halstedii четыре разных метода [5; 6]. В соответствии с техническими возможностями нашей лаборатории для исследования были выбраны локусы, в которых однонуклеотидные замены выявляются ферментативным методом (CAPS). Последовательности праймеров, фланкирующих эти локусы, представлены в таблице 1.
Возможность четкой интерпретации результатов является одним из основных требований к молекулярным маркерам. В представленных в таблице 1 SNP-локусах изменения одного нуклеотида затрагивают сайты рестрикции эндонуклеаз, и поэтому различение аллелей этих локусов не представляет трудностей.
Например, различия в миграции продуктов рестрикции рестриктазой Bvel обусловлены тем, что если в нуклеотидной последовательности продукта амплификации с праймером Pfa82 есть фрагмент ACCTGC(N)4/8, который входит в состав сайта рестрикции данной ре-стриктазы, то она подвергается «разрезанию», что и приводит к разнице в размерах фрагментов ДНК и, следовательно, изменению скорости миграции продуктов рестрикции при электрофорезе. На фореграммах (рис. 1, 2) это аллель 2. Если в нуклеотидной последовательности сайта рестрикции есть нуклеотидная замена, то разрезания не происходит (аллель 1).
Таблица 1
Характеристика исследованных SNP-локусов
|
Локус |
Тип полиморфизма |
Эндо-нуклеаза рес-трик-ции |
Нуклеотидная последовательность (5 ′ -3 ′ ) |
|
|
Pfa6 |
SNP ∗ |
Tsp45I |
F: R |
GTCGCTGATTTTATGTTTATGTGC : TACTACCTCAGTCACATCATCACC |
|
Pfa54 |
SNP |
FauI |
F: R |
ATTTGGCAACGTCTCAGAGC CCATCGTAATAACATTCTTTAAAGTCC |
|
Pfa56 |
Indel ∗∗ |
OLiI |
F: R |
GCGGTACTGGTCTATGTGCTG : TTCAAGAAGTTTGATTTTTCATGC |
|
Pfa82 |
SNP |
BspMI |
F: R |
ACTCGATCCATGCAGTAAGTAAG : AGGAGGCTTTGCAGATTGAA |
|
Pfa99 |
SNP |
BsrDI |
F: R |
CTCGCATTCAAACGGAAAAT : CAAGCCAACTGTGCATGAAT |
∗ изменения одного нуклеотида
∗∗ изменения нескольких нуклеотидов и небольшая инсерция/делеция
На рисунке 1 представлена электрофореграмма продуктов амплификации с праймером Pfa82 c последующей обработкой рестриктазой Bvel изолятов разных рас P. halstedii на подсолнечнике, собранных в Краснодарском крае. А на рисунке 2 – аналогичные продукты амплификации с тем же праймером изолятов разных рас гриба, доставленных из Франции. По этому локусу у изученных изолятов гриба из Краснодарского края не выявлено полиморфизма. Расы 330,730,710 и 100 идентичны по этому локусу.
Как хорошо видно из рисунка, электрофоретические спектры продуктов рестрикции у изолятов расы 100 из РФ и Франции хорошо различимы. У изолята из Франции выявлен аллель 1, а из Краснодарского края – 2.
Указанные различия пока сложно объяснить, т. к. необходимо изучить большую выборку изолятов. Раса 100 исключительно редко встречается в Краснодарском крае. Для исследований у нас имелся только один изо-лят, который ранее показал идентичность с образцом ДНК расы 100 из Франции по локусу Pfa74 [9].
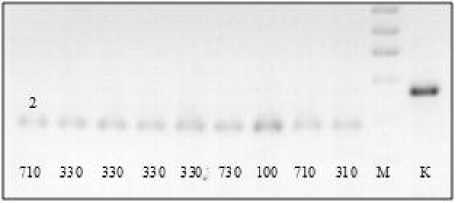
Рисунок 1 – Электрофоретические спектры продуктов рестрикции фрагментов ДНК по локусу Pfa82 у рас P. halstedii 330, 730, 710, 710, 310, 100, собранных на подсолнечнике в Краснодарском крае. К – продукты амплификации без обработки рестриктазой. М – маркер молекулярного веса.
2 – аллель локуса Pfa82
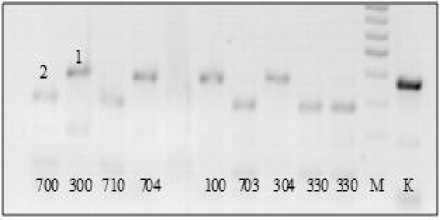
Рисунок 2 – Электрофоретические спектры продуктов рестрикции фрагментов ДНК по локусу
Pfa82 у рас P. halstedii 700, 300, 710, 704, 100, 703, 304, 330, собранных на подсолнечнике во
Франции. К – продукты амплификации без обработки рестриктазой. М – маркер молекулярного веса. 1, 2 – аллели локуса Pfa82
По локусу Pfa6 изменения в последовательности нуклеотидов находятся в сайте ре стрикции рестриктазы Tsp45I 5′...GTSAC…3′. В образцах ДНК всех рас, собранных в Краснодарском крае, нуклеотидная последовательность в данном локусе такова, что происходит «разрезание», т. е. на электрофореграмме размер фрагментов ДНК после рестрикции значительно меньше, чем до нее (рис. 3). Расы из Краснодарского края 330,710,730,700,310 не различались по локусу Pfa6.
Аналогично и по локусам Pfa56 и Pfa99. Изученные образцы ДНК рас гриба 330, 730, 710, 700, 310 и 100 из Краснодарского края имеют одинаковые аллели и, следовательно, не различаются. В то время как для образцов рас тех же наименований из Франции оба локуса полиморфны.
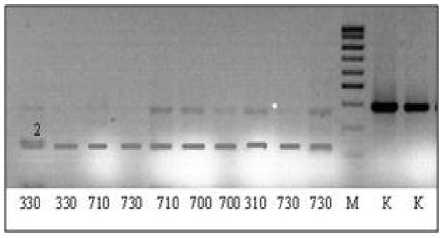
Рисунок 3 – Электрофоретические спектры продуктов рестрикции фрагментов ДНК по локусу Pfa6 у рас P. halstedii 330, 710, 730, 310, 700, собранных на подсолнечнике в Краснодарском крае. К – продукты амплификации, не обработанные рестриктазой. М – маркер молекулярного веса.
2 – аллель локуса Pfa6.
По локусу Pfa54, наоборот, были обнаружены различия между изолятами гриба из Краснодарского края. Образцы рас 100, 330 и 730 отличались от всех остальных изученных образцов. Произошедшая в сайте рестрикции 5 ′ -CCCGC(N) 4 - 3 ′ рестриктазы FauI мутация привела к тому, что расщепление фрагмента ДНК после рестриктной обработки не происходит. На электрофореграмме фракции ДНК образцов этих рас расположены на том же уровне, что и фракции продуктов амплификации, не обработанные рестриктазой (рис. 4).
710 710 730 730 710 710 330 330 700 330 М К К
ъ
Рисунок 4 – Электрофоретические спектры продуктов рестрикции фрагментов ДНК по локусу Pfa54 у рас P. halstedii 330, 710, 730, 700, собранных на подсолнечнике в Краснодарском крае. К – продукты амплификации, не обработанные ре-стриктазой. М – маркер молекулярного веса. 1, 2 – аллели локуса Pfa54
Изучение пяти локусов изолятов Plasmo-para halstedii из разных стран показало, что четыре из них – полиморфны, а локус Pfa56 был изучен только у изолятов гриба из Краснодарского края. Для них он мономорфен. Наибольший уровень полиморфизма выявлен у изолятов P. halstedii из Франции. Полимор- физм у изолятов из Краснодарского края обнаружен только по локусу Pfa54. Как было сказано выше, этот локус позволяет отличить расы 330, 730 и 100 от остальных изученных рас.
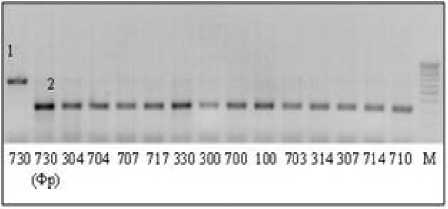
Рисунок 5 – Электрофоретические спектры продуктов рестрикции фрагментов ДНК по локусу Pfa54 у рас P. halstedii. Первая дорожка: раса 730 из Краснодарского края, остальные дорожки – расы из Франции. М – маркер молекулярного веса.
1, 2 – аллели локуса Pfa54
Таблица 2
Аллельное состояние SNP-локусов рас ЛМР
|
Раса |
Количество изолятов |
Локус |
||||
|
Pfa6 |
Pfa54 |
Pfa82 |
Pfa56 |
Pfa99 |
||
|
Изоляты из Краснодарского края |
||||||
|
330 |
30 |
2 |
1 |
2 |
2 |
1 |
|
730 |
11 |
2 |
1 |
2 |
2 |
1 |
|
710 |
20 |
2 |
2 |
2 |
2 |
1 |
|
700 |
5 |
2 |
2 |
2 |
2 |
1 |
|
310 |
5 |
2 |
- |
2 |
2 |
1 |
|
100 |
1 |
2 |
1 |
2 |
2 |
1 |
|
Изоляты из Франции |
||||||
|
730 |
1 |
2 |
2 |
- |
- |
2,1 |
|
710 |
1 |
2 |
2 |
2 |
- |
2 |
|
700 |
1 |
2 |
2 |
2 |
- |
2,1 |
|
300 |
1 |
1 |
2 |
1 |
- |
1 |
|
100 |
1 |
1 |
2 |
1 |
- |
1 |
|
707 |
1 |
2 |
2 |
1 |
- |
1 |
|
717 |
1 |
2 |
2 |
2 |
- |
1 |
|
704 |
1 |
1 |
2 |
1 |
- |
1 |
|
714 |
1 |
1 |
2 |
- |
- |
2,1 |
|
307 |
1 |
2 |
2 |
- |
- |
1,2 |
|
314 |
1 |
1 |
2 |
- |
- |
2,1 |
|
703 |
1 |
2 |
2 |
2 |
- |
2 |
|
304 |
1 |
1 |
2 |
1 |
- |
1,2 |
|
Изоляты из Испании |
||||||
|
304 |
1 |
1 |
2 |
1 |
- |
1 |
|
330 |
1 |
2 |
2 |
2 |
- |
2 |
|
Изолят из США |
||||||
|
330 |
1 1 |
2 1 |
1 1 |
2 1 |
- 1 |
- |
Из таблицы 2 видно, что у некоторых рас, определенных по трехзначной номенклатуре как идентичные, но имеющие разное географическое происхождение, выявлен разный аллельный состав. Например, раса 100 из
ISSN 0202-5493. МАСЛИЧНЫЕ КУЛЬТУРЫ. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур. Вып.2 (148-149), 2011
Краснодарского края отличается от таковой из Франции по трем локусам Pfa6, Pfa54 и Pf82. А изоляты расы 730 отличаются по локусу Pfa54, расы 710 – по локусу Pfa99. Изолят расы 330 из Испании отличается по аллельному составу от изолятов этой расы из США и России. Возможно, это связано с тем, что формирование рас происходило в разных географических регионах обособленно. Разные климатические условия, а так же сортимент выращиваемого подсолнечника могли привести к тому, что точечные мутации в ДНК гриба формировались по-разному.
Таким образом, проведение анализа по пяти выбранным SNP-маркерам показало, что этого набора недостаточно, чтобы идентифицировать каждый из исследованных образцов. Из изученных локусов перспективным для дифференциации рас Plasmopara halstedii является только локус Pfa54. Поэтому необходимо продолжить исследования по поиску полиморфных молекулярных маркеров и созданию на их основе системы маркеров для дифференциации рас патогена. В то же время, несмотря на идентичность аллельного состояния локусов Pfa6, Pfa56, Pfa82, Pfa99 у изолятов гриба из Краснодарского края разной расовой принадлежности, их маркеры необходимо применять с целью идентификации новых биотипов паразита из регионов возделывания подсолнечника в РФ.


