Воспроизводительные качества петухов с нормальным и модифицированным геномом
Автор: Волкова Н.А., Ветох А.Н., Иолчиев Б.С., Жилинский М.А., Волкова Л.А., Томгорова Е.К., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные технологии
Статья в выпуске: 6 т.53, 2018 года.
Бесплатный доступ
К современным успехам в создании трансгенной сельскохозяйственной птицы следует отнести получение эффективных генных конструкций и разработку результативных систем доставки рекомбинантной ДНК в клетки-мишени. Однако при разведении генно-модифицированной птицы вероятны проблемы с трансгенным потомством, в частности репродуктивные нарушения, ограничение численности потомства, снижение его жизнеспособности. В настоящей работе впервые была изучена гистологическая структура семенников и состав сперматогенных клеток в семенных канальцах у трансгенных петухов, полученных нами разными способами, и оценено качество и оплодотворяющая способность их семени. Исследования (ФНЦ ВИЖ им. Л.К. Эрнста, 2017-2018 годы) выполняли на трансгенных петухах ( Gallus gallus L.), полученных на основе породы Первомайская, и их нетрансгенных аналогах. Из трансгенных петухов сформировали две группы - полученные при введении лентивирусного вектора pWRSV в эмбрионы кур in vivo (I группа, n = 4) и посредством трансплантации трансформированных донорских сперматогониев в семенники стерильных петухов-реципиентов ( n = 5)...
Петухи, трансгенез, генные конструкции, трансплантация, трасформированные сперматогонии, акросома, сперматозоид, качество спермы, оплодотворяющая способность, выводимость
Короткий адрес: https://sciup.org/142220069
IDR: 142220069 | УДК: 636.52/.58:576.3/.7: | DOI: 10.15389/agrobiology.2018.6.1212rus
Текст научной статьи Воспроизводительные качества петухов с нормальным и модифицированным геномом
Целенаправленная модификация генома сельскохозяйственной птицы — перспективное направление современной биотехнологии, которое рассматривается как альтернатива традиционной селекции (1). Этот подход позволяет значительно ускорить получение популяций особей с желаемыми, а также качественно новыми признаками, привнесение которых стандартными селекционными методами невозможно. Однако приемы, используемые для изменения генома у трансгенных сельскохозяйственных животных, малоэффективны при создании генно-модифицированной птицы, что связано с особенностями ее воспроизводства и развития (2). В то же время биология этой таксономической группы дает возможность существенно расширить набор методов для эффективного введения рекомбинантной ДНК в клетки-мишени. Эмбрионы птиц развиваются вне организма самки, что облегчает доступ к ним при выполнении
∗ Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-16-10059 (исследование петухов, полученных посредством трансплантации донорских сперматогониев) и в рамках задания Федерального агентства научных организаций (ФАНО России) ¹ АААА-А18-118021590132-9 (исследование трансгенных петухов, полученных с использованием лентивирусных векторов).
генно-инженерных манипуляций. В качестве перспективных мишеней для введения рекомбинантной ДНК рассматриваются клетки бластодермы (3, 4), примордиальные зародышевые клетки (5, 6) и сперматогонии (7).
В настоящее время разработаны методы для эффективного направленного переноса рекомбинантных генов в эмбриональные и соматические клетки кур, в частности введение рекомбинантной ДНК в эмбриональные клетки с помощью лентивирусных (8) и ретровирусных (9) векторов, трансплантация трансформированных донорских примордиальных зародышевых клеток (10, 11) и сперматогониев (12, 13), трансформация примордиальных зародышевых клеток (14) и сперматогониев (15) in vivo. С использованием этих подходов выведены трансгеные куры, продуцирующие с белком яйца маркерные белки (16, 17) и рекомбинантные белки человека (18, 19). Однако при дальнейшем разведении таких особей возможны проблемы с получением трансгенного потомства (репродуктивные нарушения, меньшая численность и низкая жизнеспособность), обусловленные низкой фертильностью исходных родительских форм. В ряде исследований показано снижение оплодотворяющей способности семени и либидо у самцов трансгенных животных по сравнению с нетрансгенными особями (20, 21). На трансгенной сельскохозяйственной птице подобные исследования практически не проводились. В этой связи представляет интерес изучить воздействие трансгенеза на функциональное состояние половых клеток генетически модифицированной птицы, в частности петухов.
В настоящем исследовании впервые изучена гистологическая структура семенников и состав сперматогенных клеток в семенных канальцах у трансгенных петухов, полученных с использованием разных методических подходов. Установлено снижение качества и оплодотворяющей способности семени у трансгенных петухов по сравнению с контролем. Впервые выявлено уменьшение числа сперматогенных клеток в семенных канальцах петухов после трансплантации донорских сперматогониев. При этом не обнаружено значительных патологических нарушений в гистологической структуре семенников.
Цель работы заключалась в оценке репродуктивных качеств трансгенных петухов в сравнении с их нетрансгенными аналогами, а именно в изучении качественных и количественных показателей семени, его оплодотворяющей способности, гистоструктуры семенных канальцев семенников и количественного состава в них сперматогенных клеток.
Методика . Исследования выполняли на трансгенных петухах ( Gallus gallus L.), полученных на основе породы Первомайская. В I группу ( n = 4) входило потомство, выведенное из эмбрионов, в которые in vivo вводили лентивирусный вектор pWRSV, полученный нами ранее; II группу ( n = 5) составили стерильные петухи-реципиенты после трансплантации в их семенники трансформированных in vitro донорских сперматогониев. Контрольная группа ( n = 5) включала нетрансгенных особей в возрасте 8-9 мес, подобранных по принципу аналогов. Трансгенная и нетрансгенная птица содержалась в условиях физиологического двора (ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год) в индивидуальных клетках. При кормлении использовали полнорационные комбикорма.
Сперму от петухов получали посредством абдоминального массажа 1 раз в 2-3 сут. Для выработки условного рефлекса спермоотдачи петухов подготавливали в течение 1-2 нед. Объем эякулята определяли градуированной пипеткой (до 1,0 мл). Концентрацию сперматозоидов рассчитывали с использованием камеры Горяева при просмотре под микроскопом Nikon Ni-U («Nikon Corporation», Япония; увеличение ½400). Их подвиж- ность оценивали на нагревательном столике при 38-40 °С, эякулят предварительно разбавляли 5-кратно. Свежеполученные препараты сперматозоидов фиксировали в метаноле в течение 10 мин и проводили морфометрический анализ (увеличение ½400) с помощью цифровой камеры Nikon DS-Qi2 («Nikon Corporation», Япония; разрешение 4908½3264 px). Морфометрические показатели (площадь головки и акросомы, общая длина сперматозоида, длина жгутика) рассчитывали с использованием встроенного программного обеспечения NIS-Elements BR 4.30 («Nikon Corporation», Япония). У каждого петуха просматривали не менее 100 сперматозоидов. Состояние акросом изучали на фиксированных препаратах сперматозоидов с помощью набора для дифференциального окрашивания Диахим-Дифф-Квик (НПФ «Абрис+», Россия).
Критериями оценки оплодотворяющей способности семени служили оплодотворяемость яиц и вывод молодняка.
Гистологические препараты семенников готовили по общепринятой методике (22). Образцы ткани фиксировали в растворе Буэна (пикриновая кислота:уксусная кислота:формалин в соотношении 15:1:5) в течение 48 ч. Препараты окрашивали гематоксилином и эозином. Для анализа отбирали только семенные канальцы, имеющие просвет и округлую форму (поперечный срез). Клетки сперматогенного ряда идентифицировали по морфологии (23). От каждого самца исследовали не менее 30 семенных канальцев. Изображения обрабатывали и анализировали с помощью пакета программ NIS-Elements («Nikon Corporation», Япония). Определяли диаметр семенных канальцев, количество сперматогенных клеток в них, клеточный состав популяции.
Полученные данные обрабатывали статистически в программе Microsoft Excel. В таблицах представлены средние арифметические значения ( M ) и ошибки средних ( ± SEM). Достоверность различий оценивали по t -критерию Стьюдента. Различия считали статистически значимыми при р < 0,05.
Результаты . Визуальная оценка образцов семени, полученных от трансгенных петухов и самцов контрольной группы, не выявила каких-либо значительных отклонений: цвет и запах эякулятов соответствовали установленным требованиям. Однако по показателям качества семени между экспериментальными группами имелись различия (табл. 1).
1. Показатели качества семени у трансгенных и нетрансгенных петухов ( Gallus gallus L.) породы Первомайская ( M± SEM, физиологический двор ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год)
|
Показатель |
Группа |
||
|
контроль |
I |
II |
|
|
Объем эякулята, мл |
0,31±0,11 |
0,25±0,09 |
0,19±0,08 |
|
Концентрация сперматозоидов, млрд/мл |
2,98±0,76 |
2,51±0,65 |
2,11±0,74 |
|
Подвижность сперматозоидов, % |
86±6 |
85±7 |
84±8 |
|
Доля сперматозоидов с аномальной морфологией, % |
9±3 |
12±4 |
11±3 |
П р и м еч а ни е. Описание групп см. в разделе «Методика».
У трансгенных петухов наблюдалась тенденция к снижению объема эякулята и концентрации сперматозоидов по сравнению с контролем: в I группе — соответственно на 19 и 15 %, во II группе — 38 и 29 %. Кроме того, у трансгенных петухов сперматозоиды были менее подвижными, однако в этом случае различия оказались менее существенными и не превышали 2 %.
Наряду с уменьшением объема эякулята и концентрации сперматозоидов в опытных группах возрастала доля сперматозоидов с аномальной морфологией. Различия с контролем по этому показателю составили 33 % в I группе и 22 % — во II группе. Анализ процентного соотношения сперматозоидов с анормальной морфологией разных участков (головка, средняя часть и жгутик) показал, что наиболее частыми были нарушения в области жгутика (рис.). В контрольной группе этот показатель составил 4 %, в опытных — 5 %. По сравнению с ним доля сперматозоидов с анормальной морфологией головки и средней части во всех эксперимен- тальных группах была ниже на 1-2 %.
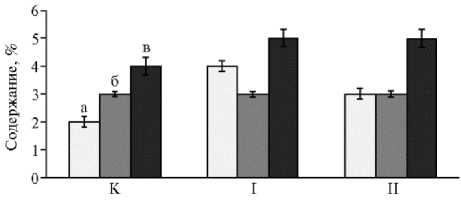
Доля сперматозоидов с анормальной морфологией головки (а) , средней части (б) и жгутика (в) в эякулятах у трансгенных и нетрансгенных петухов ( Gallus gallus L.) породы Первомайская: К — контроль, I и II — опытные группы (физиологический двор ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год). Описание групп см. в разделе «Методика».
Мы также установили различия между экспериментальными группами по морфометрическим показателям сперматозоидов (табл. 2). У трансгенных петухов из I группы наблюдалось увеличение площади головки на 27 % по сравнению с контролем (р < 0,01), из II группы — на 6 %. Кроме того, несколько уменьшалась длина жгутика и, как следствие, общая длина сперма- тозоидов (до 2 %). Размеры акросом у трансгенных особей в I группе уменьшались по сравнению с контролем на 33 %, во II группе — на 25 %
(р < 0,05). Следует, однако, отметить, что эти морфометрические измене- ния не оказывали значительного влияния на сохранность акросом: у всех петухов она была практически одинаковой и составила у трансгенных — 98,9 %, у нетрансгенной — 99,0 %.
2. Морфометрические показатели сперматозоидов в эякулятах у трансгенных и нетрансгенных петухов ( Gallus gallus L.) породы Первомайская ( M± SEM, физиологический двор ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год)
|
Группа |
Площадь, мкм2 |
Длина, мкм |
||
|
головка |
акросома |
общая |
жгутик |
|
|
Контроль |
11,9±0,6 |
1,2±0,1 |
81±3 |
68±3 |
|
I |
15,2±0,7** |
0,8±0,1* |
79±1 |
67±2 |
|
II |
12,7±0,5 |
0,9±0,1* |
80±1 |
66±3 |
П р и м е ч а н и е. Описание групп см. в разделе «Методика».
*, ** Различия с контролем статистически значимы соответственно при р ≤ 0,05 и р ≤ 0,01.
Оплодотворяющая способность семени от трансгенных петухов была ниже по сравнению с контролем (табл. 3). В I опытной группе процент оплодотворенных яиц и полученных цыплят был соответственно на 4 и 15 % ниже аналогичных показателей, установленных для контрольной птицы. Во II опытной группе различия составили 6 и 10 % (р < 0,05).
3. Развитие эмбрионов и результативность получения цыплят от трансгенных и нетрансгенных петухов ( Gallus gallus L.) породы Первомайская ( M± SEM, физиологический двор ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год)
|
Группа |
Заложено яиц на инкубацию, шт. |
Из них, шт. (%) |
Развилось эмбрионов, % |
Получено цыплят, % |
|
|
не оплодотворено |
оплодотворено |
||||
|
Контроль |
50 |
3 (6) |
47 (94) |
90 |
85 |
|
I |
50 |
5 (10) |
45 (90) |
84 |
70 |
|
II |
55 |
7 (12) |
48 (88)* |
85 |
75 |
П р и м е ч а н и е. Описание групп см. в разделе «Методика». * Различия с контролем статистически значимы при р ≤ 0,05.
Сходные данные получены для трансгенных сельскохозяйственных животных, в частности коз и кроликов. У козлов с геном лактоферрина человека hLF описано снижение качества семени и его оплодотворяю- щей способности (различия до 13 % по сравнению с контрольной группой) (20, 24). У самцов кроликов с геном гормона роста быка bGH наблюдалось снижение либидо (21). В то же время у мышей, трансгенных по гену лактоферрина человека, репродуктивные показатели были в норме (25). У овец, несущих в геноме рекомбинантный ген химозина крупного рогатого скота, процент объягнившихся маток также соответствовал нормативным показателям (26).
Снижение воспроизводительных качеств у трансгенных петухов по сравнению с контролем было обусловлено ухудшением ряда показателей качества семени, в частности уменьшением объема эякулята, подвижности и концентрации спермиев (см. табл. 1). Снижение концентрации спермиев в эякулятах, полученных от трансгенных петухов, подтвердили гистологические исследования. Анализ гистоструктуры семенных канальцев выявил снижение числа сперматогенных клеток в семенных канальцах у трансгенных петухов по сравнению с контролем (табл. 4). Наиболее выраженные изменения относительно контроля по этому показателю отмечались у трансгенных петухов после трансплантации донорских спер-матогониев (II группа) — на 19 %. При этом у трансгенных петухов, полученных с использованием лентивирусного вектора (I группа), разница с контролем по числу сперматогенных клеток не превышала 2,5 %.
4. Содержание разных типов сперматогенных клеток в семенном канальце (шт.) у трансгенных и нетрансгенных петухов ( Gallus gallus L.) породы Первомайская ( M± SEM, физиологический двор ФНЦ ВИЖ им. Л.К. Эрнста, 2018 год)
|
Группа |
Всего |
Клетки Сертоли |
Сперматого-нии |
Сперматоциты 1-го и 2-го порядка |
Сперматиды |
Спермии |
|
Контроль |
1198±115 |
18±3 |
69±5 |
613±20 |
218±14 |
280±17 |
|
I |
1167±213 |
15±2 |
65±8 |
625±35 |
205±18 |
257±25 |
|
II |
960±88 |
17±3 |
58±11 |
526±31 |
158±25 |
201±14* |
П р и м еч а ни е. Описание групп см. в разделе «Методика».
* Различия с контролем статистически значимы при р ≤ 0,05.
Сравнительный анализ качества семени трансгенных петухов, полученных с помощью разных методических подходов, продемонстрировал, что трансгенные петухи из I группы превосходили трансгенных особей из II группы (в частности, по объему эякулята семени и концентрации спер-миев соответственно на 24 и 16 %). Оплодотворяющая способность семени у петухов, полученных с использованием лентивирусного вектора, также была выше аналогичного показателя у особей после трансплантации трансформированных донорских сперматогониев.
Таким образом, проведенные исследования показали, что интеграция трансгена сказывается на функциональном состоянии половых клеток у генетически модифицированных петухов: наблюдается снижение объема эякулята, концентрации и подвижности сперматозоидов, уменьшается количество сперматогенных клеток в семенных канальцах, ухудшается оплодотворяющая способность семени. В то же время отклонений в сохранности акросом у трансгенной птицы мы не обнаружили. Анализ семенников у трансгенных петухов и их нетрансгенных аналогов также не выявил значительных патологических нарушений в гистоструктуре.
Список литературы Воспроизводительные качества петухов с нормальным и модифицированным геномом
- Зиновьева Н.А., Волкова Н.А., Багиров В.А., Брем Г. Трансгенные сельскохозяйственные животные: современное состояние исследований и перспективы. Экологическая генетика, 2015, 13(2): 58-76.
- Scott B.B., Velho T.A., Sim S., Lois C. Applications of avian transgenesis. ILAR J., 2010, 51(4): 353-361.
- Brazolot C.L., Petitte J.N., Etches R.J., Verrinder Gibbins A.M. Efficient transfection of chicken cells by lipofection, and introduction of transfected blastodermal cells into the embryo. Mol. Reprod. Dev., 1991, 30(4): 304-312 ( ) DOI: 10.1002/mrd.1080300404
- Fraser R.A., Carsience R.S., Clark M.E., Etches R.J., Gibbins A.M. Efficient incorporation of transfected blastodermal cells into chimeric chicken embryos. Int. J. Dev. Biol., 1993, 37(3): 381-385.
- Chojnacka-Puchta L., Kasperczyk K., Płucienniczak G., Sawicka D., Bednarczyk M. Primordial germ cells (PGCs) as a tool for creating transgenic chickens. Pol. J. Vet. Sci., 2012, 15(1): 181-188 ( ) DOI: 10.2478/v10181-011-0132-6
- Macdonald J., Glover J.D., Taylor L., Sang H.M., McGrew M.J. Characterisation and germline transmission of cultured avian primordial germ cells. PLoS ONE, 2010, 5: e15518 ( )
- DOI: 10.1371/journal.pone.0015518
- Han J.Y. Germ cells and transgenesis in chickens. Comparative Immunology, Microbiology and Infectious Diseases, 2009, 32(2): 61-80 ( )
- DOI: 10.1016/j.cimid.2007.11.010
- Scott В.B., Lois C. Generation of tissue-specific transgenic birds with lentiviral vectors. PNAS USA, 2005, 102(45): 16443-16447 ( )
- DOI: 10.1073/pnas.0508437102
- Kalina J., Senigl F., Micáková A., Mucksová J., Blazková J., Yan H., Poplstein M., Hejnar J., Trefil P. Retrovirus-mediated in vitro gene transfer into chicken male germ line cells. Reproduction, 2007, 134(3): 445-453 ( )
- DOI: 10.1530/rep-06-0233
- Kuwana T., Kawashima T., Naito M., Yamashita H., Matsuzaki M., Takano T. Conservation of a threatened indigenous fowl (Kureko dori) using the germline chimeras transplanted from primordial germ cells. J. Poult. Sci., 2006, 43(1): 60-66 ( )
- DOI: 10.2141/jpsa.43.60
- Naito M., Harumi T., Kuwana T. Long term in vitro culture of chicken primordial germ cells isolated from embryonic blood and incorporation into germline of recipient embryo. J. Poult. Sci., 2010, 47(1): 57-64 ( )
- DOI: 10.2141/jpsa.009058
- Li B., Sun G., Sun H., Xu Q., Gao B., Zhou G., Zhau W., Wu X., Bao W., Yu F., Wang K., Chen G. Efficient generation of transgenic chickens using the SSCs in vivo and ex vivo transfection. Science in China Series C: Life Sciences, 2008, 51(8): 734-742 ( )
- DOI: 10.1007/s11427-008-0100-2
- Yu F., Ding L.J., Sun G.B., Sun P.X., He X.H., Ni L.G., Li B.C. Transgenic sperm produced by electrotransfection and allogeneic transplantation of chicken fetal spermatogonial stem cells. Mol. Reprod. Dev., 2010, 77: 340-347.
- Tyack S.G., Jenkins K.A., O’Neil T.E., Wise T.G., Morris K.R., Bruce M.P., McLeod S., Wade A.J., McKay J., Moore R.J., Schat K.A., Lowenthal J.W., Doran T.J. A new method for producing transgenic birds via direct in vivo transfection of primordial germ cells. Transgenic Res., 2013, 22(6): 1257-1264 ( )
- DOI: 10.1007/s11248-013-9727-2
- Min S., Qing S.Q., Hui Y.Y., Zhi F.D., Rong Q.Y., Feng X., Chun L.B. Generation of antiviral transgenic chicken using spermatogonial stem cell transfected in vivo. Afr. J. Biotechnol., 2011, 10(70): 15678-15683.
- Mozdziak P.E., Borwornpinyo S., McCoy D.W., Petitte J.N. Development of transgenic chickens expressing bacterial beta-galactosidase. Dev. Dyn., 2003, 226(3): 439-445 ( )
- DOI: 10.1002/dvdy.10234
- Byun S.J., Kim S.W., Kim K.W., Kim J.S., Hwang I.-S., Chung H.K., Kan I.S., Jeon I.-S., Chang W.-K., Park S.-B., Yoo J.G. Oviduct-specific enhanced green fluorescent protein expression in transgenic chickens. Bioscience, Biotechnology, and Biochemistry, 2011, 75(4): 646-649 ( )
- DOI: 10.1271/bbb.100721
- Lillico S.G., Sherman M.J., McGrew C.D., Robertson C.D., Smith J., Haslam C., Barnard P., Radcliffe P.A., Mitrophanous K.A., Elliot E.A. Oviduct-specific expression of two therapeutic proteins in transgenic hens. PNAS USA, 2007, 104(6): 1771-1776 ( )
- DOI: 10.1073/pnas.0610401104
- Kwon S.C., Choi J.W., Jang H.J., Shin S.S., Lee S.K., Park T.S., Choi I.Y., Lee G.S., Song G., Han J.Y. Production of biofunctional recombinant human interleukin 1 receptor antagonist (rhIL1RN) from transgenic quail egg white. Biol. Reprod., 2010, 82(6): 1057-1064 ( )
- DOI: 10.1095/biolreprod.109.081687
- Айбазов М.М., Мамонтова Т.В., Холмова Е.В. Воспроизводительные показатели трансгенных по гену лактоферрина коз. Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства, 2016, 2(9): 67-72.
- Козикова Л.В., Росохацкий С.И., Яковлев А.Ф., Медведев С.Ю. Фенотипические показатели трансгенных кроликов с генами соматотропной оси. Цитология, 2005, 47(9): 814-815.
- Микроскопическая техника/Под ред. Д.С. Саркизова, Ю.П. Перова. М., 1996.
- Жункейра Л.К., Карнейро Ж. Гистология/Пер. с англ. под ред. В.Л. Быкова. М., 2009.
- Айбазов М.М., Аксенова П.В. Лактоферрин человека от трансгенных коз. 1. Особенности физиологии репродукции молочных коз зааненской породы. Вестник ветеринарии, 2010, 3(54): 59-64.
- Дейкин А.В., Ермолкевич Т.Г., Гурский Я.Г., Краснов А.Н., Георгиева С.Г., Кузнецов С.Л., Деревянко В.Г., Новикова Н.И., Мурашев А.Н., Гольдман И.Л., Садчикова Е.Р. Состояние здоровья и воспроизводительная способность трансгенных мышей, продуцирующих с молоком рекомбинантный белок человека лактоферрин. Доклады Академии наук, 2009, 427(4): 545-548.
- Калмыков С.П. Воспроизводительные способности овец, трансгенных по рекомбинантному гену фермента химозина. Зоотехния, 2008, 5: 28-30.


