Воздействие бовгиалуронидазы азоксимера на бактериальные биопленки в эякуляте пациентов с хроническим простатитом
Автор: Брагина Е.Е., Спивак Л.Г., Газимиев М.А., Евдокимов М.С., Мхитарян О.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 3 т.16, 2023 года.
Бесплатный доступ
Введение. Применение молекулярно-биологических методов при анализе бактериального разнообразия (метатаксономика) секрета предстательной железы и эякулята для оценки мужской микробиоты позволило выявить его разнообразие при хроническом простатите. При этом многие штаммы уропатогенов, выявленные при хроническом простатите, проявляют способность к образованию биопленок, при этом нет общепринятых методов лечения биопленочных инфекций. Цель исследования. Изучить действие препарата бовгиалуронидаза азоксимер при хроническом простатите, которое может быть обусловлено ферментативным действием гиалуронидазы на матрикс бактериальных биопленок, что увеличивает биодоступность антибиотиков, приводя к переходу бактерий в планктонное состояние. Материал и методы. Проведено электронно-микроскопическое исследование эякулята 42 пациентов хроническим простатитом, из них 32 рандомно выбранных пациента получали комбинированное антибактериальное лечение (4-6 недель) совместно с бовгиалуронидазы азоксимером (12 недель) (группа I); 10 пациентов получали только антибактериальную терапию согласно клиническим рекомендациям (группа II). На ультратонких срезах подсчитывали количество бактериальных микроколоний и нейтрофильных лейкоцитов на 100 сперматозоидов.
Бактериальные биопленки, хронический простатит, лонгидаза
Короткий адрес: https://sciup.org/142240023
IDR: 142240023 | DOI: 10.29188/2222-8543-2023-16-3-87-92
Текст научной статьи Воздействие бовгиалуронидазы азоксимера на бактериальные биопленки в эякуляте пациентов с хроническим простатитом
Хронический простатит является частым и полиэ-тиологичным заболеванием.К числу причин простатита относят в том числе и инфекции,преимущест-венно бактериальные [1]. Хронический бактериальный простатит является причиной 5-10% всех случаев простатита, из которых не менее 30% связаны с рецидивирующими инфекциями мочевыводящих путей [2].
Применение молекулярно-биологических методов при анализе бактериального разнообразия (метатаксо-номика) секрета предстательной железы и эякулята для оценки мужской микробиоты позволило выявить его разнообразие при хроническом простатите [3, 4]. Изучение эякулята, а не секрета предстательной железы при хроническом простатите дает возможность оценить состояние не только предстательной железы, но и других органов репродуктивной системы (семенных пузырьков, эпидидимиса и др.). Для диагностики хронического бактериального простатита метод изучения эякулята обладает более высокой чувствительностью, чем экспрессия простатического секрета [5]. Кроме того, получение эякулята, а не секрета предстательной железы достаточно практично и дает возможность пациенту собрать материал в более комфортных условиях, не прибегая к помощи медицинского персонала.
С одной стороны, ряд исследователей считает присутствие бактерий в сперме обычным явлением, в том числе и у здоровых людей [6, 7]. Семенная плазма имеет специфическую микробиоту, и возможно постулировать, что присутствие специфической бактериальной среды может быть не вредным,но естественным для нормального функционирования сперматозоидов [8, 9]. С другой стороны, показано отличие бактериального состава спермы при хроническом простатите и у здоровых людей [10, 11]. При этом многие штаммы уро- патогенов, выявленных при хроническом простатите, мультирезистентны и проявляют способность к образованию биопленок [12].
Бактериальные биопленки – комплексные поли-микробные структуры, состоящие из бактериальных клеток, заключенных во внеклеточный полимерный матрикс, продуцируемый этими клетками [13]. Внеклеточный матрикс состоит из многих биомолекул, включает углеводы, белки и нуклеиновые кислоты. Внеклеточный матрикс биопленок выполняет скелетную функцию, поддерживая структуру биопленки и, вероятно, помогает бактериям сопротивляться антибактериальному действию. Бактерии в структуре биопленки умеют избегать эрадикации и до 1000 раз более устойчивы к антибиотикотерапии, чем их планктонные аналоги [14].
В настоящее время нет общепринятых методов лечения биопленочных инфекций [15]. Так как чувствительность к антибиотикам бактерий в составе биопленок значительно ниже, чем в планктонном состоянии, разрабатываются методы терапии, позволяющие разрушать целостность биопленок [16]. Идет интенсивная работа над синтезом и оценкой небольших молекул, разрушающих бактериальные биопленки [17–20].
Один из подходов к терапии заболеваний, связанных с биопленками – использование ферментных препаратов. Препарат бовгиалуронидаза азоксимер представляет собой пролонгированную термостабильную форму гиалуронидазы, которая обладает мукоцидным действием, разрушая гиалуроновую кислоту фиброзной ткани при воспалительных заболеваниях, сопровождающихся фиброзом [21]. Есть публикации о положительных результатах применения лонгидазы при хроническом простатите [22].
Цель исследования: изучить действие препарата бовгиалуронидаза азоксимер при хроническом проста- экспериментальная и клиническая урология

тите, которое может быть обусловлено ферментативным действием гиалуронидазы на матрикс бактериальных биопленок, что увеличивает биодоступность антибиотиков, приводя к переходу бактерий в планктонное состояние.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено электронно-микроскопическое исследование эякулята 42 пациентов хроническим простатитом, из них 32 рандомно выбранных пациента получали комбинированное антибактериальное лечение (4-6 недель) совместно с бовгиалуронидазы азоксимером (12 недель) (группа I), 10 пациентов получали только антибактериальную терапию согласно клиническим рекомендациям (группа II).
Электронно-микроскопическое исследование эякулята проводили до начала лечения и через 3 месяца после начала терапии.
Для проведения электронно-микроскопического исследования эякулят разводили изотоническим раствором хлористого натрия в 5-8 раз, добавляли 0,1 мл фиксатора (2,5% раствор глютарового альдегида на 0,1М какодилатном буфере, рН 7,2) и центрифугировали 15 мин при 3000 об/мин. К осадку добавляли 2 мл фиксатора и инкубировали в течение 2-24 час при 4оС. Осадок дофиксировали 1% раствором осмиевой кислоты, обезвоживали в этиловом спирте возрастающей концентрации и заливали в эпонаралдитовую смесь. Ультратонкие срезы получали на ультрамикротоме «UltraCut 111», окрашивали цитратом свинца и изучали в электронном микроскопе «JEM 100S» при увеличении х5000 (общий просмотр) и х16000–х18000 (исследование органоидов).
На ультратонких срезах подсчитывали количество бактериальных микроколоний и нейтрофильных лейкоцитов на 100 сперматозоидов.
РЕЗУЛЬТАТЫ
Бактериальные микроколонии были обнаружены в сперме 24 пациентов группы I и 6 пациентов группы II.
В процессе лечения 24 пациентов I группы, имеющих бактериальные микроколонии, у 12 (50%) их количество уменьшилось, а у 9 (37,5%) – не обнаруживались, у 3 (12,5%) – количество колоний не изменилось, из 6 больных II группы такие же изменения отмечены у 2 (33,3%), 1 (16,6%) и 3 (50%) больных соответственно. Снижение количества нейтрофилов отмечено у 22 (68,7%) больных I группы и 3 (30%) пациентов -II группы группы (табл. 1, 2).
В процессе лечения у большинства пациентов группы I наблюдали количественные изменения содержания бактериальных колоний и нейтрофильных лейкоцитов (расчет на 100 сперматозоидов). Среднее количество бактериальных микроколоний до лечения было 11,4 в группе I и 10,3 – в группе II. После лечения среднее количество микроколоний было 4,1 в группе I и 6,2 – в группе II. Среднее количество нейтрофильных лейкоцитов до лечения было 14,8 в группе I и 16,0 в группе II. После лечения среднее количество нейтрофильных лейкоцитов было 4,7 в группе I и 14,2 в группе II.
Существенные изменения выявлены в морфологии бактериальных колоний.До лечения бактериальные микроколонии можно охарактеризовать как биопленки по характерным признакам: наличие гетерогенных микроорганизмов в одной микроколонии,
Таблица1. Количество пациентов в I и II группах, имеющих бактериальные микроколонии в сперме, до и после терапии
Table 1. The number of patients in groups I and II with bacterial microcolonies in semen before and after therapy
|
Группа Group |
Количество пациентов в группе Quantity patients in the group |
Количество больных, имеющих колонии до лечения Number of patients with colonies before treatment |
Количество больных, у которых количество колоний уменьшилось The number of patients in whom the number of colonies decreased |
Количество больных, у которых колонии после лечения не обнаружены The number of patients in whom no colonies were found after treatment |
Количество больных, у которых количество колоний не изменилось The number of patients in whom the number of colonies did not change |
Количество больных, у которых колонии до и после лечения не обнаружены The number of patients in whom colonies were not found before and after treatment |
|
Группа I Group I |
32 |
24 |
12 |
9 |
3 |
8 |
|
Группа II Group II |
10 |
6 |
2 |
1 |
3 |
4 |
Таблица 2. Количество пациентов I и II групп, у которых изменилось количество нейтрофильных лейкоцитов в сперме после терапии
Table 2. The number of patients of groups I and II in which the number of neutrophilic leukocytes in semen has changed
|
Группа Group |
Количество пациентов в группе Quantity patients in the group |
Количество больных, у которых количество нейтрофилов уменьшилось The number of patients in whom the number of neutrophils decreased |
Количество больных, у которых количество нейтрофилов не изменилось The number of patients in whom the number of neutrophils did not change |
Количество пациентов, у которых нейтрофилы до и после лечения не обнаружены The number of patients in whom neutrophils were not detected before and after treatment |
|
Группа I Group I |
32 |
22 |
5 |
5 |
|
Группа II Group II |
10 |
3 |
6 |
1 |

наличие волокнистого матрикса, в который погружены бактерии.
На рис.1 представлены грамотрицательные бактерии, заключенные в волокнистый матрикс; на рис. 2 волокнистый матрикс окружает грамположительные и грамотрицательные бактерии. После терапии в группе I выявляются лежащие отдельно единичные бактерии (планктонное состояние) (рис.3), в ряде случаев обна-
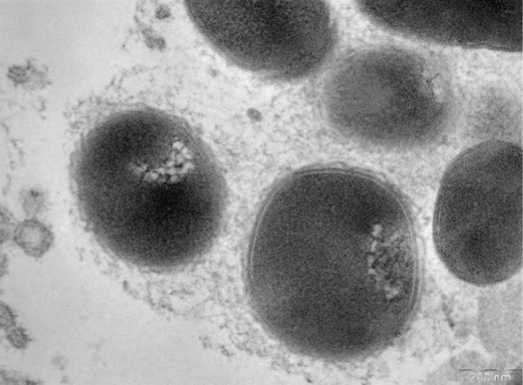
Рис.1. Грамотрицательные бактерии, заключенные в волокнистый матрикс, формируют биопленку в эякуляте (пациент группы I, до лечения)
Fig.1. Gram-negative bacteria, enclosed in a fibrous matrix, form a biofilm in the ejaculate (group I patient, before treatment)
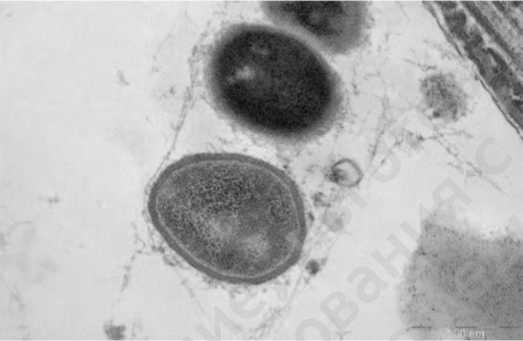
Рис.2. Грамположительные и грамотрицательные бактерии, заключенные в волокнистый матрикс, формируют биопленку в эякуляте (пациент группы I, до лечения)
Fig.2. Gram-positive and gram-negative bacteria, enclosed in a fibrous matrix, form a biofilm in the ejaculate (group I patient, before treatment)
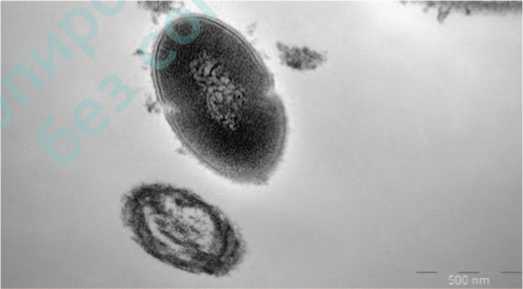
Рис.3. Грамотрицательная бактерия в планктонном состоянии. Матрикс вокруг бактриии отсутствует
Fig.3. Gram-negative bacterium in the planktonic state. There is no matrix around the bactria. Group 1 patient after treatment
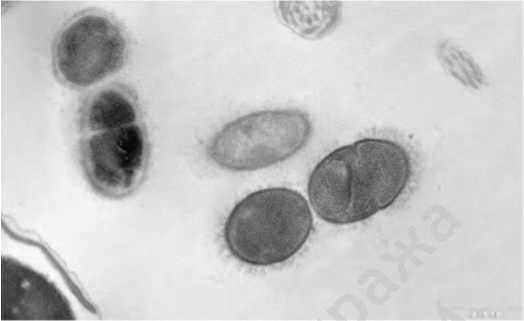
Рис.4. Грамположительные бактерии с поврежденной клеточной стенкой. Пациент группы I после лечения
Fig.4. Gram-positive bacteria with damaged cell walls. Group I patient after treatment руживается повреждение клеточной стенки бактерий (рис. 4). В группе II также выявлены количественные изменения содержания микроколоний и нейтрофильных лейкоцитов, однако морфология микроколоний в группе II не меняется.
ОБСУЖДЕНИЕ
Для визуализации биопленок чаще всего используется сканирующая электронная микроскопия, позволяющая определять трехмерную структуру биопленки [23, 24]. Этот метод позволяет исследовать топографию и плотность биопленки на поверхности образца.Од-нако трансмиссионная электронная микроскопия, несмотря на сложный процесс пробоподготовки, считается золотым стандартом, позволяющим оценить внутреннюю структуру биопленки и наблюдать изменения матрикса в процессе терапии [25, 26]. Это важный момент, так как именно наличие внеклеточного полимерного матрикса в биопленках затрудняет действие противомикробных препаратов и делает бактерии устойчивыми к антибиотикам и другим лекарственным средствам [27].
Интересные результаты были получены при добавлении Лонгидазы® к стандартной антибактериальной терапии в лечении хронического простатита. Отмечалось снижение клинического индекса хронического простатита, а также уменьшение размера очагов плотности, фиброза в тканях предстательной железы, обогащение сосудистого рисунка, повышение скорости потока крови в сосудах [28, 29]. В настоящей работе мы показали изменение количества активных нейтрофилов в эякуляте, что является показателем уменьшения выраженности воспалительного процесса. В контрольной группе (антибиотики без добавления лонгидазы) содержание нейтрофильных лейкоцитов в эякуляте практически не изменилось.
Ключевым аспектом данного исследования является оценка эффективности бовгиалуронидазы азоксимера в отношении возможности разрушения био- экспериментальная и клиническая урология
пленок, формирующих защиту микроколоний различных бактерий в эякуляте и способствующих устойчивости микроорганизмов к антимикробной терапии. Ранее подобные эффекты Лонгидазы® были изучены исключительно in vitro [30]. Наше исследование является первым, доказывающим этот эффект in vivo. Благодаря применению электронной микроскопии были обнаружены различия в эякуляте пациентов до и после лечения. Данные различия отмечались именно в группе пациентов, получавших бовгиалуронидазу азоксимер: продемонстрировано уменьшение количества колоний микробов, окруженных матриксом различной природы, чаще мукополисахаридной (биопленки), либо изменения морфологии самих микроколоний. Исчезновение межклеточного матрикса и переход бактерий в планк- тонную форму существования является показателем разрушения бактериальных биопленок. В контрольной группе подобных изменений не происходило.
ЗАКЛЮЧЕНИЕ
Применение трансмиссионной электронной микроскопии при исследовании эякулята пациентов с хроническим простатитом позволяет выявить особенности структуры бактериальных биопленок в процессе терапии. В настоящей работе показали, что при комбинированной антибактериальной терапии совместно с бовгиалуронидазы азоксимером изменяется матрикс биопленок и происходит переход бактерий в планктонную форму.
Список литературы Воздействие бовгиалуронидазы азоксимера на бактериальные биопленки в эякуляте пациентов с хроническим простатитом
- Ejike CE, Ezeanyika LU. Prevalence of chronic prostatitis symptoms in a randomly surveyed adult population of urban-community-dwelling Nigerian males. Int J Urol 2008;15(4):340–3. https://doi.org/10.1111/j.1442-2042.2008.02003.x.
- Shang Y, Liu C, Cui D, Han G, Yi S. The effect of chronic bacterial prostatitis on semen quality in adult men: a meta-analysis of case-control studies. Sci Rep 2014;4(1):7233. https://doi.org/10.1038/srep07233.
- Коган М.И., Набока Ю.Л., Исмаилов Р.С. Микробиота секрета простаты: сравнительный анализ хронического простатита категорий II и IIIA. Урология 2020;(2):16-22. https://doi.org/https://dx.doi.org/10.18565/urology.2020.2.16-22. [Kogan M.I., Naboka Y.L., Ismailov R.S. Prostatic secretion microbiota: a comparative analysis of the chronical prostatitis II and IIIa category. Urologiya = Urologiia 2020;(2):16-22. (In Russian)].
- Suárez JP, Cardona Maya WD. Microbiota, prostatitis, and fertility: bacterial diversity as a possible health ally. Adv Urol 2021:1007366. https://doi.org/10.1155/2021/1007366.
- Budía A, Luis Palmero J, Broseta E, Tejadillos S, Benedicto A, Queipo JA, et al. Value of semen culture in the diagnosis of chronic bacterial prostatitis: a simplified method. Scand J Urol Nephrol 2006;40(4):326–331. https://doi.org/10.1080/00365590600748247.
- Cottell E, Harrison RF, McCaffrey M, Walsh T, Mallon E, C Barry-Kinsella. Are seminal fluid microorganisms of significance or merely contaminants? Fertil Steril 2000;74(3):465–70. https://doi.org/10.1016/s0015-0282(00)00709-3
- Rodin DM, Larone D, Goldstein M. Relationship between semen cultures, leukospermia, and semen analysis in men undergoing fertility evaluation. Fertil Steril 2003;79(Suppl 3):1555–8. https://doi.org/10.1016/s0015-0282(03)00340-6.
- Weng SL, Chiu CM, Lin FM, Huang WC, Liang C, Yang T, et al. Bacterial communities in semen from men of infertile couples: metagenomic sequencing reveals relationships of seminal microbiota to semen quality. PLoS One 2014;9:e110152. https://doi.org/10.1371/journal.pone.0110152. eCollection 2014.
- Mändar R, Punab M, Borovkova N, Lapp E, Kiiker R, Korrovits P, et al. Complementary seminovaginal microbiome in couples. Res Microbiol 2015;166:(5):440–7. https://doi.org/10.1016/j.resmic.2015.03.009.
- Delcaru C, Alexandru I, Podgoreanu P, Grosu M, Stavropoulos E, Chifiriuc MC, et al. Microbial biofilms in urinary tract infections and prostatitis: etiology, pathogenicity, and combating strategies. Pathogens 2016;5(4):65. https://doi.org/10.3390/pathogens5040065.
- Magri V, Boltri M, Cai T, Colombo R, Cuzzocrea S, De Visschere P, et al. Multidisciplinary approach to prostatitis. Arch Ital Urol Androl 2019;90(4):227-248. https://doi.org/10.4081/aiua.2018.4.227.
- Mazzoli S. Biofilms in chronic bacterial prostatitis (NIH-II) and in prostatic calcifications. FEMS Immunol Med Microbiol 2010;59(3):337-44. https://doi.org/10.1111/j.1574 695X.2010.00659.x.
- Flemming HC, Wingender J. The biofilm matrix. Nat Rev Microbiol 2010;8(9):623–33. https://doi.org/10.1038/nrmicro2415.
- Rather MA, Gupta K, Mandal M. Microbial biofilm: formation, architecture, antibiotic resistance, and control strategies. Braz J Microbiol 2021;52(4):1701-18. https://doi.org/10.1007/s42770-021-00624-x.
- Lundin PM, Fiser BL, Blackledge MS, Pickett HL, Copeland AL. Functionalized self-assembled monolayers: versatile strategies to combat bacterial biofilm formation. Pharmaceutics 2022;14(8):1613. https://doi.org/10.3390/pharmaceutics14081613.
- Stewart PS, Costerton JW Antibiotic resistance of bacteria in bioflms. Lancet 2001;358(9276):135–138. https://doi.org/10.1016/S0140-6736(01)05321-1).
- Roy R, Tiwari M, Donelli G, Tiwari V. Strategies for combating bacterial biofilms: A focus on anti-biofilm agents and their mechanisms of action. Virulence 2018;9:522–554. https://doi.org/10.1080/21505594.2017.1313372.
- Parrino B, Schillaci D, Carnevale I, Giovannetti E, Diana P, Cirrincione G, et al. Synthetic small molecules as anti-biofilm agents in the struggle against antibiotic resistance. Eur J Med Chem 2019;161:154–178. https://doi.org/10.1016/j.ejmech.2018.10.036.
- Hemmati F, Rezaee MA, Ebrahimzadeh S, Yousefi L, Nouri R, Kafil HS, et al. Novel strategies to combat bacterial biofilms. Mol Biotechnol 2021;63(7):569–86. https://doi.org/10.1007/s12033-021-00325-8.
- Ghosh A, Jayaraman N, Chatterji D. Small-molecule inhibition of bacterial biofilm. ACS Omega 2020;5(7):3108–15. https://doi.org/10.1021/acsomega.9b03695.
- Бутов Ю.С., Васенова В.Ю., Возможности применения и терапевтическая эффективность Лонгидазы при патологиях соединительной ткани. Эффективная фармакотерапия Дерматология и Дерматокосметология 2012;(1):40-43. [Butov Yu.S., Vasenova V.Yu., Possibilities of application and therapeutic efficacy of Longidase in connective tissue pathologies. Effektivnaya farmakoterapiya Dermatologiya i Dermatokosmetologiya = Effective pharmacotherapy Dermatology and Dermatocosmetology 2012;(1):40-43. (In Russdian)].
- Зайцев А.В., Ходырева Л.А., Дударева А.А., Пушкарь Д.Ю. Современный взгляд на применение ферментных препаратов у больных хроническим простатитом. Клиническая дерматология и венерология 2016;(3): 53-
- https://doi.org/10.17116/klinderma201615353-60. [Zaitsev A.V., Khodyreva L.A., Dudareva A.A., Pushkar D.Yu. The use of enzymatic drugs in patients with chronic prostatitis: the current view. Klinicheskaya Dermatologiya i Venerologiya = Russian Journal of Clinical Dermatology and Venereology 2016;(3): 53-60. (In Russian).
- Bergmans L, Moisiadis P, Van Meerbeek P, Quirynen M, Lambrechts P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J 2005;38(11):775–88. https://doi.org/10.1111/j.1365-2591.2005.00999.x.
- Hannig C, Follo M, Hellwig E, Al-Ahmad A. Visualization of adherent microorganisms using diferent techniques. J Med Microbiol 2010;59(Pt 1):1–7. https://doi.org/10.1099/jmm.0.015420-0.
- Grin I, Schwarz H, Linke D. Electron microscopy techniques to study bacterial adhesion. Adv Exp Med Biol 2011;715:257-69. https://doi.org/10.1007/978-94-007-0940-9_16.
- Keleş, A., Keskin, C., Kalkan, M., Yakupoğulları, Y., Gül, M., Aydemir, H., et al. Visualization and characterization of Enterococcus faecalis biofilm structure in bovine dentin using 2D and 3D microscopic techniques. Arch Microbiol 2020; 203(1):269–277. https://doi.org/10.1007/s00203-020-02031-6).
- Gupta P, Sarkar S, Das B, Bhattacharjee S, Tribedi P. Biofilm, pathogenesis and prevention—a journey to break the wall. Arch Microbiol 2016;198(1):1-15. https://doi.org/10.1007/s00203-015-1148-6.
- Авдошин В.П., Андрюхин М.И., Михайликов Т.Г. Опыт применения ферментной терапии (Лонгидаза 3000 МЕ, ректальные суппозитории) в комплексном лечении хронического простатита. Урология 2008;(6):55-61. [Avdoshin V.P., Andryukhin M.I., Mikhailikov T.G. Magneto-laser and enzyme therapy in combined treatment of patients with chronic bacterial prostatitis. Urologiya = Urologiia 2008;(6):55-61. (In Russian)].
- Кульчавеня Е.В., Швецова О.П., Бреусов А.А. Обоснование назначения и эффективность препарата Лонгидаза у больных хроническим простаттом. Урология 2018;(4):64-71 https://doi.org/https://dx.doi.org/10.18565/urology.2018.4:64-71 [Kulchavenya E.V., Shvetsova O.P., Breusov A.A. Rationale of use and effectiveness of longidaza in patients with chronic prostatis. Urologiya = Urologiia 2018;(4):64-71. (In Russian)].
- Gatina A, Trizna E, Kolesnikova A, Baidamshina D, Gorshkova A, Drucker V, et al. The Bovhyaluronidase Azoximer (Longidaza®) Disrupts Candida albicans and Candida albicans-Bacterial Mixed Biofilms and Increases the Efficacy of Antifungals. Medicina (Kaunas) 2022;58(12):1710. https://doi.org/10.3390/medicina58121710.


