Возможность использования показателей радиоиндуцированного апоптоза лимфоцитов периферической крови для расчета коэффициента индивидуальной радиочувствительности
Автор: Кулинич Т.М., Сотников В.М., Шишкин А.М., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Радиобиология
Статья в выпуске: 2 т.20, 2020 года.
Бесплатный доступ
Поиск маркеров, отражающих индивидуальную радиочувствительность человека, является одной из основных задач радиобиологии. При проведении лучевой терапииопределение параметров индивидуальной радиочувствительности имеет особо важное значение, но, в настоящее время, не существует клинических показателей, способных оценить данный показатель. Целью проведенного исследования являлось определение коэффициента индивидуальной радиочувствительности на основе уровня радиоиндуированного апоптоза лимфоцитов периферической крови in vitro. С помощью метода проточной цитофлуориметрии был оценен апоптоз лимфоцитов, облученных in vitro в дозах от 0 до 4 Гр, и, на основании полученных значений, вычислен коэффициент, отражающий индивидуальную радиочувствительность. Показано, что данный коэффициент имеет отличия между группами здоровых доноров и пациентов с неходжкинскими лимфомами, а также коррелирует с последующим ответом на химио- лучевую терапию в группе пациентов.
Индивидуальная радиочувствительность, прогноз лучевой терапии, апоптоз
Короткий адрес: https://sciup.org/149132139
IDR: 149132139
Текст научной статьи Возможность использования показателей радиоиндуцированного апоптоза лимфоцитов периферической крови для расчета коэффициента индивидуальной радиочувствительности
Оценка параметров индивидуальной радиочувствительности и поиск маркеров, отражающих данную характеристику, на протяжении многих десятилетий и до настоящего времени является одной из центральных проблем радиобиологии. Известно, что радиочувствительность (РЧ) клеток во многом определяется системой репарации ДНК, и, в настоящее время, определены основные молекулярные механизмы, ответственные за эти процессы [9]. На текущий момент предложены разные показатели радиочувствительности [2], однако, универсального и общепринятого метода до настоящего времени не разработано [1]. Особое значение эта проблема имеет в клинической практике при оценке повреждающего воздействия ионизирующего излучения в процессе формирования программ лучевой терапии [4].
Лучевая терапия является стандартным методом лечения различных видов онкологических заболеваний и широко применяется в клинической практике [5]. В настоящее время развитие лучевой терапии позволило внедрить, кроме традиционной лучевой гамма-терапии, методы, основанные на ретгеновском, ионном и протонном излучении, широко используются методы брахитерапии, лучевая терапия в сочетании с компьютерной томографией позволяет обеспечить высокую прецизионность процесса облучения опухоли. Однако, большинство программ лучевой терапии разрабатываются исключительно на основе морфологического типа и локализации опухоли, что нередко приводит к разной клинической эффективности, когда индивидуальные генетические и/или фенотипические особенности в радиочувствительности приводят к различным ответам на лечение среди пациентов, получающих одну и ту же дозу облучения [8]. Одной из причин таких отличий может быть отличие в индивидуальной радиочувствительности как опухоли, так и здоровых тканей пациента. В настоящее время предпринимаются попытки определения индивидуальной радиочувствительности на основе оценки различных молекулярно-генетических показателей опухоли и здоровых тканей пациента. Например, выявлено, что некоторые варианты гена АТМ связаны с дифференциальной гиперчувствительностью к радиационному воздействию, также разработаны экспрессионные панели, включающие гены регуляторов апоптоза, клеточного цикла и репарации ДНК, способные, по данным авторов, оценивать индивидуальную РЧ пациентов [10, 11]. Эффективность модели прогнозирования на основе оценки РЧ по экспрессионным профилям подтверждена при лечении рака прямой кишки, рака пищевода и рака молочной железы, однако данный метод оценки РЧ не получил широкого распространения и не вошел в стандарты лечения [6, 8]. Поэтому разработка эффективного и технологичного метода оценки индивидуальной радиочувствительности остается актуальной задачей.
Мы предположили, что анализ устойчивости лимфоцитов периферической крови к воздействию ионизирующего издучения (ИИ) может являться показателем, отражающим индивидуальную РЧ [7]. Клетки крови являются наиболее доступным биоматериалом для исследования, в частности, лимфоциты периферической крови, которые используются для оценки степени радиационного воздействия на организм с применением цитогенетических и других методов [3, 9].
Целью данной работы было определение коэффициента индивидуальной радиочувствительности на основе уровня радиоиндуированного апоптоза лимфоцитов периферической крови in vitro.
Материалы и методы
Исследование проведено на лимфоцитах, выделенных из периферической крови 20 пациентов больных неходжкинскими лимфомами (НХЛ) и 16 здоровых доноров. Соотношение мужчин и женщин для обеих групп 1:4. Группы не отличались по возрасту, средний возраст 52 года (от 21 до 64 лет). Больные НХЛ на момент взятия крови никакого лечения не получали. Всем пациентам, больным НХЛ, в последующем было проведено комбинированное лечение, включавшее в себя курс полиохимиотерапии и лучевую терапию.
Лимфоциты были выделены методом центрифугирования в градиете плотности на фиколле (плотность 1,077 г/мл). После получения мононуклеарной фракции, клетки инкубировались в условиях 37 °С при 5% СО 2 . Облучение лимфоцитов проводилось однократно на гамма-терапевтической установке «Рокус-АМ», дозы облучения составили 1 Гр, 2 Гр, 3 Гр и 4 Гр.
С помощью метода проточной цитофлуорометрии (Cytomix FC 500 (Beckman Coulter, США)) был проведен анализ апоптоза и некроза облученных лимфоцитов, в качестве контроля использовали образцы не подвергшиеся воздействию гамма-излучения. Для оценки уровней апоптоза и некроза была использована окраска аннексин V и пропидий йодид (FITC Annexin V Apoptosis Detection Kit I (BD Pharmingen™, США)), подготовка образцов проводилась согласно методике производителя. Анализ был проведен через 24 и 48 часов после воздействия ИИ.
Анализ и статистическая обработка результатов проведены с помощью стандартных программ Excel 2016 и Statistic 10.
Результаты
В ходе исследования был проведен анализ уровней апоптоза и количества жизнеспособных (доля выживших после облучения) лимфоцитов после воздействия на них гамма-излучения в дозах от 1 до 4 Гр и времени после облучения 24 и 48 часов. В группе здоровых доноров в образцах, не подвергавшихся воздействию гамма-излучения, было обнаружено, что уровень спонтанного апоптоза в среднем составил 7,96% (от 0,86% до 12,65%). В группе пациентов с НХЛ уровень спонтанного апоптоза колебался в пределах от 1,28% до 22,48% и составил в среднем 7,79%. Отличия недостоверны (p=0,274). Уровень спонтанного апоптоза во всех пробах увеличивался пропорционально времени инкубации, так, в группе здоровых доноров через 24 часа инкубации уровень спонтанного апоптоза составлял 14,08%, а через 48 часов – 24,88% (достоверность отличий составила р=0,001). В группе больных НХЛ уровень спонтанного апоптоза составил 15,48% и 40,09% через 24 и 48 часов, соответственно (р=0,0005).
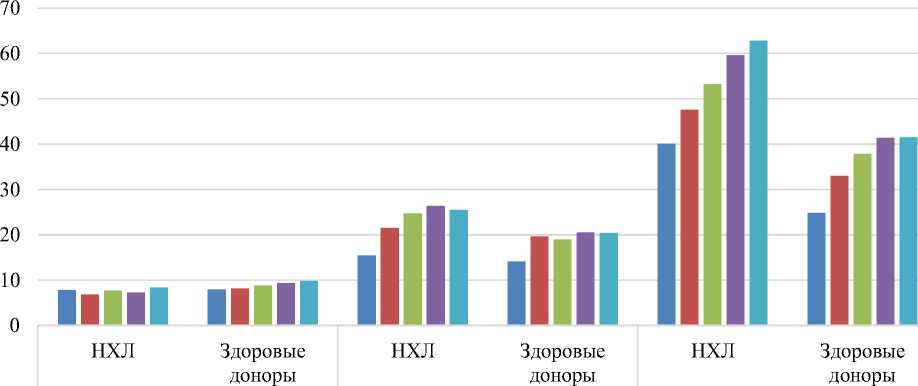
Доля апоптотических лимфоцитов достоверно увеличивалась пропорционально дозе облучения как в группе здоровых доноров (р=0,02), так и в группе больных НХЛ (р=0,004). Зависимость доли апоптотических клеток от дозы облучения и времени инкубации после облучения представлена на Рис. 1.
Зависимость доли апоптотических клеток от дозы облучения и времени инкубации
2 часа 24 часа 48 часов
■0■1■2■3■4
Рис. 1. Зависимость доли апоптотических клеток от дозы облучения (1 Гр, 2 Гр, 3 Гр и 4 Гр) и времени инкубации в группах больных НХЛ и здоровых доноров.
Как видно из рисунка, уровень апоптоза через 2 часа после облучения не зависит от доз в интервале от 0 Гр до 4 Гр и одинаков для двух исследованных групп, через 24 часа после облучения уровень апоптоза при увеличении дозы облучения достоверно возрастает, при этом в группе больных НХЛ уровень радиоиндуцированного апоптоза выше. Через 48 часов после облучения разница в уровне радиоиндуцированного апоптоза между группами увеличивается.
Проведенный нами анализ продемонстрировал, что количество апоптотических клеток не связано с такими индивидуальными показателями, как пол, возраст, показатели клинического (гематологического) анализа крови, субпопуляционный состав лимфоцитов. Анализ доли жизнеспособных клеток в образах для проанализированных групп показал, что их количество снижается, в завиимости от дозы облучения и времени инкубации (Рис. 2). В необлученных образцах количество живых клеток для группы здоровых доноров составило 93,3%±4,08% и для группы больных НХЛ 89,45%±4,21% при времени инкубации 2 часа. Через 48 часов после облучения в тех же образцах количество живых 50
клеток снизилось до 66,49%±3,89% в группе здоровых доноров и 40,83%±3,01% в группе больных НХЛ. При увеличении дозы облучения и времени инкубации количество живых клеток снижалось в обеих группах и достигало минимальных значений через 48 часов после облучения при дозе 4 Гр: 41,4% в группе здоровых доноров и 12,5% в группе пациентов с НХЛ.
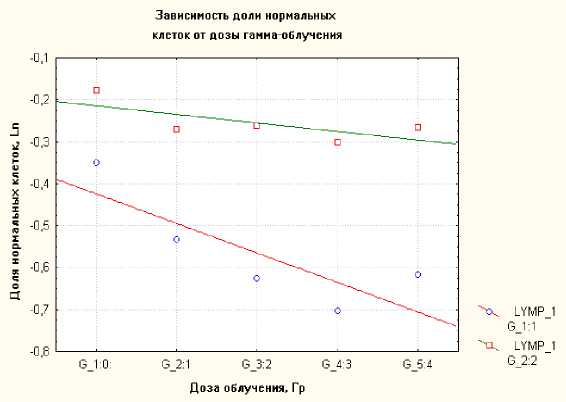
Рис. 2. Зависимость доли живых клеток от дозы облучения в полулогарифмическом масштабе: 1 – доля живых клеток в группе здоровых доноров (y = -0,0691x + 0,0439; R2 = 0,9516.); 2 – доля живых клеток в группе больных НХЛ (y = -0,05x + 0,0328; R2 = 0,966).
Мы исследовали характер математической зависимости доли выживших клеток от дозы облучения. Показано, что данные зависимости имеют вид экспоненциальных кривых в линейных координатах, а при переводе в полулогарифмические координаты данные зависимости имеют линейный характер (Рис. 2).
В зависимости от ответа на последующую комплексную химио-лучевую терапию группа больных НХЛ была разделена на две подгруппы: пациенты с положительным ответом на проводимую терапию (стабилизация процесса, достижение частичной ремиссии) и пациенты, не отвечающие на лечение.
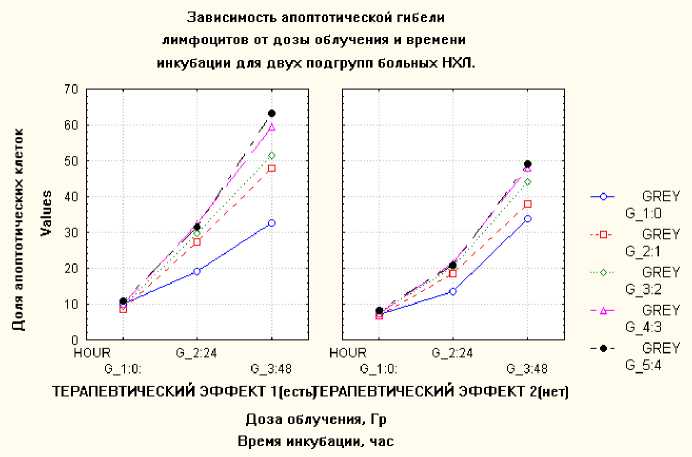
Рис. 3. Зависимость доли апоптотических клеток от дозы облучения и времени инкубации в двух подгруппах больных НХЛ: для пациентов с хорошим терапевтическим эффектом (слева) и с плохим терапевтическим эффектом (справа).
Эти две подгруппы, как показано на Рис. 3, имеют сравнимый уровень спонтанного апоптоза (p=0,146) и значимые отличия в уровне радиоиндуцированного апоптоза после 24 и 48 часов инкубации ( p=0,0008). Для подгруппы пациентов с хорошим терапевтическим эффектом уровень радиоиндуцированного апоптоза через 24 и 48 часов после облучения был значительно выше, чем для пациентов, не отвечающих на терапию. Через 24 часа после облучения средний уровень апоптоза в группе с хорошим терапевтическим эффектом составил 30,25%, в группе с низким терапевтическим эффектом – 20,72%; через 48 часов после облучения – 56,61% и 48,31% для двух подгрупп соответственно.
Анализ индивидуальных дозовых зависимостей (Рис. 4) доли выжившых лимфоцитов от дозы облучения подтвердил результаты, полученные при анализе групп (Рис. 2), согласно которым эта зависимость хорошо описывается в полулогарифмических координатах линейным уравнением регрессии: Ln(P) = a + bD,
Где D – доза облучения, Гр; P – доля жизнеспособных клеток после облучения в дозе, равной D; a и b – коэффициенты уравнения регрессии.
Вычисление коэффицинта радиочувствительности лимфоцитов.
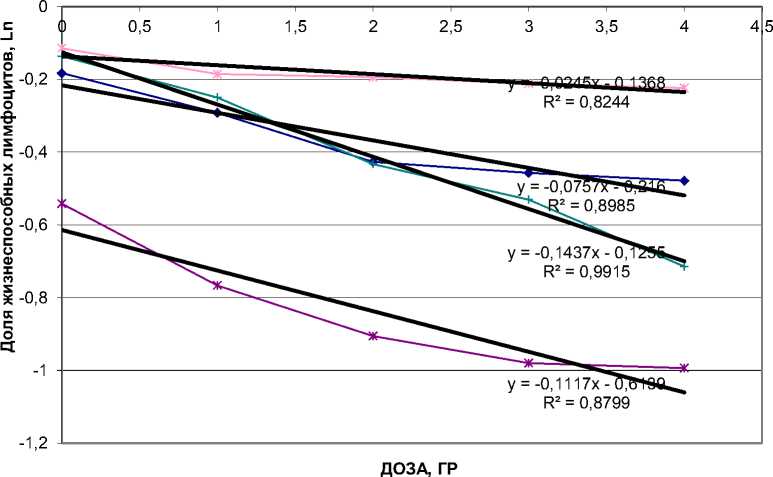
Рис. 4. Определение коэффициента радиочувствительности лимфоцитов.
Коэффициент a = Ln(P) при D = 0 позволяет определить долю нормальных клеток в необлученной популяции, а значение коэффициента b может отражать индивидуальную (т.е., для данного образца) радиационную «повреждаемость» лимфоцитов. Мы предположили, что именно коэффициент «b» может отражать индивидуальную радиочувствительность. Параметры линейной регрессии были вычислены для всех проанализированных образцов. Значение коэффициента b в группе здоровых доноров колебалось в диапазоне от 0,016 до -0,125. Среднее значение (± стандартная ошибка) составило -0,035 ±0,014. Для группы больных НХЛ значение коэффициента b колебалось в диапазоне от -0,003 до -0,166. Среднее значение (± стандартная ошибка) составило -0,063 ±0,012. Было показано, что коэффициент b (нами предложено называть коэффициентом радиочувствительности лимфоцитов (КР)) индивидуален для каждого 53
пациента и не зависит от пола и возраста пациента, количества лимфоцитов в крови и популяционного состава лимфоцитов.
В группе больных НХЛ КР коррелировал с ответом пациентов на проводимую терапию (коэффициент корреляции 0,6693, р=0,006). При сравнении двух подгрупп больных НХЛ более высокие значения КР были получены для подгруппы пациентов с хорошим ответом на проводимое лечение: среднее значение (-0,0839 ± 0,0132); у пациентов со слабым терапевтическим эффектом КР составил (-0,0268 ± 0,0092) (Рис. 5).
|
Значения коэффициента радиочувствительности для двух подрупп НХЛ (1 - хороший терапевтический эффект, 2 - плохой терапевтический эффект) л |
|
|
0 0, л ЛЭ |
5 1 1,5 2 2,5 |
|
-0,02 |
|
|
Л Л/1 - |
|
|
-0,04 |
♦ 1 |
|
Л ЛА - |
♦ |
|
-0,06 |
|
|
л ле - |
♦ |
|
-0,08 |
|
|
Л 1 - |
ф ♦ Коэф. B |
|
-0,1 |
|
|
-0,12 |
|
|
-0,14 |
|
|
Л 1 А - |
|
|
-0,16 |
|
|
Л 1 2 - |
|
|
-0,18 |
|
Рис. 5. Значения коэффициента радиочувствительности в группах пациентов с НХЛ с разным ответом на проведенную химио-лучевую терапию, 1 – хороший терапевтический эффект, 2 – плохой терапевтический ответ.
Обсуждение результатов
Исследование радио-индуцированной гибели лимфоцитов периферической крови показало, что она имеет выраженный дозозависимый характер, а анализ этой зависимости позволил предложить коэффициент для оценки индивидуальной радиочувствительности. Нами было показано, что предложенный коэффициент достоверно различается у здоровых доноров и больных НХЛ , а также в группах НХЛ с хорошим эффектом от лучевой терапии и отсутствием такого эффекта. Вариабельность этого показателя была более выражена в группе больных НХЛ, т.е. лица с крайними значениями радиочувствительности в этой группе встречались чаще.
Нами установлено, что при НХЛ более низкие значения КР (-0,0268 ± 0,0092) в последующем коррелируют с низкой эффективностью химио-лучевой терапии. Возможно, это связано с нарушениями в распознавании и элиминации клеток с поврежденной ДНК, что способствует накоплению хромосомных аббераций и других генетических аномалий, приводящих к возникновению мутаций. При более высокие значениях КР (-0,0839 ± 0,0132) наблюдался положительный ответ на терапию. Таким образом, было показано, что КР, вычисленный на основании оценки уровня радиоиндуцированного апоптоза лимфоцитов периферической крови in vitro, может являться прогностическим маркером, способным предсказывать эффективность лучевой терапии у пациентов с НХЛ.
Список литературы Возможность использования показателей радиоиндуцированного апоптоза лимфоцитов периферической крови для расчета коэффициента индивидуальной радиочувствительности
- Васильев С.А., Лебедев И.Н. Цитогенетические и экспрессионые маркеры индивидуальной радиочувствительности человека. Медицинская генетика. 2018. Т. 17. № С. 3-8. DOI: 10.25557/2073-7998.2018.01.3-8.
- Кузьменко Е.В. Современные подходы к определению групповой и индивидуальной радиочувствительности организма. Ученые записки Таврического национального университета им. В. И. Вернадского. Серия «Биология, химия». 2011. Т. 24 (63). № 1. С. 109-122.
- Кулинич Т.М., Боженко В.К., Сергеев И.Е. и др. Изучение краткосрочных эффектов воздействия ионизирующего излучения на лимфоциты периферической крови больных неходжкинскими лимфомами in vitro. Вестник Российского университета дружбы народов. Серия: Медицина. 2005. № 1. С. 34-40.
- Любченко П.Н., Боженко В.К., Масленникова В.Г. Гематологические показатели у участников ликвидации последствий аварии на ЧАЭС. Лабораторное дело. 1991. № 8. С. 47.
- Малеева К.П., Каримов Н.А., Мулатов А.А. и др. Радиочувствительность опухолей и способы радиомодификации. Международный студенческий научный вестник (электронный научный журнал). 2018. № 2.
- Dadkhah E., Naseh H., Farshchian M., et al. A Cancer-Array Approach Elucidates the Immune Escape Mechanism and Defects in the DNA Repair System in Esophageal Squamous Cell Carcinoma. Arch Iran Med. 2013. V. 16. No. 8. P. 463-470.
- Pajic J., Rovcanin B., Kekic D., et al. The Influence of Redox Status on Inter-Individual Variability in the Response of Human Peripheral Blood Lymphocytes to Ionizing Radiation. Int J Radiat Biol. 2018. V. 94. No. 6. P. 569-575. doi:10.1080/09553002.2018.1466207.
- Riou O., Bourgier C., Brengues M., et al. Predictive Assays for Responses of Tumors and Normal Tissues in Radiation Oncology. Cancer Radiother. 2019. V. 23. No. 6-7. P. 666-673. doi: 10.1016/j.canrad.2019.07.152.
- Toprani S.M., Das B. Radio-adaptive Response, Individual Radio-Sensitivity and Correlation of Base Excision Repair Gene Polymorphism (hOGG1, APE1, XRCC1, and LIGASE1) in Human Peripheral Blood Mononuclear Cells Exposed to Gamma Radiation. Environ Mol Mutagen. 2020. V. 61. No. 5. P. 551-559. doi: 10.1002/em.22383.
- Stetka J., Gursky J., Linan Velasquez J., et al. Role of DNA Damage Response in Suppressing Malignant Progression of Chronic Myeloid Leukemia and Polycythemia Vera: Impact of Different Oncogenes. Cancers (Basel). 2020. V. 12. No. 4. Article ID. 903. doi: 10.3390/cancers12040903.
- Wang W.A., Lai L.C., Tsai M.H., et al. Development of a prediction model for radiosensitivity using the expression values of genes and long non-coding RNAs. Oncotarget. 2016. V. 7. No. 18. P. 26739-26750. doi: 10.18632/oncotarget.8496.


