Возможность использования вторичного сырья в качестве питательной среды для синтеза эргостерола дрожжами вида Saccharomyces cerevisiae
Автор: Калинина Ирина Валерьевна, Ни Даниил Дмитриевич, Черняев Степан Сергеевич, Мерлина Екатерина Валерьевна, Абдуллина Альфия Рушановна, Фаткуллин Ринат Ильгидарович
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.8, 2020 года.
Бесплатный доступ
Эргостерол (эргостерин), известный как предшественник витамина D2, широко используется в различных отраслях пищевой промышленности и медицине. Химический синтез эргостерола является сложным, многостадийным и очень затратным процессом. По этой причине промышленное получение эргостерола в настоящее время осуществляется путем биосинтеза с применением различных микроорганизмов, растительных клеток и микроводорослей. Среди дрожжей наибольшее распространение для получения эргостерола получили Saccharomyces cerevisiae, Saccharomyces uvarum, Saccharomyces carlsbergensis, Saccharomyces ellipsoideus. Целью настоящего исследования стало изучение интенсивности биосинтеза эргостерола двумя образцами дрожжей Saccharomyces cerevisiae при использовании питательных сред на основе экстрактов яблочного жмыха с различным содержанием глюкозы (от 1 до 15 %) как основного источника углерода для питания дрожжей. На первом этапе исследований была проведена оценка степени зрелости дрожжей путем микроскопии окрашенного раствором Люголя препарата дрожжей как одного из важных показателей технологической пригодности дрожжевой культуры для синтеза и накопления эргостерола. Исследования биосинтеза эргостерола проводились путем определения его количественного содержания в биомассе дрожжей через 12, 24, 36 и 48 часов брожения. Полученные результаты показали, что характер протекания процесса биосинтеза эргостерола для обоих образцов дрожжей был схожим, и количественное содержание глюкозы в питательной среде оказало весомое влияние на интенсивность данного процесса. Так, недостаток глюкозы привел к резкому снижению эффективности накопления эргостерола дрожжевыми клетками, через 48 часов количество эргостерола составило 2,0-2,5 %. Избыток же глюкозы привел к значительному временному сдвигу фазы активного синтеза эргостерола дрожжами, примерно на 12 часов. Было установлено, что среди исследуемых образцов наиболее эффективно синтез эргостерола протекал при содержании глюкозы в питательной среде 8 %.
Биосинтез эргостерола, дрожжи saccharomyces cerevisiae, питательная среда, содержание глюкозы
Короткий адрес: https://sciup.org/147234324
IDR: 147234324 | УДК: 664.68.022.345 | DOI: 10.14529/food200408
Текст научной статьи Возможность использования вторичного сырья в качестве питательной среды для синтеза эргостерола дрожжами вида Saccharomyces cerevisiae
Эргостерол (эргостерин) (эргоста-5,7,22-триен-3β-ол, рис. 1) является предшественником витамина D2, а также необходим для синтеза гормонов кортизона и флавона.
Из-за наличия асимметричного центра в молекуле эргостерола его химический синтез сложен, многостадиен и требует высоких материальных, энерго- и трудозатрат [6, 13, 19, 21]. Вследствие чего процессы дрожжевого биосинтеза стали наиболее привлекательными методами получения эргостерина в промышленных масштабах. Среди всего разнообразия потенциальных продуцентов эргостерола предпочтение отдается различным штаммам
Saccharomyces cerevisiae , как достаточно неприхотливым и наиболее изученным микроорганизмам.
Биосинтез эргостерола дрожжами в последние годы являлся предметом многочисленных исследований и на сегодняшний день достаточно полно представлен в литературе (рис. 2).
Эргостерол является основным липидным компонентом мембраны клеток дрожжей и определяет их структурные особенности, такие как проницаемость, текучесть и целостность, которые важны для правильного функционирования мембранных белков. Эргостерол обеспечивает барьерную функцию мем-
браны и деятельность ассоциированных с мембраной ферментов. Значительная нехватка эргостерина или его разрушение приводят к дестабилизации мембраны [1, 2, 7, 11, 14, 19]. На эргостерин приходится более 60 % от всех стеринов дрожжевой клетки, его содержание в среднем составляет 0,2 - 0,5 % сухой биомассы дрожжей, для некоторых штаммов может достигать 10 %.
Исследования последних лет указывают на то, что синтез эргостерина протекает в строго аэробных условиях. Так, Alexandra Cristina Blaga и соавторы установлено, что для образования одной молекулы эргостерина необходимо десять молекул кислорода [13].
Помимо аэрации к процессу дрожжевого биосинтеза эргостерола предъявляются и другие требования, в частности исследованиями X. He и соавторами установлено, что на эффективность биосинтеза оказывает влияние соотношение источников углерода и азота в питательной среде, а также накопленный в процессе брожения этанол [14].
Tianwei Tan и соавторы проводили исследования, направленные на выявление взаимосвязи процесса накопления биомассы дрожжей и синтезом эргостерола, которые показали, что для синтеза эргостерола прирост биомассы не является тригерным фактором. Наиболее активно синтез эргостерола протекал в зрелой культуре дрожжей [22].
Вместе с тем, несмотря на то, что производство эргостерола путем дрожжевого биосинтеза представляет собой активно эксплуатируемую отрасль биотехнологий, многие аспекты этого процесса до сих пор остаются неизученными [3–5, 8–10, 12, 15]. В частности, в литературе отсутствуют системные данные о возможности регулирования интенсивности биосинтеза эргостерола путем изме- нения содержания сухих веществ в питательной среде. Кроме того, значительный практический интерес представляет возможность использования отходов пищевых производств в качестве основы для питательной среды в технологии дрожжевого биосинтеза. В рамках данных исследований изучалась возможность использования отходов производства сока из сортов яблок, районированных в Уральском регионе.
Целью настоящего исследования стало изучение интенсивности накопления эргостерола дрожжами при использовании питательных сред на основе экстрактов яблочного жмыха с различным содержанием глюкозы.
Объекты и методы исследований
Для исследования было выбрано 2 образца дрожжей Saccharomyces cerevisiae :
образец 1 – дрожжи сухие хлебопекарные производства АО Компания «ПРОКСИМА»;
образец 2 – дрожжи сухие быстродействующие «Dr. Oetker» производства ЗАО «Д-р Оеткер».
Внешний вид дрожжей в сухом виде и результаты их микроскопии представлены на рис. 3.
В качестве питательной среды использовалась стерильная среда YP (8×2 % пептона, 8×2 % дрожжевого экстракта) с дополнительно внесенным количеством глюкозы в количестве 1, 8 и 15 %.
Дрожжи вносили в предварительно ре-гидратированном виде в количестве 3 об. % к объему питательной среды.
Таким образом, был сформирован перечень объектов исследования, представленный в таблице.
Процесс брожения протекал при температуре 37 °С в течение 48 часов в аэробных условиях. Содержание эргостерина оценивали через каждые 12 часов.
SQUALENE

SQUALENE EPOXIDE

LANOSTEROL

4.4-DIMETHYLCHOLESTA-8.14.24 TRIENOL

4.4-DIMETHYLZYMOSTEROL
Предварительно была проведена условная оценка степени зрелости дрожжевой культуры путем микроскопирования окрашенного раствором Люголя препарата дрожжей.
Характеристика объектов исследования
|
Код образца |
Используемые дрожжи |
Содержание глюкозы в питательной среде, % |
|
1.1 |
образец 1 |
1 |
|
1.2 |
образец 1 |
8 |
|
1.3 |
образец 1 |
15 |
|
2.1 |
образец 2 |
1 |
|
2.2 |
образец 2 |
8 |
|
2.3 |
образец 2 |
15 |
ERG 24.26.27
4a - METHYLZYMOSTEROL
ERG 24.26.27
ZYMOSTEROL
ERG 6

FECOSTEROL

EPISTEROL
ERG3

ERGOSTA 5.7.24 (28) TRIENOL
ERG 5
ERGOSTA 5.7.22.24 (28) TETRAENOL

ERGOSTEROL
Рис. 2. Метаболический путь синтеза эргостерола Saccharomyces cerevisiae [13]
Содержание эргостерина в дрожжах определяли спектрофотометрически. Для чего из навески 200 мг дрожжей экстрагировали эргостерин с использованием 70 % раствора этилового спирта. Определение оптической плотности вещества проводили в концентрированной серной кислоте при длине волны СФ 328 нм.
Содержание эргостерола определяли по формуле
A ×100×25×100
Acm×m×(100-W) ,
где A – оптическая плотность испытуемого раствора; m – точная навеска анализируемого образца, мл; W – влажность сырья; Acm – удельный показатель поглощения чистого эргостерина.
Результаты и обсуждение
Для эффективного протекания процессов биосинтеза к состоянию дрожжевой культуры предъявляется ряд требований, в том числе контролируется количество почкующихся клеток, мертвых клеток, наличие посторонних микроорганизмов, содержание в дрожжах запасных питательных веществ (гликогена и волютина) [7, 15–17, 21].
Поскольку исследования, представленные в литературе, указывают на то, что для эффективного синтеза эргостерола необходима зрелая культура дрожжей, то в рамках проводимых исследований на первом этапе была проведена оценка физиологического состоя-

б)
а)

в) г)
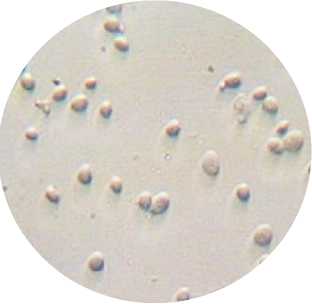
Рис. 3. Внешний вид исследуемых дрожжей Saccharomyces cerevisiae: а – образец 1, сухие дрожжи; б – образец 1, препарат «раздавленная капля» при увеличении ×600; в – образец 2, сухие дрожжи; г – образец 2, препарат «раздавленная капля» при увеличении ×600
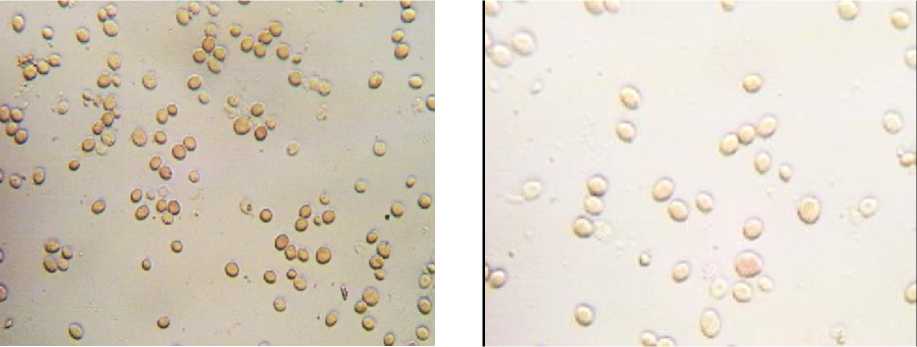
ние дрожжевых культур путем микроскопирования окрашенного раствором Люголя препарата (рис. 4) [4, 7, 13, 15, 18].
Известно, что количество гликогена в клетках дрожжей меняется как от их возраста, так и в зависимости от условий культивирования. В зрелых клетках гликоген занимает от 1/3 до 2/3 клетки и более. В клетках с низкой физиологической активностью окрашенный гликоген занимает менее 1/4 клетки. В молодых клетках гликоген отсутствует и при окрашивании раствором йода клетки приобретают бледно-желтый цвет [2, 6–8, 12, 19, 20].
Результаты микроскопии показали, что исходное состояние дрожжевых суспензий было близким. Исследуемые дрожжи имели овальную форму, клетки дрожжей образца 1 отличались несколько меньшими размерами, чем клетки образца 2. Окраска суспензий дрожжей йодсодержащим раствором показала, что в суспензии дрожжей образца 1 превалировали дрожжи зрелые (окрашенные в коричневый цвет), клетки дрожжей образца 2
можно было отнести к молодым (отмечалось преимущество клеток со светло-желтой окраской).
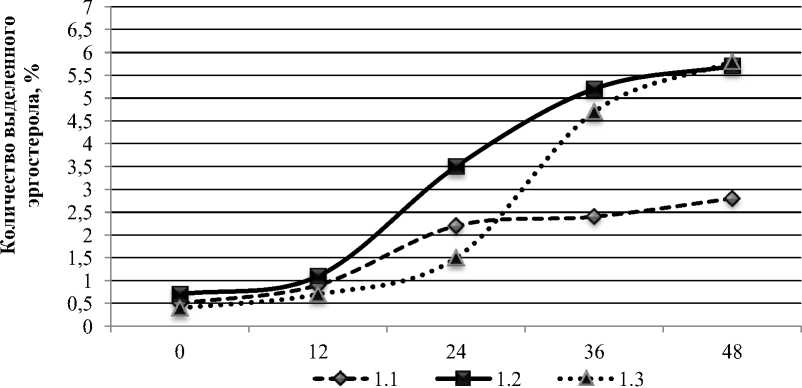
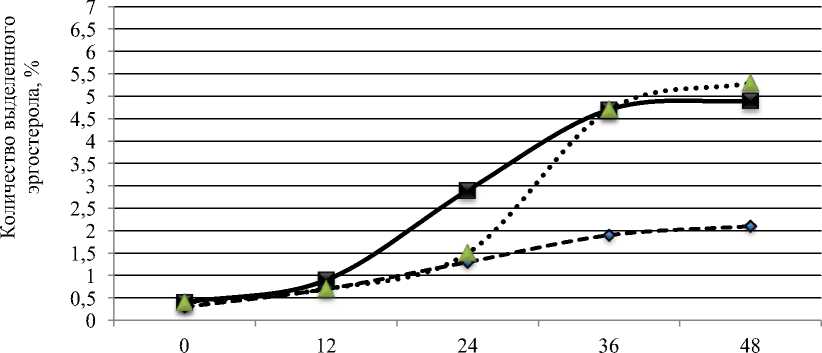
Результаты определения эргостерола в исследуемых образцах дрожжей представлены на рис. 5.
Полученные результаты показали, что исследуемые образцы дрожжей способны синтезировать эргостерол в количествах, достигающих 5,4–5,8 % от количества биомассы. При этом наблюдается выраженная зависимость накопленного эргостерола от используемой питательной среды. Так, для обоих образцов дрожжей использование питательной среды, содержащей 1 % глюкозы, оказалось неэффективным. За период 48 часов биосинтез эргостерола не превышал 2,5 и 2,0 % для образцов 1 и 2 соответственно.
Наиболее интенсивно синтез эргостерина протекал при содержании глюкозы 8 и 15 % не зависимо от образцов дрожжей. При этом характер синтеза был схож. Так, при использовании питательной среды с содержанием
а) б)
Рис. 4. Результаты микроскопии дрожжей (препарат «раздавленная капля», окрашенный раствором Люголя, увеличение × 600): а – образец 1; б – образец 2
а)
—о— 2.1 2.2 ••*••2.3
б)
Рис. 5. Количество эргостерола, синтезированное в процессе брожения исследуемыми образцами дрожжей, %: а – образец 1; б – образец 2
глюкозы 8 % наибольшая интенсивность накопления эргостерола отмечалась в период с 12 до 36 часов как для образца 1, так и для образца 2, что вероятно соответствовало середине экспоненциальной фазы роста дрожжей. Достаточно большое количество глюкозы (8 и 15 %) в питательных средах позволило обеспечить относительно высокую скорость синтеза эргостерола для обоих образцов дрожжей. Вместе с тем, при использовании среды с содержанием глюкозы 8 % активный синтез эргостерола начинается уже после 12 часов брожения, тогда как при содержании глюкозы 15 % – только после 24 часов. Очевидно, высокая концентрация глюкозы (15 %) привела к снижению доступного кислорода для дрожжей и быстрому росту клеток в период с 12 до 24 часов, что привело к сдвигу фазы активного синтеза эргостерола. На конец брожения, через 48 часов, количество накопленного эргостерола в образцах дрожжей, брожение которых протекало в среде с содержанием глюкозы 8 и 15 % различалось незначительно, колебания составили 0,2–0,3 %.
Заключение
Таким образом, представленные материалы свидетельствуют о том, что процесс интенсивности биосинтеза эргостерола дрожжами можно регулировать путем изменения содержания глюкозы, как основного источника углерода, в питательной среде. Установлено, что нехватка глюкозы приводит к снижению общей эффективности синтеза эргостерола, тогда как ее избыток – к сдвигу фазы активного синтеза эргостерола и увеличению продолжительности этого процесса во времени. Настраивая процесс биосинтеза эргостерола путем оптимизации состава питательной среды и других характеристик можно эффективно решать биотехнологические задачи в промышленных масштабах.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011.
Список литературы Возможность использования вторичного сырья в качестве питательной среды для синтеза эргостерола дрожжами вида Saccharomyces cerevisiae
- Бабьева, И.П. Биология дрожжей / И.П. Бабьева, И.Ю. Чернов. - М.: Изд-во МГУ, 2004. - 239 с.
- Бирюзова, В.И. Ультраструктурная организация дрожжевой клетки / В.И. Бирюзова. - М.: Наука, 1993. - 224 с.
- Борисова, С.В. Использование дрожжей в промышленности и / С.В. Борисова, О.А. Решет ник, З.Ш. Мингалеева. - СПб.: ГИОРД, 2008. - 216 с.
- Калинина, И.В. Оценка эффективности процесса биосинтеза этанола дрожжами рода Saccharomyces / И.В. Калинина, Р.И. Фат куллин, Н.В. Попова, А .Р. Шарипова // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». - 2018. - Т. 6, № 4. - С. 74-82. DOI: 10.14529/food180410
- Кретова Ю.И. Актуальные аспекты обеспечения качества сырьевых компонентов в технологии производства напитков/ Ю.И. Кре ова, И.В. Калинина // Ве ник ВГУИТ. -2017. - Т. 79, № 1 (71). - С. 169-177.
- Клунова, С.М. Биотехнология / С.М. Клунова, Т.А. Егорова, Е.А. Живухина. - М. : Издательский центр «Академия», 2010. -256 с.
- Меледина Т.В. Физиологиче кое о-стояние дрожжей: учебн. пособие / Т.В. Ме-ледина, С.Г. Давыденко, Л.М. Васильева. -СПб.: НИУИТМО; ИХиБТ, 2013. - 48 с.
- Паймулина, А .В. Влияние полисахаридов бурых водоро лей на проце ы жизнедея-т ельност и дрожжей Saccharomyces Cerevisiae / А .В. Паймулина, И.Ю. Пот ороко, И.В. Калинина // Вест ник ЮУрГУ. Серия «Пищевые и биотехнологии». - 2020. - Т. 8, № 3. - С. 90-98. DOI: 10.14529/food200311
- Палагина, К.К. Технологические расче-ы дрожжевого производ ва / К.К. Палагина. - М. : Пищевая промышленность, 2008. -4 .
- Уст инова, А .С. Влияние углеводного о ава вы ококонцен рированного ячменного сусла на бродильную активность спиртовых дрожжей / А .С. Уст инова, Н.В. Барако-ва, Е.В. Бори ова // Производ во пир а и ликероводочных изделий. - 2013. - № 3. -С. 37-40.
- Apweiler E., Sameith K., Margaritis T., Brabers N., van de Pasch L., Bakker L.V., van Leenen D., Holstege F.C., Kemmeren P. Yeast glucose pathways converge on the transcription-al regulation of trehalose biosynthesis // BMC Genomics. - 2012. - V. 13. - P. 239.
- Alexandre H., Rousseaux I., Charpentier C. Ethanol adaptation mechanisms in Saccharo-myces cerevisiae // Biotechnol. Appl. Biochem. -1994. - V. 20 (Pt 2). - P. 173-183.
- Blaga, A. C., Ciobanu, С, Cagcaval, D., Galaction, A. Enhancement of ergosterol production by Saccharomyces cerevisiae in batch and fed-batch fermentation processes using n-dodecane as oxygen-vector // Biochemical Engineering Journal. - 131 (2018). - P. 70-76.
- He, X., Huai, W., Tie, C., Liu Y., Zhang, B. Breeding of high ergosterolproducing yeast strains // J. Ind. Microbiol. Biotechnol. - 25 (2000). - Pp. 39-44.
- Hounsa C.G., Brandt E.V., Thevelein J., Hohmann S., Prior B.A. Role of trehalose in survival of Saccharomyces cerevisiae under osmotic stress // Microbiology. - 1998. - V. 144. - P. 671-680.
- Pahlman A.K., Granath K., Ansell R., Hohmann S., Adler L. The yeast glycerol 3-phosphatases Gpp1p and Gpp2p are required for glycerol biosynthesis and differentially involved in the cellular responses to osmotic, anaerobic, and oxidative stress // J. Biol. Chem. - 2001. -V. 276. - P. 3555-3563.
- Parks, L.W., Crowley J.H., Leak, F.W., Smith S.J., Tomeo, M.E. Use of sterol mutants as probes for sterol functions in the yeast Saccha-romyces cerevisiae Crit. Rev. // Biochem. Mol. Biol. - 34 (1999). - P. 399-404.
- Siderius M., Van Wuytswinkel O., Reijenga K.A., Kelders M., Mager W.H. The control of intracellular glycerol in Saccharomyces cerevisiae influences osmotic stress response and resistance to increased temperature // Mol. Microbiol. - 2000. - V. 36. - P. 1381-1390.
- Shobayashi, M., Mitsueda, S., Ago, M., Fujii, T. Iwashita, K., Iefuji Effects of culture conditions on ergosterol biosynthesis by Saccha-romyces cerevisiae // Biosci. Biotechnol. Biochem. - 69 (2005). - P. 2381-2388.
- Souza, C.M., Schwabe, T.M., Pichler, H., Ploier B., Leitner, E., Guan, X.L., Wenk, M.R, Riezman, I., Riezman H. A stable yeast strain efficiently producing cholesterol instead of ergosterol is functional for tryptophan uptake, but not weak organic acid resistance // Metab. Eng., 13 (2011). - P. 555-569.
- Stanley D., Bandara A., Fraser S., Chambers P.J., Stanley G.A. The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae // J. Appl. Microbiol. - 2010. -V. 109. - P. 13-24.
- Tan T., Zhang M., Cao H. Ergosterol production by fed-batch fermentation of Saccha-romyces cerevisiae // Enz. Microb. Technol. -33 (2003). - P. 366-370.


