Возможности лучевой диагностики рака эндометрия у больных с метаболическим синдромом
Автор: Данилова О.С., Величко С.А., Коломиец Л.А., Фролова И.Г., Трухачева Н.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.27, 2012 года.
Бесплатный доступ
В исследование включено 83 женщины с диагнозом рак эндометрия в сочетании с метаболическим синдромом. При сочетанном применении комплексного ультразвукового исследования и спиральной компьютерной томографии данные методы дополняют друг друга для получения полноценной объективной оценки распространенности патологического процесса, включающего переход на слизистую цервикального канала, инвазию в миометрий, поражение параметральной клетчатки и лимфатического аппарата, что в совокупности повышает уровень достоверности дооперационной диагностики рака эндометрия. Обоснована целесообразность комплексного применения ультразвукового исследования и мультиспиральной компьютерной томографии в диагностике рака эндометрия у пациенток с метаболическим синдромом.
Рак эндометрия, диагностика, ультрасонография, компьютерная томография
Короткий адрес: https://sciup.org/14919784
IDR: 14919784 | УДК: 618.14-006.6:616-008.9]-073.48
Текст научной статьи Возможности лучевой диагностики рака эндометрия у больных с метаболическим синдромом
Ежегодно в мире выявляют 10,9 млн новых случаев злокачественных новообразований, более 850 тыс. из них приходится на злокачественные новообразования женской половой сферы. Рак эндометрия, по данным мировой статистики, занимает лидирующие позиции в структуре онкогинекологической заболеваемости. Ежегодно число вновь выявленных больных раком тела матки в мире составляет 188800. В России каждый год регистрируется более 17 тыс. случаев рака тела матки. В последние десятилетия наблюдается неуклонный рост данной патологии. Так, в России за последние 20 лет она увеличилась в 2 раза и составила 13,3 случаев на 100 тыс. населения [3, 4]. Данная тенденция наблюдается не только среди женщин старше 60 лет, но и среди пациенток репродуктивного и пременопаузального периодов [7]. В структуре злокачественных новообразований женского населения России рак эндометрия занимает IV место при анализе всех возрастных рангов, а в возрастной группе от 45 до 54 лет – III место [4, 8, 16].
Рост заболеваемости раком эндометрия обусловлен не только увеличением средней продолжительности жизни женщин, но также ростом эндокринно-метаболических нарушений – изменениями репродуктивного и энергетического гомеостаза (сахарный диабет, гиперлипиде- мия, гиперэстрогенемия, ановуляция), а также нарушениями, связанными с длительным применением эстрогенсодержащих препаратов, высококалорийной диетой с повышенным содержанием жиров.
Метаболический синдром (МС) – междисциплинарная проблема, имеющая не только медицинский, но и социальный характер, поскольку распространенность его в общей популяции составляет от 5 до 20% и продолжает увеличиваться. По данным ВОЗ (2006), в возрасте 30–65 лет его основные проявления имеются у каждого пятого жителя экономически развитых стран. Предполагается, что от МС в России и западных странах страдают 25– 35% населения. А в возрасте старше 60 лет доля лиц с МС составляет приблизительно 43%. Больные с МС в большей степени, чем в популяции в целом, предрасположены к развитию ряда злокачественных новообразований. При ожирении с превышением массы на 15 кг риск возникновения рака эндометрия увеличивается в 3 раза, а на 25 кг – в 10 раз. При сахарном диабете риск заболевания раком эндометрия также увеличивается в 3 раза, а при длительном приеме эстрогенов возрастает в 10–15 раз [8, 9].
Между тем в ранней диагностике рака эндометрия отмечаются неудовлетворительные результаты, т.к. существующие методы, такие как аспирационная биопсия эндометрия, диагностическое выскабливание полости мат- ки и цервикального канала, гистероскопия с прицельным взятием биопсии являются постсимптомными и выполняются уже при наличии клинических проявлений заболевания – кровотечений [2, 15]. В этой связи особенно ценными являются возможности его доклинической диагностики и, в частности ультразвуковой метод исследования с применением современных технологий, таких как нативная и тканевая гармоника, энергетический допплер, допплеровская визуализация, трехмерная, панорамная эхографии, эхоконтрастная ангиография, что определяется его высокой информативностью [1, 2, 5].
Существуют многочисленные работы, посвященные эффективности использования эхографии в онкогинекологии [5, 6, 9–11]. Однако диагностический потенциал метода с учетом новых возможностей ультразвуковой аппаратуры до конца не изучен и лишен четкой систематизации.
Особая сложность возникает при определении распространенности патологического процесса на цервикальный канал и уточнении инвазии в миометрий, что влияет на изменение в тактике лечения. Утвердилось мнение, что в постменопаузе толщина эндометрия не должна превышать 4 мм [2, 4, 5, 9, 11, 14]. М-эхо более 8 мм считается патогномоничным для рака эндометрия в этом возрасте [4–6, 11, 14]. Но, с другой стороны, в репродуктивном периоде в секреторную фазу менструального цикла такая толщина эндометрия может соответствовать норме.
Важным вопросом при раке эндометрия является оценка степени инвазии в миометрий. К эхографическим признакам инвазивного характера роста опухоли относятся нарушение целостности ореолы вокруг слизистой, резкое истончение и исчезновение нормального изображения ткани миометрия. Точность трансвагинальной эхографии в оценке степени инвазии при раке эндометрия составляет от 68,0 до 91,4%. Большинство авторов, характеризуя инвазию в миометрий, используют критерий, подразумевающий распространение процесса на глубину до 50% и более толщины миометрия [2, 5, 6, 11, 12]. Вместе с тем четких и объективных ультразвуковых признаков инвазивного роста рака эндометрия до настоящего времени не разработано.
Не менее актуальной проблемой при раке эндометрия является своевременная диагностика инфильтрации параметральной клетчатки и лимфагенного метастазирования. Существуют трудности визуализации лимфатических узлов, обусловленные малыми размерами в норме и на начальных этапах метастазирования, расположением их в анатомически глубокой области с чрезмерным развитием жировой ткани, как в зонах обследования, так и общего избыточного развития подкожно-жировой клетчатки в результате метаболического синдрома [7, 11]. Соответственно, при сочетании рака эндометрия с метаболическим синдромом возникает необходимость использования дополнительного метода исследования.
Методом выбора, позволяющим всесторонне исследовать малый таз и выполнить пельвиометрию, выявить измененные лимфатические узлы при избыточном весе, улучшить визуализацию патологического образования, применив контрастное усиление с оценкой взаимоотношений патологического очага и прилежащих сосудов и органов, является спиральная компьютерная томография [13]. Таким образом, сопоставление данных УЗИ и спиральной компьютерной томографии дает возможность объективизировать полученные данные. Однако сочетанное применение ультразвукового исследования и спиральной компьютерной томографии у больных раком эндометрия в сочетании с метаболическим синдромом до настоящего времени не нашли должного отражения в литературе.
Цель: оценка роли комплексного применения ультрасонографии и мультиспиральной компьютерной томографии в определении степени распространенности опухолевого процесса у больных раком эндометрия.
Материал и методы
В работе представлены результаты исследования 83 пациенток, находившихся на обследовании и лечении в клинике ФГБУ “НИИ онкологии” СО РАМН (Томск) с 2008 по 2010 гг. включительно с диагнозом рака эндометрия в сочетании с МС. Возраст пациенток варьировал от 25 до 70 лет. Наибольшее количество больных, включенных в исследование, находилось в возрастной группе 45–65 лет (средний возраст составил 61,0±1,5 лет). Индекс массы тела колебался от 30 до 40 кг/м2 (табл. 1).
Всем больным проводились ультразвуковое исследование и спиральная компьютерная томография. УЗИ органов малого таза, зон лимфогенного и гематогенного метастазирования выполнялось на аппарате Logiq 5 Expert (GE, США) конвексным датчиком с переменной частотой 2–5 МГц и трансвагинальным датчиком с переменной частотой 6–10 МГц в режимах серошкального сканирования (В-режим), цветового допплеровского картирования (режим ЦДК). Трансабдоминальное сканирование органов малого таза выполнялось полипозиционно по традиционной методике после предварительного естественного наполнения мочевого пузыря, трансвагинальная эхография – после опорожнения мочевого пузыря.
Ультразвуковая диагностика рака эндометрия включала следующие последовательные этапы: определение точной локализации опухоли в полости матки, оценку глубины инвазивного роста опухоли в миометрий, уточнение поражения внутреннего маточного зева, выявление лимфогенных и гематогенных метастазов. При изучении шейки матки обращалось особое внимание на состояние внутреннего зева. С помощью цветового допплеровского (ЦДК) и/или энергетического (ЭДК) картирования изучались качественные параметры кровотока в сосудах мат-
Таблица 1
Распределение больных раком эндометрия в зависимости от индекса массы тела
Спиральная компьютерная томография проводилась на мультиспиральном томографе “Somatom Emotion-6” с применением внутривенного болюсного контрастирования омнипаком, контрастированием кишечника урографином и умеренном наполнении мочевого пузыря. В последующем осуществлялись мультипланарные реформации и построение объемного изображения. Сканирование органов малого таза выполняли в каудальном направлении, начиная от уровня гребней подвздошных костей и заканчивая на уровне седалищных костей. Для оценки инвазии стромы, инфильтрации стенки мочевого пузыря и прямой кишки проводили отсроченную фазу через 5–7 мин. Анализ компьютерных томограмм оценивали двумя способами – визуальным и денситометри-ческим. Критериями правильности установления диагноза при ультразвуковом исследовании и спиральной компьютерной томографии служили результаты хирургического лечения и гистологического исследования операционного и биопсийного материала, а также цитологического исследования операционных смывов из брюшной полости. Во всех случаях получена гистологическая верификация процесса.
Стадию заболевания устанавливали в соответствии с общепринятой классификацией FIGO (1988) и TNM (2003). У 67 (81%) пациенток диагностирована I стадия рака тела матки (T1а-Ib), у 9 (11%) – II стадия, у 7 (8%) – III стадия. Все больные получили комбинированное лечение. На первом этапе выполнялась операция, на втором – сочетанная лучевая терапия. Выявленные при ультразвуковом исследовании и спиральной компьютерной томографии критерии у больных раком эндометрия были сопоставлены с результатами хирургического лечения и морфологическим исследованием операционного материала.
Все пациенты давали письменное информационное согласие на проведение исследований и использование данных в дальнейшем научном анализе и публикациях.
Статистическую обработку материала осуществляли с помощью программ Excel и STATISTICA 6.0. Результаты представлены в виде среднего значения (M)±ошибки среднего (m), определения долей (в %). При нормальном распределении выборочных данных статистическую гипотезу о равенстве средних значений проверяли с помощью t-критерия Стьюдента. Для сравнения признаков, не отвечающих закону нормального распре- деления, использовался U-тест Манна–Уитни. Для оценки статистической значимости различий долей – метод четырехпольных таблиц с определением χ2. Вероятность ошибочного принятия неверной гипотезы p не превосходила 0,05 (5%).
Результаты и обсуждение
Преобладающим гистотипом опухоли была эндометриоидная аденокарцинома 72 (87%). Эндометриоидная аденокарцинома с папиллярными структурами диагностирована у 6 пациенток (7%), светлоклеточный рак – у 5 (6%). Распределение больных в зависимости от степени дифференцировки аденокарциномы эндометрия было следующим: высокодифференцированная – 28 чел. (34%), умеренно дифференцированная – 36 (43%), низкодифференцированная – 5 (6%), смешанная – 14 пациенток (17%).
Использование современной высокотехнологичной ультразвуковой аппаратуры позволило проанализировать большое количество ультразвуковых критериев и выделить среди них наиболее значимые при диагностике рака эндометрия (табл. 2).
В большинстве случаев (57,8%) диагностировано утолщение срединных маточных структур, максимально до 32 мм (рис. 1 А). При этом наибольший объем опухоли составил – 205 см3. В то же время у 2 пациенток (6,6%) выявлен рак эндометрия с минимальным утолщением эндометрия до 5 мм при объеме опухоли – 0,5 см3. Диффузное утолщение эндометрия по всей длине полости матки значительно чаще отмечалось при значительном утолщении измененного эндометрия. Локальное неравномерное утолщение эндометрия в области дна или трубного угла диагностировано в основном при незначительном утолщении эндометрия в средней трети полости матки, либо при нормальном значении в данной зоне исследования. В 51,9% случаев карцинома эндометрия лоцировалась как образование повышенной эхогенности с неровными контурами, а в 30,1% наблюдений при ультрасонографии визуализировались опухоли с наличи-
Таблица
Характер и частота ультрасонографических признаков рака эндометрия
|
Ультразвуковые признаки |
Частота признака |
|
|
Толщина эндометрия |
менее 4 мм |
2 (2,4%) |
|
4–10 мм |
33 (39,8%) |
|
|
более 10 мм |
48 (57,8%) |
|
|
Эхогенность эндометрия |
не изменена |
- |
|
снижена |
15 (18,0%) |
|
|
повышена |
43 (51,9%) |
|
|
изоэхогенная |
25 (30,1%) |
|
|
Структура эндометрия |
однородная |
38 (45,8%) |
|
неоднородная |
45 (54,2%) |
|
|
Конфигурация границы между |
четкая |
16 (19,3%) |
|
опухолью и миометрием |
нечеткая |
67 (80,7%) |
|
Контуры гипоэхогенного ободка |
непрерывный |
16 (19,3%) |
|
прерывистый |
67 (80,7%) |
|
|
Инвазия опухоли в миометрий |
есть |
67 (80,7%) |
|
нет |
16 (19,3%) |
|
|
Контуры гипоэхогенного ободка |
определяется |
27 (32,5%) |
|
не определяется |
56 (67,5%) |
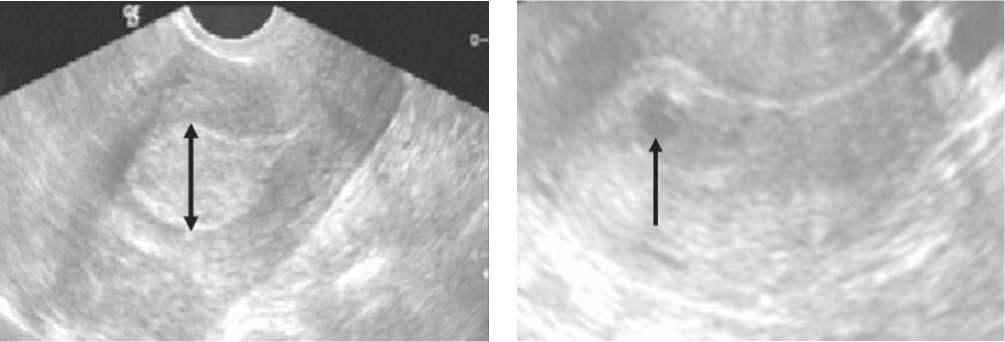
Рис. 1. А – сонограмма пациентки Р., 57 лет. Визуализируется утолщение эндометрия (до 32 мм) в сочетании со значительным повышением его эхогенности. Б – сонограмма пациентки З., 68 лет. Эндометрий утолщен (26 мм), структура его неоднородная за счет наличия участков снижения эхогенности, которые имеют неправильную форму с неровными и нечеткими контурами
ем изо- и гипоэхогенных зон неправильной формы с неровными и нечеткими контурами (рис. 1 Б).
Кроме того, у 10 больных (12,0%) при толщине срединных маточных структур более 28 мм визуализировались такие признаки, как расширение полости матки с гипоэхогенным неоднородным содержимым и массивными солидными эхогенными разрастаниями по контуру (рис. 2).
В ходе исследования установлено, что с увеличением объема опухоли эхоструктура эндометрия менялась в зависимости от размеров опухоли от повышенной к изо-эхогенной с присоединением неоднородности структуры. Были выявлены также особенности кровотока в пораженных участках эндометрия. Так, при проведении исследования в режиме ЦДК в 32,5% случаев визуализировались признаки неоваскуляризации в структуре опухоли. Цветовые локусы, как правило, определялись при объеме эндометрия 40,0 см3 и более. При количественном
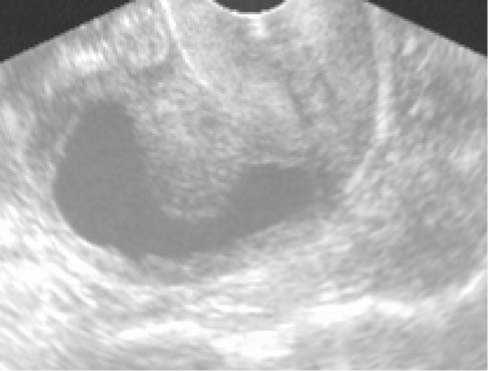
Рис. 2. Сонограмма пациентки Р., 57 лет. Визуализируется расширенная полость матки с наличием изоэхогенных разрастаний по ее контуру с неровными краями. Содержимое полости гипоэхогенное с мелкой гомогенной взвесью
А
Б
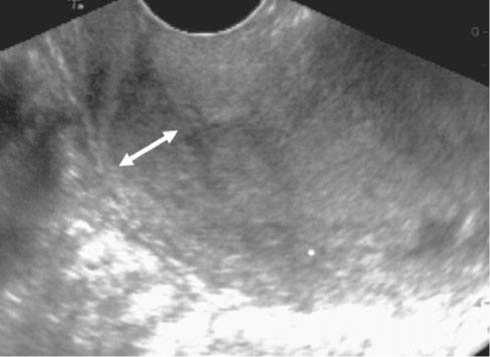
Рис. 3. А – сонограмма пациентки П., 63 лет. Эндометрий значительно утолщен, характер его изоэхогенный, визуализируется прерывистость гипоэхогенного ободка и нечеткость границы между опухолью и миометрием. Б – сонограмма пациентки К., 60 лет. Визуализируется расширение внутреннего зева и цервикального канала. Стенки неровные и нечеткие, содержимое изоэхо-генное, идентичное содержимому полости матки
анализе внутриопухолевого кровотока отмечалось снижение индексов сосудистого сопротивления (индекс резистентности находился в пределах 0,35–0,45). В 80,7% случаев наблюдалась инвазия опухоли в миометрий, что характеризовалось прерывистостью гипоэхогенного ободка и нечеткостью границы с миометрием (рис. 3 А). В месте инвазии в режиме ЦДК определялись множественные цветовые локусы. При комплексной ультрасонографии отмечены преимущества трансвагинального метода исследования в возможности выявления инвазии опухо-
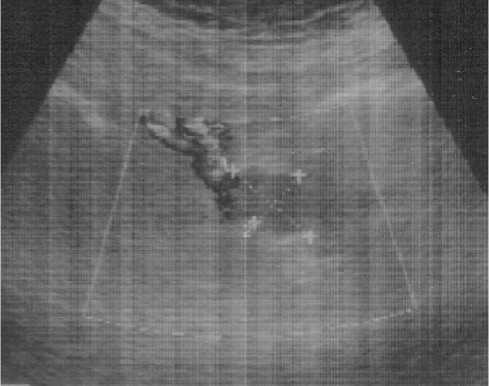
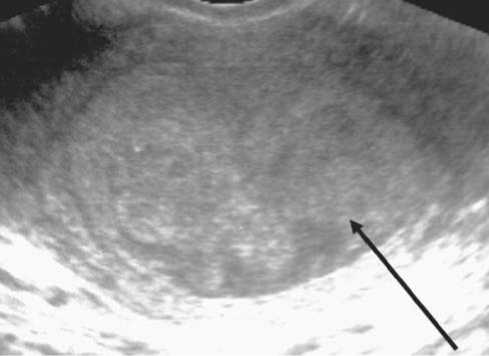
Рис. 4. Сонограмма пациентки У., 64 лет проекции подвздошных лимфатических узлов. По ходу подвздошных сосудов визуализируется овальное гипоэхогенное гомогенное образование 15х10 мм с ровными четкими контурами ли в шейку матки. При распространении злокачественного процесса на цервикальный канал диагностировалось расширение внутреннего зева с визуализацией нижней границы опухоли на его уровне и ниже. Инвазия карциномы диагностировалась при потере ровного четкого контура стенок цервикального канала на уровне опухолевого поражения, визуализации сосудов на границе опухоли и стенок цервикального канала (рис. 3 Б). Переход опухоли на перешеек или шейку матки чаще наблюдался при низкодифференцированном раке тела матки, больших опухолях и глубокой инвазии миометрия. При определении распространения опухоли на шейку матки диагностическая точность эхографии составила 92,2%, чувствительность – 95,1%, специфичность – 89,5%.
При ультразвуковом обследовании у 4 (4,8%) больных раком тела матки диагностированы метастазы в подвздошные лимфатические узлы. Метастатические лимфатические узлы визуализировались в виде округлых гипо-эхогенных образований, расположенных вдоль магистральных сосудов (рис. 4). При ультрасонографии наименьший размер выявленного метастатически измененного лимфатического узла составил 12х14 мм, больший – 35 мм.
При выполнении спиральной компьютерной томографии оказалось, что главным ее преимуществом по сравнению с ультразвуковым методом является возможность выявления метастатического поражения лимфатических узлов размерами до 10 мм. В ходе исследования визуализированы метастатические лимфоузлы в 7 случаях, что получило морфологическое подтверждение после операции в объеме расширенной экстирпации матки с придатками и лимфодиссекцией (рис. 5 А, Б).
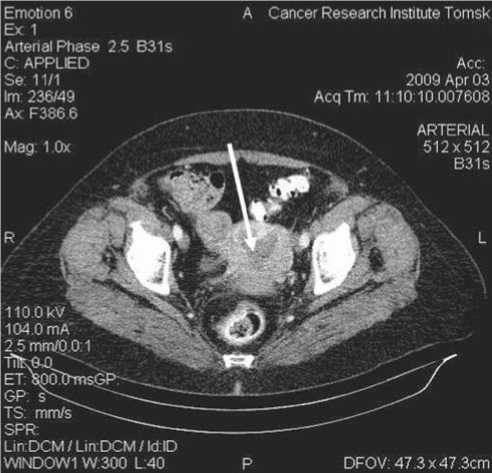
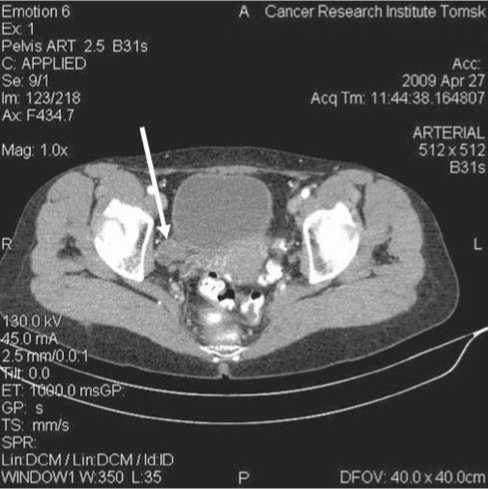
Рис. 5. Данные спиральной КТ. А – Полость матки расширена, с наличием жидкостного содержимого; в параметральной клетчатке – мелкие округлые лимфоузлы. Б – Матка отклонена влево, контуры ее нечеткие, в параметральной клетчатке справа визуализируется бугристое неоднородное образование размерами 30х35 мм – увеличенный лимфоузел
Однако применение метода СКТ нецелесообразно в определении глубины инвазии опухоли в миометрий, т.к. на томограммах можно выявить опухоль гомогенной структуры с денсиметрической плотностью от +40 до +50 ед., но невозможно достоверно визуализировать границу эндометрия с миометрием. Кроме того, судить о распространении опухолевого процесса на шейку матки возможно только по косвенным признакам (увеличение поперечного размера шейки, сглаженность наружного контура матки в проекции перешейка).
Проведение комплексного лучевого исследования у больных раком эндометрия, включающего УЗИ и СКТ, показало, что ультрасонография является высокоинформативным методом дооперационной диагностики местного распространения рака эндометрия. Метод позволяет выявлять наиболее специфические ультрасонографические признаки перехода патологического процесса на цервикальный канал. К ним относятся расширение внутреннего зева с визуализацией нижней границы опухоли на его уровне и ниже, потеря ровного четкого контура стенок цервикального канала на уровне опухолевого поражения, визуализация сосудов на границе опухоли и стенок цервикального канала, а также инвазии опухоли в миометрий, признаками которой являются нечеткость границы между опухолью и миометрием, прерывистость контуров гипоэхогенного ободка, наличие кровотока в опухоли с визуализацией сосудов на границе с миометрием.
Сравнительный анализ результатов ультразвукового исследования и спиральной компьютерной томографии не выявил преимущества последней при определении величины, характера, структуры опухоли эндометрия. Вместе с тем, СКТ позволяет более точно установить распространенность опухоли за пределы матки, метастазирование в забрюшинные, парааортальные, подвздошные лимфатические узлы, что имеет большое значение для адекватного планирования объема оперативного вмешательства.
Заключение
Таким образом, у больных раком эндометрия в сочетании с МС сочетанное использование спиральной компьютерной томографии и ультразвукового исследования позволяет добиться высокой информативности в оценке распространения опухолевого процесса, что является важным для определения тактики лечения.
Список литературы Возможности лучевой диагностики рака эндометрия у больных с метаболическим синдромом
- Абдуллаев Р.Я., Грабарь В.В., Лысенко Т.П. и др. Допплерография в гинекологии: учеб. пособ. -Харьков: Новое слово, 2009. -104 с.
- Ашрафян Л.А., Тё С.А., Огрызкова В.Л. и др. Возможности современных ультразвуковых технологий в уточняющей диагностике рака эндометрия//Медицинская визуализация. -2003. -№ 4. -С. 96-101.
- Бохман Я.В. Лекции по онкогинекологии. -М.: Медицинское информационное агентство, 2007. -304 с.
- Давыдов М.И. Летягин В.П., Кузнецов В.В. Опухоли женской репродуктивной системы. -М.: Медицинское информационное агентство, 2007. -255 с.
- Зыкин Б.И., Огрызкова В.Л., Соболь М.Ю. и др. Ультразвуковая диагностика рака эндометрия//Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. -2001. -№ 4. -С. 247-252.
- Исамухамедова М.А., Фазылов А.А, Мамадалиева Я.С. и др. Возможности эхографии в диагностике рака эндометрия//Ультразвуковая диагностика. -2000. -№ 3. -С. 44-48.
- Коломиец Л.А., Бочкарева Н.В., Кондакова И.В. и др. Метаболизм и рецепция эстрогенов при гиперпластических процессах и раке эндометрия/под ред. проф. Л.А. Коломиец. -Томск: НТЛ, 2007. -188 с.
- Коломиец Л.А., Бочкарева Н.В., Чернышова А.Л. Рак эндометрия и метаболический синдром. -Томск: Иван Федоров, 2010. -228 с.
- Минько Б.А. Диагностические возможности современных ультразвуковых методик в онкоурологии и онкогинекологии//SonoAce-International. -2006. -№ 15. -С. 35-41.
- Никитин Ю.М., Труханова А.И. Ультразвуковая доплеровская диагностика в клинике. -Иваново: Изд-во МИК, 2004. -496 с.
- Озерская И.А. Эхография в гинекологии. -М.: Медика, 2005. -292 с.
- Подзолкова Н.М., Кузнецова И.В., Глазкова О.Л. Клиническая гинекология: учеб. пособ. -М.: Медицинское информационное агенство, 2009. -616 с.
- Прокоп М., Галански М. Спиральная и многослойная компьютерная томография/под ред. А.В. Зубарева, Ш.Ш. Шотемора. -М.: МЕДпресс-информ, 2007. -Т. 2. -С. 410.
- Пронин С.М., Новикова Е.Г. Диагностика и лечение начального рака эндометрия//Российский онкологический журнал. -2007. -№ 3. -С. 19-20.
- Табакман Ю.Ю. Рак эндометрия: руководство для врачей. -М.: Практическая медицина, 2009. -172 с.
- Чернышова А.Л., Коломиец Л.А., Бочкарева Н.В. Рак эндометрия у больных с метаболическим синдромом. -Saarbrucken (Germany): Lambert Academic Pudlishing, 2011. -267 с.


