Возможности поддержания митохондриального аппарата при гипоксии субстратами энергетического обмена
Автор: Ашастин Б.В.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 42 (301), 2012 года.
Бесплатный доступ
В гипоксических условиях высокая степень восстановленности NАД(Ф)Н препятствует окислению любого NАД-зависимого субстрата, при этом окисление сукцината остается на высоком уровне благодаря сохранению большей окисленности флавинов в дыхательной цепи митохондрий. Эксперимент, поставленный на препаратах гомогената печени крыс и митохондриальных суспензиях, показал, что в условиях пониженного рО 2 преимущество сукцината над NАД-зависимыми субстратами более выражено, чем в условиях «нормоксии», что дает предпосылки для использования экзогенного сукцината для коррекции гипоксии и метаболического ацидоза.
Гипоксия, субстраты, митохондрии, дыхательная цепь
Короткий адрес: https://sciup.org/147153015
IDR: 147153015 | УДК: 612.017.1
Текст научной статьи Возможности поддержания митохондриального аппарата при гипоксии субстратами энергетического обмена
Метаболический ацидоз является атрибутом многих экстремальных физиологических и патологических состояний, в частности, связанных со значительной активацией процессов, потребляющих энергию, с нарушением функций митохондрий, недостаточным снабжением тканей кислородом, избыточным окислением липидов при голодании или сахарном диабете. Особое значение приобретает метаболический ацидоз в условиях интенсивной мышечной работы. Ряд исследователей (L. Kaijser; J. Karlsson и др.) считают, что метаболический ацидоз является основным фактором, ответственным за утомление и ограничение работоспособности при физических нагрузках. В одной из своих работ ( in vitro ) мы показали, что с помощью экзогенных субстратов, окисляющихся в митохондриях, можно существенно уменьшить степень метаболического ацидоза, обусловленного активацией АТФ-аз, которая в свою очередь является обязательным атрибутом любой интенсивной нагрузки [1]. Однако в условиях целостного организма интенсивная нагрузка, как правило, сопряжена с развитием рабочей гипоксии. Причина рабочей гипоксии заключена в высокой активности окислительно-восстановительных процессов, протекающих в митохондриях. Кислородный дефицит обусловлен тем, что при интенсивной работе потребление кислорода превышает скорость его доставки. Поэтому вопрос об увеличении вклада митохондрий в энергопродукцию не может быть решен просто путем увеличения подачи субстратов окисления непосредственно в цикл трикарбоновых кислот, минуя гликолиз, без учета возможности окисления этих субстратов в гипоксических условиях.
В модельных экспериментах на изолированных митохондриях, гомогенате, перфузируемом органе нами было показано, что наиболее высокой противоацидотической активностью обладает сукцинат. Несмотря на то, что при его окислении термодинамическая эффективность окислительного фосфорилирования меньше, чем при окислении NАД-зависимых субстратов (коэффициент АДФ/О при окислении сукцината равен двум, а при окислении NАД-зависимых субстратов – трем), за счет того что скорость его окисления существенно выше, чем у других субстратов цикла, мощность процесса генерации трансмембранного потенциала, столь велика, что обеспечивает более высокую скорость как фосфорилирования, так и других энергозависимых реакций, например обратного переноса электронов, поддерживающего более высокую степень восстановленности NАДН и NАДФН, чем при окислении NАД(Ф)-зависимых субстратов.
Однако меньшая термодинамическая эффективность и высокая скорость потребления кислорода при окислении сукцината казалось бы несовместима с условиями кислородного дефицита. При гипоксии кислород должен расходоваться более экономично, а добавка экзогенного сукцината должна увеличивать кислородный дефицит и снижать энергетический выход фосфорилирующего дыхания. В связи со сказанным энергетические преимущества окисления сукцината, выявленные при нормоксии (а реально in vitro при гипероксии), становятся совсем не очевидными при гипоксии. Хотя имеющиеся в литературе данные дают основание полагать, что при гипоксии может складывается ситуация, более благоприятная для окисления сукцината, чем для окисления NАД-зависимых субстратов. Суть этой ситуации заключается в следующем.
Даже в гипероксических условиях эксперимента in vitro, когда парциальное давление кислорода в инкубационной среде достигает 150 мм рт. ст., в изолированных митохондриях степень восста-новленности NАД(Ф)Н существенно выше, чем степень восстановленности флавинов и тем более цитохромов (табл. 1). Эти различия, возможно, обусловлены не только тем, что NАД и NАДФ более удалены от кислорода, чем флавины и цитохромы, но и кинетическими особенностями организации дыхательной цепи. В частности тем, что на пути восстановительных эквивалентов от первого комплекса расположен наиболее медленный переносчик – коэнзим Q, пул которого существенно больше, чем пул других коферментов, и на его уровне возможно перераспределение и торможение потока восстановительных эквивалентов.
При уменьшении парциального давления кислорода наблюдается еще более значительное увеличение степени восcтановленности пиридиннук-леотидов, по сравнению с другими переносчиками в дыхательной цепи. Это было показано на перфузируемой печени в лаборатории Б. Чанса и на срезах головного мозга в лаборатории Л.Д. Лукьяновой. Фактически пиридиннуклеотиды целиком восстановлены, а флавины еще частично окислены.
Исходя из анализа такого рода редокс сдвигов в дыхательной цепи, мы предположили, что в гипоксических условиях высокая степень, восстанов-ленности NАД(Ф)Н должна препятствовать окислению любого NАД-зависимого субстрата при том, что окисление сукцината, дегидрогеназа которого является флавин-зависимым ферментом, может оставаться на высоком уровне благодаря сохранению большей окисленности флавинов в дыхательной цепи. Е.И. Маевским были получены косвенные свидетельства того, что сукцинат легче окисляется при гипоксии, или по крайней мере окисляется быстрее, чем воспроизводится из NАД-зависимых субстратов, поскольку его концентрация в условиях острой гипоксической гипоксии в ткани печени может снижаться в 2 раза [4]. В подобных же экспериментах М.С. Волковым показано, что при гипоксической гипоксии наблюдалось увеличение концентрации всех остальных интермедиатов цикла трикарбоновых кислот, что свидетельствует скорее всего о торможении их окисления.
R.W. Von Korff промерил изменение концентраций субстратов цикла Кребса на изолированных митохондриях сердца кролика в разных метаболических состояниях, в частности в 3 и 4 состояниях по Чансу – Вильямсу, отличающихся, прежде всего, разной степенью восстановленности дыхательных переносчиков, как это видно из данных табл. 1. Так в 3 состоянии они практически полностью окислены, тогда как в 4 состоянии восстановлены, причем степень восстановленности NАДН в 4 состоянии достигает 99 %.
Итак, R.W. Von Korff показал, что в 3 состоянии происходит уменьшение стационарных концентраций всех NАД-зависимых субстратов и прирост концентрации сукцината, а в 4 состоянии при более высокой восстановленности NАД(Ф)Н возрастает концентрация всех NАД-зависимых субстратов, но уменьшается концентрация сукцината. Если полагать, что 3 и 4 состояние с точки зрения изменения редокс состояния переносчиков дыхательной цепи моделируют соответственно нормоксическое и гипоксическое состояние, то можно полагать, что при нормоксии лучше окисляются NАД-зависимые субстраты, а при гипоксии предпочтение имеет сукцинат. При этом еще следует иметь в виду, что сукцинатдегидрогеназа (СДГ) чрезвычайно чувствительна к редокс состоянию пиридиннуклеотидов, железосерного комплекса и коэнзима Q (СДГ активируется при росте степени восстановленности этих переносчиков и ингибируется при их окислении) [2]. Более того, конкурентный ингибитор СДГ – щавелевоук-сусная кислота может накапливаться только при высокой степени окисленности NАД, поскольку является высоко электронофильным соединением и легко восстанавливается до малата при малейшем росте восстановленности NАДН. Очевидно, именно уменьшением величины щавелевоуксусно-го торможения СДГ при росте восстановленности NАДН обусловлено повышение скорости дыхания, в частности окисления сукцината митохондриями,
Таблица 1
Метаболические состояния митохондрий по Чансу – Вильямсу
[B. Chance, G.R. Williams, 1955]
|
Характеристика состояния |
Степень восстановленности дыхательных переносчиков в стационарном состоянии, % |
||||||||
|
[O 2 ] в % |
[AДФ] |
[Cубстрат] |
VO 2 |
Ограничитель дыхания |
Цитохромы |
ФП |
ПН |
||
|
а |
с |
b |
|||||||
|
100 |
Низкая |
Низкая |
Малая |
AДФ |
0 |
7 |
17 |
21 |
90 |
|
100 |
Высокая |
0 |
Малая |
Субстрат |
0 |
0 |
0 |
0 |
0 |
|
100 |
Высокая |
Высокая |
Большая |
Дых. цепь |
4 |
6 |
16 |
20 |
53 |
|
100 |
Низкая |
Высокая |
Малая |
АДФ |
0 |
14 |
35 |
40 |
99 |
|
0 |
Высокая |
Высокая |
0 |
O 2 |
100 |
100 |
100 |
150 |
100 |
Примечание. Квадратными скобками обозначены концентрации веществ; VO 2 – скорость дыхания.
выделенными после гипоксии. По крайней мере величина щавелевоуксусного торможения сукцинат-зависимого дыхания митохондрий печени, сердца и коркового слоя почек, после перенесения животными острой гипоксической гипоксии, резко уменьшалась [3].
Таким образом, наш собственный опыт и анализ литературного материала свидетельствуют о том, что в условиях гипоксии можно было бы ожидать преобладание окисления сукцината как в связи с торможением окисления NАД-зависимых субстратов, так и в связи с повышением активности СДГ при восстановлении удаленных от кислорода участков дыхательной цепи. Однако прямые экспериментальные доказательства такого сдвига в соотношение скоростей окисления NАД-зависимых субстратов и сукцината до настоящего времени не были получены.
Мы подошли к исследованию этого вопроса, используя различия в окислении таких NАД-зави-симых субстратов, как пируват и α -кетоглутарат с одной стороны, и сукцинат – с другой. Пируват и α -кетоглутарат в процессе окисления подвергаются окислительному декарбоксилированию, то есть одновременно идут дегидрирование – поставка водорода в дыхательную цепь и образование СО 2 , тогда как окисление сукцината – это только дегидрирование. Можно было полагать, что измерение отношения освобождающегося СО 2 к количеству потребляемого кислорода, то есть величины дыхательного коэффициента RQ = Δ СО 2 / Δ О 2 позволит определить какой субстрат окисляется: подвергающийся окислительному декарбоксилированию (пируват или α -кетоглутарат) или только дегидрирующийся сукцинат. В первом случае теоретически величина дыхательного коэффициента должна приближаться к единице ( Δ СО 2 = Δ О 2 ), а во втором случае должна быть равной нулю ( Δ СО 2 = 0).
В физиологических условиях на уровне целостного организма по данным научной литературы величина дыхательного коэффициента (RQ) не падает, по крайней мере, в покое ниже 0,8. При этом считается, что величина RQ зависит от того, какой из основных видов субстратов – углеводы, жиры или белки преимущественно окисляются в момент измерения.
Очевидно, что окисление глюкозы
С6Н12О6 + 6О2 → 6СО2 + 6Н2О дает величину дыхательного коэффициента равную 1: RQ = 6 СО2/6 О2.
Тогда как при окислении жирных кислот, например пальмитиновой,
С 18 Н 34 О 2 + 25,5 О 2 → 18СО 2 + 17Н 2 О величина RQ = 18 СО 2 / 25,5 О 2 составит около 0,71.
При окислении аминокислот величина дыхательного коэффициента может существенно варьировать в зависимости от вида окисляющейся аминокислоты, но если учитывать, что количественно в энергетическом обмене преобладает окисление глутаминой, аспарагиновой – дикарбоновых аминокислот, а также аланина и глутамина, то ясно, что величина RQ для аминокислот в среднем составит не менее 1,0.
При гипоксии обычно наблюдают повышение величины дыхательного коэффициента, обусловленное тем, что в кровоток поступают недоокис-ленные продукты обмена веществ, которые нейтрализуются бикарбонатной буферной системой
НА (кислота-метаболит) + NaНСО 3 → NaA + + Н 2 СО 3 .
В результате образуется угольная кислота, которая в легочных капиллярах под влиянием карбоангидразы превращается в СО 2 и Н 2 О. Вследствие этого падает бикарбонатная буферная емкость плазмы крови и выход СО 2 может существенно превышать потребление кислорода. Таким образом, величина дыхательного коэффициента в зависимости от вклада бикарбонатной буферной системы в нейтрализацию органических кислот может возрастать до 2–2,5.
Для того чтобы исключить вклад бикарбонат-ной буферной системы в изменение величины RQ, мы провели исследование совместно с доктором биологических наук А.М. Зякуном (ИБФМ РАН) кратковременной гипоксии, когда выход недоокис-ленных продуктов из ткани в кровоток не успевает повлиять на рН плазмы крови. Кратковременную гипоксию вызывали внезапной 45–60-секундной задержкой дыхания на уровне спокойного вдоха. Во время короткого нефорсированного выдоха собирали 250 мл воздуха и в нем определяли масс-спектрометрически изменение содержания СО2 и О2 относительно вдыхаемого воздуха. Исследование выполнено на здоровых добровольцах, больных диабетом и ожирением, в покое и после аэробной физической нагрузки, натощак и на фоне глюкозной нагрузки. Во всех перечисленных случаях кратковременная задержка дыхания сопровождалась падением величины RQ от 0,9–1,0 до 0,5–0,45. Столь резкое падение RQ нельзя объяснить связыванием СО 2 гемоглобином в виде карбаминогемог-лобина, поскольку гемоглобин может связывать не более 10 % углекислоты.
Такое падение RQ позволяет предположить, что в условиях организма может происходить очень быстрая смена окисляющихся субстратов, или, по крайней мере, уменьшение доли субстратов, подвергающихся декарбоксилированию при уменьшении доставки кислорода. Едва ли это может быть объяснено активацией гликолиза.
Как показано на рисунке, для падения RQ необходимо, чтобы поступление восстановительных эквивалентов в дыхательную цепь шло через малат-аспартатный или α -глицерофосфатный шунт (3) из гликолитической оксидоредукции или через флавин-зависимую сукцинатдегидрогеназу, и не сопровождалось одновременным декарбоксилированием. В этом случае надо исключить из рассмотрения анаэробную дисмутацию α -кетоглута-рата (5), являющаяся одновременно источником
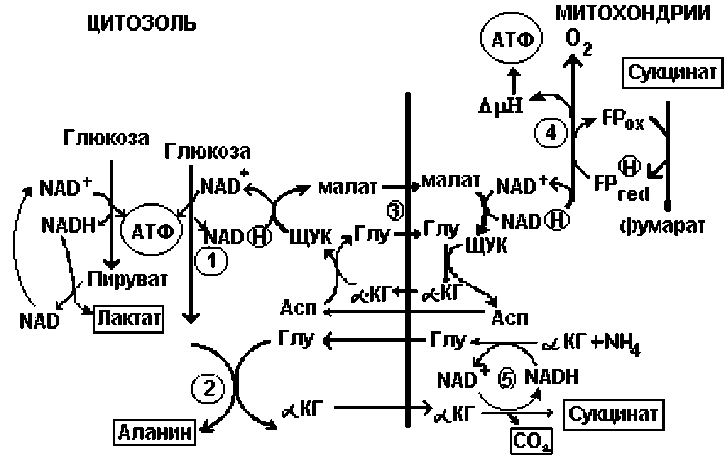
NAD
ЦИТОЗОЛЬ
Сукцинат малат— rMafiaL,NAD+^
FP.
NAD+.
NAD
^ NAD (fl)
NADH-'
4jAD
АТФ
ЩУК
ЛКГ+ -^КГ
ЛКГ
^КГ
* Сукцинат
| Аланин |
Пируват ^Лактат]
Acn *
Глу *
Глюкоза Глюкоза red фумарат
Асп
Глу-^^-^КГ^Н^
NAD* ® NADH
-—- МИТОХОНДРИИ АТф) О2
ЩУК ЛГлу- *ГлУ
Схема возможного вклада гликолитической оксидоредукции в падение дыхательного коэффициента за счет поставки цитозоль-митохондриальными шунтами части восстановительных эквивалентов в дыхательную цепь при гипоксической активации гликолиза без участия субстратов цикла трикарбоновых кислот в энергопродукции: 1 – гликолиз; 2 – переаминирование пирувата; 3 – малат-аспартатный шунт; 4 – дыхательная цепь митохондрий; 5 - дисмутация а -кетоглутарата - единственный на схеме источник углекислого газа
СО 2 и сукцината. Без учета дисмутации величина RQ может приближаться к нулю. Поставка водорода в дыхательную цепь из гликолиза в случае высокой степени восстановленности NАДН может идти только через а -глицерофосфатный шунт, дегидрогеназа которого в митохондриях является флавин-зависимым ферментом. В последнем случае на уровне организма может иметь место кратковременное резкое падение RQ.
Таким образом, наиболее приемлемым, на наш взгляд, может быть предположение о том, что при задержке дыхания происходит быстрое, обусловленное изменением степени восстановленности дыхательных переносчиков, увеличение доли окисления флавин-зависимых субстратов, которые не подвергаются декарбоксилированию, сукцинат, эфиры КоА-жирных кислот и а -глицерофосфат, в том числе в качестве участника шунта для активированного гликолиза.
В любом случае следовало проверить экспериментально, как меняется величина RQ и соотношения окисления пирувата и сукцината на изолированных тканевых препаратах, гомогенате и митохондриях, при изменении степени оксигенации и степени восстановленности переносчиков дыхательной цепи in vitro .
Методика исследования. Эксперименты были выполнены в многоэлектродной ячейке, скорость потребления кислорода измеряли полярографическим закрытым Кларковским электродом, а скорость образования СО2 – СО2-чувствитель-ным электродом. Состояние окислительного фосфорилирования оценивали по параметрам дыхательного контроля (величине отношения АДФ/О), определяемым полярографически, а также по скорости и величине изменений концентрации ионов водорода при фосфорилировании добавленного АДФ (регистрация рН-чувствитель-ным электродом) и по изменению распределения липофильного катиона тетрафенилфосфония (ТФФ+) между митохондриями и внемитохондриальной средой. Распределение ТФФ+ регистрировали ТФФ+-чув-ствительным электродом, что позволяло оценивать энергозависимую генерацию электрохимического трансмембранного потенциала на внутренней мембране митохондрий.
Обсуждение результатов и выводы. Первые же исследования, выполненные на гомогенате и на непромытых митохондриях печени крысы, показали, что величины RQ существенно зависят от вида экзогенного субстрата, метаболического состояния и используемого тканевого препарата (табл. 2).
RQ = VCO2/VO2; RQ3 и RQ4 – соответственно величины RQ в 3 и 4 метаболических состояниях по Чансу – Вильямсу; концентрация митохондрий 3 мг белка на мл, концентрации добавленных субстратов – 4 мМ. Среда инкубации: 125 мМ КCl, 1 mM MgSО 4 , 3 mM KH 2 PO 4 , 0,5 mM ЭГТА, рН 7,2.
Добавка АДФ - 170 мкМ. Температура 28 ° С. Объем инкубационной ячейки 2 мл. Исходное рО 2 – 150 мм рт. ст.
Анализ приведенных в табл. 2 данных свидетельствует о том, что регистрируемые в эксперименте величины RQ значительно отличаются от теоретически ожидаемых. В частности, сукцинат, малат, а -глицерофосфат и Р -оксибутират в процессе окисления не подвергаются декарбоксилированию, поэтому величина RQ должна быть
Таблица 2
Изменение величины дыхательного коэффициента (RQ) при окислении различных субстратов гомогенатом и митохондриями печени крысы
|
Окисляющиеся субстраты (4 мМ) |
Гомогенат |
||
|
RQ 3 |
RQ 4 |
||
|
Декарбоксилирующиеся субстраты |
Глюкоза |
0,97 |
1,21 |
|
Пируват |
1,80 |
1,20 |
|
|
α -кетоглутарат |
1,42 |
2,80 |
|
|
Недекарбоксилирующиеся субстраты |
Сукцинат |
0,18 |
0,60 |
|
Малат |
0,30 |
0,62 |
|
|
β -оксибутират |
0,43 |
0,84 |
|
|
α -глицерофосфат |
0,34 |
0,39 |
|
|
Эндогенные |
0,81 |
0,92 |
|
при окислении избытка этих субстратов бесконечно малой. Напротив, при окислении α -кетоглутарата и пирувата величина RQ должна быть на уровне 2,0, так как эти субстраты подвергаются окислительному декарбоксилированию. Однако окисление интермедиатов цикла Кребса, образующихся из экзогенных субстратов, может давать некий вклад в потребление О 2 и образование СО 2 , что и обеспечивает отличие экспериментальных параметров от теоретически ожидаемых. Кроме того, сказываются вклад эндогенных субстратов и множественность путей включения экзогенных субстратов в различные метаболические превращения наряду с непосредственным участием в окислительно-восстановительных реакциях. Зафиксировано наличие четкой разницы для многих субстратов в величинах RQ в 3 и 4 состояниях по Чансу – Вильямсу. Ранее подобные сдвиги RQ в зависимости от метаболического состояния никем не описывались.
Если исходить из развиваемых представлений о том, что сукцинат может монополизировать дыхательную цепь, то следует признать, что в условиях пониженного рО2 или просто в 4 состоянии, когда повышена степень восстановленности NАДН, преимущество сукцината над NАД-зависимыми субстратами более выражено, чем в условиях «нор-моксии». Таким образом, полученные результаты позволяют предположить, что в условиях целостного организма экзогенный сукцинат способен уменьшить симптомы гипоксии. При этом возможна нормализация ацидотического сдвига и улучшение общего состояния организма за счет поддержания функций митохондрий.
Список литературы Возможности поддержания митохондриального аппарата при гипоксии субстратами энергетического обмена
- Анаэробное образование сукцината и облегчение его окисления -возможные механизмы адаптации клетки к кислородному голоданию/Е.И. Маевский, Е.В. Гришина, А.С. Розенфельд и др.//Биофизика. -2000. -Т. 45, № 3. -С. 509-513.
- Виноградов, А.Д. Измерение активности сукцинатдегидрогеназы/А.Д. Виноградов//Реакции живых систем и состояние энергетического обмена: сб. науч. тр. -Пущино, 1979. -С. 98-125.
- Кондрашова, М.Н. Введение/М.Н. Кондрашова//Регуляция энергетического обмена и устойчивость организма: сб. науч. тр. -Пущино, 1975. -С. 3-21
- Сукцинат -продукт анаэробных превращений и гипоксический субстрат/Е.И. Маевский, Е.В. Гришина, А.С. Розенфельд и др.//Материалы второй Всероссийской конференции «Гипоксия, механизмы, адаптация, коррекция». -М., 1999. -С. 43-44.


