Выбор ферментного препарата для получения маннозосодержащих гидролизатов с пребиотической активностью
Автор: Радиф З.Х., Анохина Е.П., Корнеева О.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология и бионанотехнология
Статья в выпуске: 3 (73), 2017 года.
Бесплатный доступ
Манноза и манноолигосахариды обладают рядом функциональных свойств, что подтверждает необходимость исследования их получения. Манноза, являясь незаменимым углеводным компонентом иммуноглобулинов, проявляет противовоспалительные, пребиотические, иммуностимулирующие свойства и может быть использована для профилактики и лечения различных патологических состояний. Манноолигосахариды обладают пребиотической и антиоксидантной активностью. Потенциальный источник маннозы и манноолигосахаридов - маннаны растительного сырья, ферментативная обработка которых является перспективным и экологически безопасным способом их получения. В качестве растительного сырья для выделения маннанов выбрана древесина ели обыкновенной. Было исследовано влияние дозировки ферментных препаратов β-маннаназыВ. subtilis и Tr. harzianum и продолжительности гидролиза на эффективность гидролиза маннанов древесины ели обыкновенной. Установлены рациональные параметры процесса гидролиза маннанов для β-маннаназ различного происхождения. Для β-маннаназы В. subtilis оптимальными параметрами являются дозировка ферментного препарата 10 ед/г, продолжительность 3 ч, температура 35 °С, рН 7.0. Для β-маннаназы Tr. harzianum - дозировка ферментного препарата 15 ед/г, продолжительность 4 ч, температура 60 °С, рН 4.5. Была исследована способность маннозосодержащих гидролизатов, полученных при ферментативном гидролизе маннанов, стимулировать развитие бифидобактерий in vitro в сравнении с инулином Raftiline и маннозой. Изученные гидролизаты обладали выраженной способностью стимулировать рост бифидобактерий на протяжении всего процесса культивирования, сопоставимой с активностью признанного стимулятора роста бифидобактерий инулина. Однако гидролизаты, полученные под действием β-маннаназы В. subtilis, проявляли более выраженную пребиотическую активностью по сравнению с гидролизатами, полученными при гидролизе маннанов β-маннаназой Tr. harzianum. Таким образом, высокая каталитическая способность β-маннаназы В. subtilis расщеплять маннаны древесины ели и более выраженная способность гидролизатов стимулировать рост бифидобактерий делают предпочтительным использование этого фермента для получения маннозосодержащих гидролизатов из хвойной древесины.
Маннан, хвойная древесина, β-маннаназа, гидролиз, манноза, манноолигосахариды, пребиотическая активность
Короткий адрес: https://sciup.org/140229852
IDR: 140229852 | DOI: 10.20914/2310-1202-2017-3-159-163
Текст научной статьи Выбор ферментного препарата для получения маннозосодержащих гидролизатов с пребиотической активностью
В последние годы особый интерес вызывают минорные сахара и их полимеры: манноза и манноолигосахариды. Манноза является незаменимым углеводным компонентом иммуноглобулинов и других биологически активных веществ, обладает пребиотическим действием [1]. Исследования показали, что этот углевод выполняет важную роль в живом организме [2, 3], и может быть использован для профилактики и лечения урологических инфекций [4], диабета [5] и углевод-дефицитных гликопротеиновых синдромов I и II типов [6].
Манноолигосахариды наряду с маннозой обладают пребиотической активностью [7], а также проявляют антиоксидантную активность [8].
Манноза в виде гомогенных или гетерогенных полисахаридов входит в состав клеточных стенок растений и некоторых дрожжей. Наиболее перспективным и экологически безопасным способом получения маннозы и манноолигосахаридов является ферментативный гидролиз маннанов клеточных стенок растений.
Ферментами, гидролизующими внутренние β-1,4-гликозидные связи в маннанах, являются β-маннаназы. Ранее получены β-маннаназы грибного и бактериального происхождения, способные расщеплять гликозидные связи в маннанах, но обладающие разными физикохимическими свойствами и специфичностью к гидролизуемой связи.
Цель данного исследования состояла в подборе ферментного препарата β-маннаназы для получения маннозосодержащих гидролизатов с пребиотической активностью из растительного сырья.
Объекты и методы исследования
Объектами исследования служили спиртоосажденные ферментные препараты: рекомбинантная β-маннаназа В. subtilis с активностью 72000 ед/г и β-маннаназа Tr. harzianum с активностью 2100 ед/г.
Выделение маннанов из растительного сырья проводили по описанной методике [9].
Для определения степени гидролиза маннанов реакционную смесь, состоящую из 200 мкл 1 % раствора субстрата в соответствующем буфере и 100 мкл раствора фермента разной концентрации, выдерживали при оптимальной температуре действия фермента в течение 5 часов. Через каждый час в реакционной смеси определяли редуцирующие сахара по методу Сомоджи-Нельсона [10], по количеству которых рассчитывали степень гидролиза маннанов.
Для изучения пребиотических свойств маннозосодержащих гидролизатов in vitro проводили культивирование бактерий Bifidobacterium bifidum .
Коммерческий препарат «Бифидобактерин сухой» предварительно растворяли и активизировали в питательной среде Блаурокка при температуре 37 °С в течение 24 ч. Его вносили в подготовленные для культивирования питательные среды в количестве 5 доз на 1 л среды.
Выращивание бифидобактерий проводили в анаэробных условиях при температуре 37 0С на среде Блаурокка (г/л): пептон - 10; NaCl - 5; агар-агар - 0,75; лактоза - 10; цистеин солянокислый - 0,1; печеночный отвар, рН 7,5. Для определения бифидогенной активности различных углеводов в питательную среду вместо лактозы вносили инулин, маннозу, маннозосодержащие гидролизаты.
Накопление биомассы бифидобактерий оценивали по оптической плотности суспензии бактерий при длине волны 590 нм [11].
Результаты и обсуждение
Маннаны – полисахариды, состоящие преимущественно из остатков D-маннозы. Также в состав маннанов различной структуры входят глюкоза и галактоза. Маннаны входят в состав гемицеллюлоз клеточных стенок растений. По литературным данным содержание гемицеллюлозы в твердой древесине составляет 10 %, а в древесине мягких пород - 25 %. Наиболее перспективным растительным сырьем, содержащим гемицеллюлозную фракцию, богатую маннанами, является древесина хвойных пород деревьев. Содержание маннанов в древесине хвойных деревьев представлено в таблице 1.
Таблица 1.
Содержание маннанов в древесине хвойных пород деревьев
Table 1.
The mannans content in softwood wood
|
Растение The pant |
Содержание маннанов, % The mannans content, % |
Соотношение углеводов в маннане The ratio of carbohydrates in mannan |
|
Ель обыкновенная | Common spruce |
11 |
МАН:ГЛЮ 3,7:1 MAN: GLU 3,7:1 |
|
Сосна | Pine |
12 |
МАН:ГЛЮ:ГАЛ 1,7:1:0,26 MAN:GLU:GAL 1,7:1:0,26 |
|
Кедр сибирский | Siberian cedar |
9,8 |
МАН:ГЛЮ 3,5:1 MAN: GLU 3,5:1 |
|
Туга канадская | Canadian tuga |
6,2 |
МАН:ГЛЮ:ГАЛ 3:1:0,1 MAN:GLU:GAL 3:1:0,1 |
Так, наибольшее количество маннанов находится в древесине сосны и ели обыкновенной (12 и 11 % соответственно), однако в древесине ели соотношение маннозы и глюкозы составляет 3,7:1, следовательно, ферментативный гидролиз маннанов такой структуры позволит получить высокий выход маннозы. Таким образом, ель обыкновенная является перспективным источником маннанов для получения маннозосодержащих гидролизатов. Кроме того отходы древесного производства являются широко доступными, что значительно удешевит производство маннозы в промышленных масштабах.
Был исследован процесс гидролиза маннанов древесины ели обыкновенной спиртоосажденными ферментными препаратами β-маннаназы В. subtilis и Tr. harzianum при оптимальных условиях действия ферментов: рН 7,0 и 35°С и рН 4,5 и 60°С соответственно.
Эффективность ферментативного гидролиза полимеров зависит от ряда факторов, важными из которых являются дозировка ферментного препарата и продолжительность гидролиза.
На рисунке 1 представлена зависимость степени гидролиза глюкоманнана от дозировки ферментного препарата β-маннаназы В. subtilis . Фермент вносили в количестве 5-15 ед/г маннанов. При дозировке фермента 5 ед/г субстрата степень гидролиз составила 60 % за 3 ч. Увеличение количества фермента до 10 ед/г субстрата обеспечивало максимальную степень деструкции глюкоманнана – 88 % за 3 ч гидролиза. Более высокая дозировка фермента и увеличение продолжительности процесса не способствовали значительному увеличению степени гидролиза.
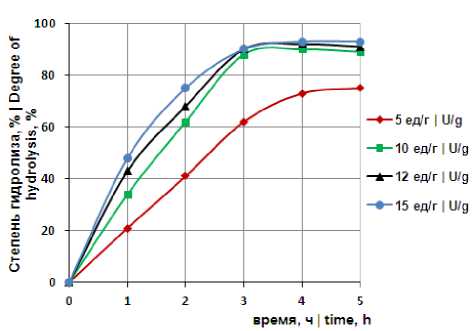
Рисунок 1. Зависимость степени гидролиза глюкоманнана от концентрации β-маннаназы В. subtilis (ед/г глюкоманнана) при температуре 35 ºС и рН 7,0
-
Figure 1. The dependence of the degree of hydrolysis of glucomannan on the concentration of β-mannanase B. subtilis (U / g glucomannan) at 35 ºC and pH 7.0
Динамика ферментативной деструкции маннанов при разной концентрации ферментного препарата β-маннаназы Tr. harzianum представлена на рисунке 2. Ферментный препарат вносили в количестве 5-25 ед/г маннанов. Количество фермента 5 ед/г субстрата обеспечивало гидролиз на 58 % за 4 ч. При увеличении концентрации фермента до 10 ед/г степень гидролиза за это время составила около 70 %. Дозировка 15 ед/г обеспечивала максимальную степень деструкции маннанов – 90 %. Более высокая концентрация фермента не способствовала значительному увеличению степени гидролиза.
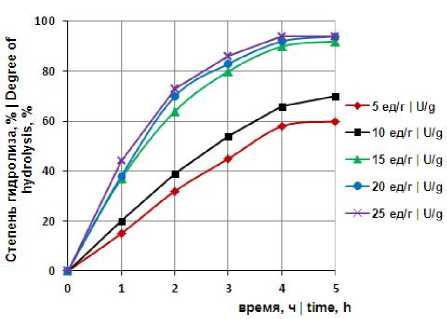
Рисунок 2. Зависимость степени гидролиза глюкоманнанов от концентрации β-маннаназы Tr. harzianum (ед/г глюкоманнанов) при температуре 60 0С и рН 4,5
-
Figure 2. The dependence of the degree of hydrolysis of glucomannan on the concentration of β-mannanase Tr. harzianum (U / g glucomannan) at 60 ºC and pH 4,5
Таким образом, были установлены рациональные параметры процесса гидролиза маннанов ели обыкновенной для β-маннаназ различного происхождения. Для β-маннаназы В. subtilis оптимальными параметрами являются дозировка ферментного препарата 10 ед/г, продолжительность 3 ч, температура 35 °С, рН 7,0. Для β-маннаназы Tr. harzianum - дозировка ферментного препарата 15 ед/г, продолжительность 4 ч, температура 60 °С, рН 4,5.
В результате гидролиза маннанов β-манна-назами различного происхождения образуются различные конечные продукты: манноолигосахариды различной молекулярной массы и манноза.
Известно, что маннозосодержащие гидролизаты обладают пребиотическими свойствами, поэтому была исследована способность маннозосодержащих гидролизатов, полученных при оптимальных условиях гидролиза β-маннаназами В. subtilis и Tr. harzianum , стимулировать развитие бифидобактерий. Исследование активности гидролизатов, как единственного источника углерода в питательной среде для бифидобактерий, проводили в сравнении с инулином Raftiline и маннозой. Контролем служила среда с лактозой.
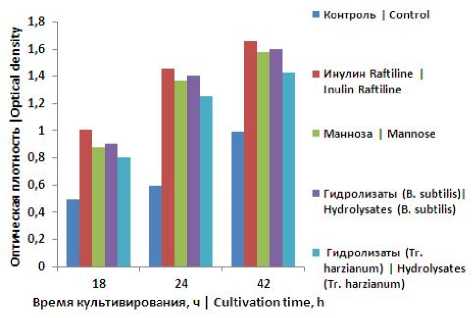
Рисунок 3. Накопление биомассы бифидобактерий при культивировании на средах с маннозосодержащими гидролизатами
-
Figure 3. The accumulation of biomass of bifidobacteria during cultivation on media with mannose-containing hydrolysates
Из представленных данных видно, что изученные гидролизаты обладают выраженной способностью стимулировать рост бифидобактерий
Список литературы Выбор ферментного препарата для получения маннозосодержащих гидролизатов с пребиотической активностью
- Korneeva O. S, Cheremushkina I. V, Glushchenko A. S, Mikhaĭlova N. A. et al. Prebiotic properties of mannose and its effect on specific resistance//Zh Mikrobiol Epidemiol Immunobiol. 2012. № 5. P. 67-70.
- Sharma V., Ichikawa M., Freeze H. H. Mannose metabolism: more than meets the eye//Biochem Biophys Res Commun. 2014. V. 453. № 2. P. 220-228 DOI: 10.1016/j.bbrc.2014.06.021
- Fekete F., Fadgyas B., Papp É., Szilágyi Á. et al. The role of mannose binding lectin on fever episodes in pediatric oncology patients//Pathol Oncol Res. 2016. V. 22, № 1, Р. 139-143 DOI: 10.1007/s12253-015-9992-x
- Kranjčec B., Papeš D., Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial//World J Urol. 2014, V. 32, № 1, Р. 79-84 DOI: 10.1007/s00345-013-1091-6
- Пат. 2097041, RU, С1 A61K 31/70. Способ лечения сахарного диабета/Чепурной И.П., Больбат К.Э.; заявитель и патентообладатель Чепурной И.П. № 94042023/14; Заявл. 22.11.1994.;Опубл. 27.11.1997.
- Martín Hernández E., Vega Pajares A.I., Pérez González B., Ecay Crespo M.J. et al. Congenital disorder of glycosylation type 1b. Experience with mannose treatment//An Pediatr (Barc). 2008, V. 69, № 4, Р. 358-365.
- Anokhina E. P., Shuvaeva G. P., Radif Z. K., Korneeva O. S. Investigation of the prebiotic properties of mannose-containing hydrolysates//International Journal of Probiotics and Prebiotics. 2016, V. 11, № 3/4, P. 137-140.
- Черенков Д.А., Анохина Е.П., Кирьянова С.В., Корнеева О.С. Антиоксидантная активность продуктов гидролиза природных полимеров (маннана и фукоидана)//Вестник Воронежского государственного университета инженерных технологий. 2012. № 1. С. 151-153.
- Пат. 2392332, RU, C1 C13K13/00, A23L1/0528 Способ получения маннанов из растительного сырья/Корнеева О.С., Глущенко А.С., Черемушкина И.В., Черенков Д.А., Слепокуров А.А. № 2008149923/13; Заяв. 18.12.2008; Опубл. 20.06.2010, Бюл. № 17.
- Полыгалина Г.В., Чередниченко В.С., Римарева Л.В. Определение активности ферментов. Справочник. М.: ДеЛи принт, 2003. 376 c.
- Санина Т.В., Кирьянова С.В., Черемушкина И.В., Корнеева О.С. Исследование бифидогенной активности фукозы и ее полимеров//Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. 2011. № 1. С. 141-143.


