Выделение и идентификация вируса эпизоотической диареи свиней при вспышке в крупном свиноводческом хозяйстве
Автор: Стрижакова О.М.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 4 т.48, 2013 года.
Бесплатный доступ
Эпизоотическая диарея свиней (ЭДС) характеризуется острым энтеритом и сильным поносом. Ее возбудитель относится к той же группе рода Сoronavirus семейства Сoronaviridae, что и вирусы трансмиссивного гастроэнтерита свиней (ТГС), коронавирус кошек, собак и человека 229Е. Начиная с 2005 года, на территории Российской Федерации регистрировали вспышки болезни, клинически схожей с трансмиссивным гастроэнтеритом свиней (ТГС) и вызывающей массовый падеж подсосных поросят (в некоторых случаях до 80 %). При этом свиноматки в неблагополучных хозяйствах были привиты против ТГС. Целью нашей работы было выделение в культуре клеток и идентификация инфекционного агента, ставшего причиной вспышек болезни с диарейным синдромом у свиней. Из патологического материала от больных поросят 3-5-суточного возраста выделен РНК-содержащий вирус, идентифицированный как вирус эпизоотической болезни свиней. Титр инфекционности вируса 5-го пассажа в культуре клеток Vero составлял 10 3,50 ТЦД 50/см 3. Выделенный вирус обозначили как изолят БС-08. К настоящему времени проведено 25 последовательных пассажей вируса в культуре клеток; срок проявления цитопатического действия составляет 24-48 ч, инфекционный титр — 10 4,75-10 5,50 ТЦД 50/см 3.
Эпизоотическая диарея свиней (эдс), патологический материал, выделение вируса, культуры клеток, цитопатический эффект
Короткий адрес: https://sciup.org/142133429
IDR: 142133429 | УДК: 636.4:619:616.98:578:57.083
Текст научной статьи Выделение и идентификация вируса эпизоотической диареи свиней при вспышке в крупном свиноводческом хозяйстве
Целью нашей работы было выделение в культуре клеток и идентификация инфекционного агента, ставшего причиной вспышек болезни с диарейным синдромом у свиней.
Методика. Материалом для исследования служили пробы патологического материала (кишечник, желудок, печень, почки, головной мозг) от вынужденно убитых и павших поросят 3-5-суточного возраста, полученные с сентября по декабрь 2008 года из свиноводческих хозяйств закрытого типа в западном регионе России. Для выделения возбудителя использовали перевиваемые линии культур клеток РК-15, CV-1, MA104 и Vero (предоставлены лабораторией культур клеток Всероссийского НИИ ветеринарной вирусологии и микробиологии — ВНИИВВиМ). В качестве ростовой применяли среду Игла с добавлением 10 % фетальной сы- воротки телят (ФСТ), пенициллина (100 ед/мл), стрептомицина (100 мкг/мл), амфотерицина В (2,5 ед/мл). Поддерживающей служила среда Игла без ФСТ с указанными антибиотиками и трипсином (5 мкг/см3). Для предварительной обработки гомогенатов патологического материала и культуральных материалов, полученных при пассировании, использовали среду Игла с антибиотиками и трипсином в концентрации 5, 10 и 20 и 40 мкг/см3.
Культуры клеток инкубировали при 37 ° С, после формирования монослоя (через 1-2 сут) ростовую среду удаляли, монослой 3-кратно промывали бессывороточной средой Игла и инокулировали суспензиями патологического материала или культуральным материалом, полученным при проведении пассажей. В культуру клеток вносили 5 см3 материала и инкубировали 60 мин при 37 ° С. Затем инокулят удаляли и во флаконы помещали поддерживающую среду Игла с трипсином (в концентрации 5 мкг/см3) или без трипсина. Инокулированные культуры инкубировали при 37 ° С в течение 5-6 сут (при слепых пассажах) либо до проявления цитопатического действия (ЦПД). После этого культуру замораживали, оттаивали, стерильно сливали во флаконы и хранили при - 70 ° С.
Тип нуклеиновой кислоты определяли по методу Майра с соавт. (1974). Чувствительность к воздействию хлороформа анализировали в соответствии с описанием Майра и Бегеля (1961).
Полимеразную цепную реакцию проводили с использованием коммерческой тест-системы «ЭДС» для выявления эпидемической диареи свиней методом ПЦР, кат. № VET-58-FRT-S(RG,iQ) серия 18.08.12 (производитель — ФБУН ЦНИИ эпидемиологии Роспотребнадзора, г. Москва) в соответствии с прилагаемыми рекомендациями.
Реакцию нейтрализации (РН) выполняли в микроварианте с применением 96-луночных культуральных планшетов («Corning», США). В лунки помещали по 100 мкл 2-кратных разведений (с 1:2 до 1:4096) нормальной, специфической и исследуемых сывороток в среде Игла с добавлением пенициллина (100 ед/мл), стрептомицина (100 мкг/мл) и амфотерицина В (2,5 ед/мл), затем по 100 мкл ростовой среды Игла, содержащей вирус в расчетной дозе 100 ЕД. Планшеты выдерживали в течение 1 ч при 37 ° С, после чего переносили образцы (смесь сыворотки с вирусом) в лунки планшетов с монослоем культуры клеток и инкубировали в течение 4-5 сут в атмосфере 5 % СО 2 при 37 ° С. В РН использовали референтные сыворотки к вирусу ТГС, полученные из музея штаммов ВНИИВВиМ.
Статистическую обработку данных выполняли с помощью программы Statistica v. 17.
Результаты. Наблюдавшаяся клиническая картина при развитии патологии была следующей: у поросят с 2-4-суточного возраста проявлялась диарея с выделением серо-зеленых каловых масс, обезвоживание, жажда, анемичность видимых слизистых оболочек, температура тела повышалась или находилась в пределах физиологической нормы (39,4 °C), у некоторых животных отмечали мышечную дрожь. Гибель наступала через 2-5 сут после начала диареи. Клинических и патологоанатомических признаков заболевания органов дыхания выявлено не было. Свиноматок в хозяйствах вакцинировали против ТГС, ротавируса свиней, колибактериоза, анаэробной энтеротоксемии, рожи, классической чумы свиней.
Ветеринарно-санитарное состояние ферм в большинстве случаев соответствовало принятым требованиям. Территория огорожена сплошным забором по периметру, корпуса нового и старого типа. Дезбарьеры и дезковрики имелись в ветсанпропускниках и на местах выезда транспортных средств. Содержание безвыгульное, поголовье — около 2000 свиноматок. Заболеваемость поросят за период регистрируемой вспышки (около 3 мес) составила приблизительно 90 %, летальность — примерно 85 %.
При постановке диагноза были исключены бактериальные инфекции (колибактериоз, анаэробная энтеротоксемия), а также вирусные инфекции — африканская чума свиней (АЧС), репродуктивно-респираторный синдром (РРСС), трансмиссивный гастроэнтерит (ТГС), классическая чума свиней (КЧС), болезнь Ауески, ротавирусная инфекция свиней.
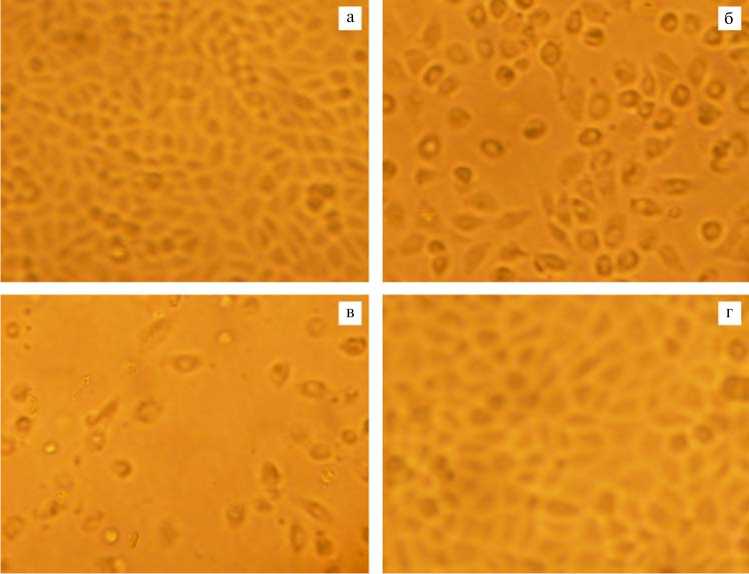
Рис. 1. Цитопатический эффект в культуре клеток Vero, индуцированный полученным изолятом вируса эпизоотической диареи свиней: а, б, в — соответственно 24, 48, 72 ч после заражения; г — незараженная культура (множественность заражения 0,1 ед. на клетку).
При последовательных слепых пассажах проб патологического материала в культурах клеток РК-15, CV-1, MA104 и Vero с использованием двух модификаций метода (с применением трипсина и без его добавления) цитопатогенный вирус был выделен из ткани тонкого отдела кишечника на 5-м пассаже в клетках Vero (рис. 1) в случае, когда инокулят предварительно обрабатывали ферментом. Титр инфекционности при этом составлял 103 , 50 ТЦД50/см3.
Накопление вируса эпизоотической диареи свиней при пассировании в культуре клеток Vero в зависимости от предварительной обработки вируссодержащего материала трипсином ( n = 4)
|
Концентрация трипсина |
Пассаж |
||||
|
1-й |
2-й |
3-й |
4-й |
5-й |
|
|
ТЦД 50 /см3 |
ТЦД 50 /см3 |
ТЦД 50 /см3 |
ТЦД 50 /см3 |
ТЦД 50 /см3 |
|
|
Без обработки (0 мкг/см3) |
3,50 (3,1-3,8) |
3,50 (3,1-3,8) |
3,75 (3,4-4,0) |
3,75 (3,4-4,0) |
3,75 (3,4-4,0) |
|
5 мкг/см3 |
3,50 (3,1-3,8) |
3,75 (3,4-4,0) |
3,75 (3,4-4,0) |
4,00 (3,5-4,5) |
4,00 (3,5-4,5) |
|
10 мкг/см3 |
3,50 (3,1-3,8) |
4,00 (3,5-4,5) |
4,25 (3,7-4,7) |
4,50 (3,9-5,0) |
4,50 (3,9-5,0) |
|
20 мкг/см3 |
3,75 (3,4-4,0) |
4,50 (3,9-5,0) |
5,25 (4,9-5,5) |
5,50 (5,1-5,8) |
5,50 (5,1-5,8) |
|
40 мкг/см3 |
3,75 (3,4-4,0) |
4,50 (3,9-5,0) |
5,25 (4,9-5,5) |
5,50 (5,1-5,8) |
5,50 (5,1-5,8) |
Примечание. Доверительный интервал 95 %.
При определении влияния различных концентраций трипсина на репродукцию вируса в культуре клеток Vero (в качестве контроля культуру клеток инокулировали необработанным вируссодержащим материалом) провели 5 последовательных пассажей (табл.). Как свидетельствуют представленные данные, при обработке трипсином в концентрации 5 мкг/см3 титр вируса возрастал до 4-го пассажа на 0,5 lg. Максимальное увеличение инфекционного титра было установлено после предварительной обработки вируссодержащего материала трипсином в конечной концентрации 20 мкг/см3. В этих условиях титр вируса повышался до 4-го пассажа, составил 5,50 ТЦД 5о /см3, и его величина сохранялась до 25-го пассажа.
Дальнейшее увеличение концентрации трипсина в вируссодержа-щем материале не приводило к повышению инфекционного титра вируса при пассировании на восприимчивой культуре клеток.

I 2 3 4 5 6 7 8 9 10 11 12
Рис. 2. Электрофорез в агаровом геле продуктов ПЦР РНК вируса эпизоотической диареи свиней: 1, 2 — экспертизные тканевые суспензии; 3-8 — пассажи вируса в культуре клеток (соответственно 1, 5, 10, 15, 20 и 25 пассажей); 9, 10 — концентрированный вирус; 11 — положительный контроль; 12 — отрицательный контроль.
При определении типа нуклеиновой кислоты посредством обработки зараженной культуры клеток 5 -йод-2'-дезоксиуридином не отмечалось затруднения репликации, что позволило нам отнести выделенный вирус к РНК-содержащим. При обработке хлороформом вирус потерял инфекционную активность, что указывает на наличие у него липидной оболочки.
Следует отметить, что ин-фекционность вируса не снижалась после обработки ультразву ком и при многократном замораживании/оттаивании. В РН с сыворотками против ВТГС было установлено, что они не нейтрализуют изолят.
При изучении с помощью ПЦР суспензии патологического материала, а также каждого 5-го пассажа выделенного вируса в культуре кле ток мы подтвердили наличие вируса ЭДС как в исходном патологическом материале, так и в последующих 25 пассажах (рис. 2).
Выделенный вирус обозначили как изолят БС-08. К настоящему времени было проведено 25 последовательных пассажей вируса в культуре клеток; срок появления цитопатического действия составлял при этом 2448 ч, инфекционный титр — 104 ’ 75-105 ’ 50 ТЦД50/см3
Итак, из патологического материала от больных 3-5-суточных по- росят, отобранного при вспышке болезни с диарейным синдромом и доставленного с сентября по декабрь 2008 года из западного региона РФ, выделен РНК-содержащий вирус, чувствительный к растворителям липидов. По результатам ПЦР возбудитель идентифицирован как вирус эпизоотической диареи свиней (ЭДС). В настоящее время с использованием этого изолята проводится работа по совершенствованию диагностики ЭДС, созданию средств для специфической иммунопрофилактики болезни и определения напряженности поствакцинального иммунитета.
Автор выражает благодарность И.Ю. Егоровой (Всероссийский НИИ ветеринарной вирусологии и микробиологии) за помощь при выполнении ПЦР.


