Выделение и описание штаммов Bacillus cereus как факторов риска пищевых отравлений пиццей с говядиной (Ханой, Вьетнам)
Автор: Пхам Нгок Ха, Нинх Тхи Нанх, Ву Кханх Ван, Тран Ле Минх, Нгуен Тханх Трунг
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в эпидемиологии
Статья в выпуске: 2 (50), 2025 года.
Бесплатный доступ
Бактерия Bacillus cereus является одной из основных причин пищевых отравлений во всем мире. В рамках данного исследования выделено 10 штаммов B. cereus из образцов пиццы с говядиной как установленной причины пищевого отравления детей в двух детских садах A и B в 2024 г. во Вьетнаме. Идентификация вида бактерий была выполнена при помощи биохимических тестов и использования технологии MALDI-TOF; профиль устойчивости к антибиотикам был построен согласно рекомендациям M45 CLSI, а также изучено наличие генов токсинов cytK, bceT, hbl (hblA, hblC, и hblD) и nhe (nheA, nheB, and nheC) в выделенных штаммах. Установлено, что выделенные штаммы B. cereus обладали высоким уровнем устойчивости к нескольким антибиотикам, включая пенициллин (100 %), ванкомицин (100 %), стрептомицин (90 %), тетрациклин (80 %), ампициллин (70 %) и эритромицин (70 %). Помимо этого, 100 % штаммов B. cereus (10/10), выделенных из образца пиццы с говядиной, показали положительный результат в тесте на определение гена токсина bceT; 80 % штаммов (8/10) были позитивны на ген токсина cytK, а 60 % штаммов (6/10) показали наличие генов токсинов nheA и nheC при отсутствии гена рвотного токсина NRPS. Исследование вносит вклад в базу данных об устойчивости к антибиотикам штаммов B. cereus, связанных с пищевыми отравлениями во Вьетнаме, а его результаты являются базой для разработки справочных материалов, актуальных для быстрой диагностики пищевого отравления, связанного с бактериями типа B. cereus.
Bacillus cereus, пищевое отравление, устойчивость к антибиотикам, M45 CLSI, bceT, cytK, hbl, nhe
Короткий адрес: https://sciup.org/142244771
IDR: 142244771 | УДК: 614.446 | DOI: 10.21668/health.risk/2025.2.08
Текст научной статьи Выделение и описание штаммов Bacillus cereus как факторов риска пищевых отравлений пиццей с говядиной (Ханой, Вьетнам)
По разным оценкам, бактерия B. cereus считается причиной почти 12 % инцидентов пищевых отравлений во всем мире. Согласно данным Центра по контролю и предотвращению заболеваний (CDC) в США, бактерии вида Bacillus spp вызвали 619 вспышек пищевых отравлений с общим количествам случаев заболеваний 7385, из них 75 случаев тяжелого заболевания и трех смертей, за период с 1998 по 2015 г. [1]. В Китае за период с 2010 по 2020 г. было зарегистрировано 419 вспышек пищевых отравлений, вызванных B. cereus, с общим количеством пострадавших 7892 человека, из которых 2786 человек были госпитализированы, а пять случаев закончились смертельным исходом [2]. Во Вьетнаме также были зарегистрированы многочис- ленные вспышки отравлений с участием B. cereus. Например, в 2020 г. 230 человек отравились едой, загрязненной бактериями Escherichia coli (E. coli), Staphylococcus aureus (S. aureus) и B. cereus, в одном из вегетарианских ресторанов в Да Нанге. В том же году десятки детей дошкольного возраста были госпитализированы в Кан Тхо после употребления в пищу супа пхо и йогурта, обсемененных B. cereus. В 2022 г. более 600 студентов в Нха Транг были госпитализированы после употребления в пищу жареных куриных крылышек, загрязненных Salmonella, B. cereus и E. coli, и один исход был фатальным.
Бактерия B. cereus – это грамположительная палочковидная бактерия семейства Bacillaceae и
Нгуен Тханх Трунг – кандидат наук, руководитель лаборатории микробиологии продуктов питания (e-mail: ; тел.: + 84349363269; ORCID: .
Пхам Нгок Ха – магистр, научный сотрудник лаборатории микробиологии продуктов питания (e-mail: ; тел.: + 84963991575 ; ORCID: .
Нинх Тхи Нанх – научный сотрудник лаборатории микробиологии продуктов питания (e-mail: ; тел.: + 84338273077; ORCID: .
одна из самых распространенных причин пищевых отравлений. Бактерия B. cereus повсеместно обнаруживается в почве, воде и пищевых продуктах, в особенности рисе, готовых продуктах и молочных продуктах1. Следует заметить, что бактерия B. cereus устойчива к нагреванию, а ее споры обладают высокой лекарственной устойчивостью, что позволяет данному штамму выживать в разных условиях окружающей среды. Бактерия B. cereus способна вырабатывать токсины и вызывает два вида последствий пищевых отравлений, сопровождающихся преимущественно рвотой (токсины обычно возникают уже при потреблении загрязненных пищевых продуктов) и / или диареей (токсины продуцируются бактерией после того, как загрязненный продукт попадает в ЖКТ) [3].
Широкое применение антибиотиков привело к возникновению лекарственной устойчивости у многих штаммов бактерий, включая B. cereus , которая часто продуцирует ферменты β-лактамазы, обеспечивающие сильную устойчивость к β-лактамным антибиотикам [4]. Согласно рекомендациям Института клинических и лабораторных стандартов (CLSI), штаммы B. cereus в основном восприимчивы к аминогликозидам, клиндамицину, хлорамфениколу, эритромицину и ванкомицину. Однако в нескольких исследованиях отмечается, что бактерия B. cereus обладает устойчивостью к тетрациклину, стрептомицину, ципрофлоксацину, клоксациллину, эритромицину и рифампицину [5].
Отравления, сопровождающиеся преимущественно диареей, связаны с негемолитическим энтеротоксином ( nhe ), гемолизином BL ( hbl ), цитотоксином K ( cytK ) и энтеротоксином T ( bceT )2 [6–8]. Однако данные об энтеротоксическом потенциале bceT , приведенные в нескольких исследованиях, остаются противоречивыми [9, 10]. Отравления, сопровождающиеся преимущественно рвотой, связаны с геном рвотного токсина NRPS (нерибосомная пептидная синтетаза) бактерии B. cereus и продукцией таких токсичных пептидов, как Cereulide и isocereulides A-G. Этот ген функционирует независимо от конвенционального синтеза белков и позволяет бактерии эффективно синтезировать опасные вещества, повышающие вирулентность B. cereus при вспышках пищевых отравлений [11].
В Ханое, где при приготовлении пищи применяются в основном традиционные способы, необходим постоянный мониторинг и описание штаммов B. cereus, связанных со вспышками пищевых отравлений, для определения их происхождения, понима- ния их эпидемиологических характеристик и разработки эффективных профилактических мер.
Цель исследования – построение профиля лекарственной устойчивости и определение генов вирулентности штаммов бактерии B. cereus , обусловивших в 2024 г. в Ханое вспышки пищевой этиологии в двух детских садах при употреблении пиццы с говядиной.
Материалы и методы. В качестве причины отравления дошкольников в двух детских садах (условно А и В) были определены 10 штаммов бактерии B. cereus , выделенных из образцов пиццы с говядиной. Оба дошкольных учреждения расположены в г. Ханое и находятся под единым управлением. Случаи отравления зарегистрированы в 2024 г. В учреждении А пострадали 135 детей дошкольного возраста, у которых были диагностированы желудочно-кишечные расстройства. В учреждении В было зарегистрировано 77 детей дошкольного возраста с тем же диагнозом. Все соответствующие образцы пищевых продуктов были отобраны на месте, заморожены в холодильных устройствах и направлены в Национальный институт контроля пищевой продукции для анализа.
Выделение и идентификация штаммов B. cereus в образцах пиццы с говядиной. Определение B. cereus было выполнено в соответствии с международным стандартом ISO 7932: 20043 (TCVN 4992: 2005), а именно 10 г каждого образца пищевого продукта были гомогенизированы в 90 мл пептонной воды (Merck). Для каждого образца была подготовлена серия растворов 10-5, и 100 мкл каждого раствора были инокулированы на маннитол-агаре с добавлением яичного желтка и полимиксина (MYP; Merck). Инкубация во всех чашках продолжалась в течение одной ночи при температуре 37 °C. Колонии с типичными морфологическими признаками (плоские, диаметр – 2–3 мм, зубчатые края, розоватый цвет, окружены чистым пространством) были отобраны для гемолиза на кровяном агаре и биохимических тестов с применением углеводного набора API 50 (bioMerieux, Франция). Типичные колонии B. cereus , показавшие положительный результат в биохимических тестах, хранились при температуре -80 °C. Для идентификации эти колонии в виде тонких полосок были помещены на соевый агар Tryptone (TSA; Merck), инкубированы в течение 24 ч при 37 °C, а затем идентифицированы с применением метода матрично-активированной лазерной десорбции / ионизации – время пролетной детекции MALDI-TOF на приборе VITEK® MS
(BioMérieux SA, Marcy l’Etoile, Франция). В качестве контрольного штамма применялся E. coli ATCC 8739.
Оценка профиля лекарственной устойчивости штаммов B. cereus, обнаруженных в образцах пиццы с говядиной. Лекарственная устойчивость штаммов B. cereus была оценена при помощи метода диско-диффузии в тесте Кирби – Бауэра4. Бактерии B. cereus выращивались в 10 мл стерильного бульона с сердечно-мозговой вытяжкой до тех пор, пока плотность клеток не достигала 0,5 стандарта МакФарланда, что составляет примерно 1,5·108 КОЕ/мл. Для распределения бактериальной суспензии на агаре Muller – Hinton применялся стерильный мазок. Согласно рекомендациям M45 CLSI было протестировано 11 типов антибиотиков, включая ампициллин (АМП, 10 мкг/диск), хлорамфеникол (Х, 30 мкг/диск), ципрофлоксацин (ЦИП, 5 мкг/диск), эритромицин (ЭРИ, 15 мкг/диск), имипенем (ИПМ, 10 мкг/диск), меропенем (МРП, 10 мкг/диск), офлоксацин (ОФК, 5 мкг/диск), пенициллин (ПРЛ, 10 МЕ/диск), стрептомицин (С, 10 мкг/диск), тетрациклин (ТЕ, 30 мкг/диск) и ванкомицин (ВАН, 30 мкг/диск). Диски были размещены на поверхности агара при помощи стерильных хирургических щипцов для последующей инкубации при температуре 37 °C в течение 18 ч. Результаты тестов на лекарственную устойчивость были получены при помощи измерения диаметра зоны подавления, представленной четко видимой областью вокруг диска с антибиотиком.
Определение генов токсинов B. cereus в образцах пиццы с говядиной. Метод экстракции ДНК. 10 штаммов B. cereus, выделенных из образов пиццы с говядиной, хранились при температуре -80 oC. Они были размещены тонкими полосками на кровяном агаре для обнаружения чистых штаммов, культивированных в бульоне с сердечно-мозговой вытяжкой (Brain Heart Infusion broth), и инкубированы в течение 18–24 часов при температуре 37 oC. Полная ДНК B. cereus была выделена в соответствии с протоколом для грамположительных бактерий для набора очистки геномной ДНК GeneJET (Thermofisher; C5042). Общая концентрация ДНК штаммов B. cereus была определена с применением наноспектрофотометра со спектральной поглощательной способностью 260 нм. До применения раствор ДНК хранился при температуре -20 oC.
ПЦР и мультиплексная ПЦР. Пары праймеров, использованных в рамках данного исследования для обнаружения генов рвотных и диарейных токсинов штаммов B. cereus , обнаруженных в образцах пиццы с говядиной, приведены в табл. 1. Простая ПЦР применялась для пар bceT-F/R, EM1F/R и cytK F/R, в то время как для оставшихся пар праймеров была использована мультиплексная ПЦР.
Смесь для ПЦР (25 мкл) состояла из 12,5 мкл мастер-смеси 2X PCR (Thermo Scientific), 1 мкл прямого праймера (10 пкмоль), 1 мкл обратного праймера (10 пкмоль), 3 мкл шаблона ДНК и 7,5 мкл деионизированной воды. Условия температурного цикла для пары праймеров EM1F / EM1R были определены следующим образом: 95 °C в течение 15 мин; (95 °C в течение 30 с; 60 °C на 30 с; 72 °C на 60 с) на 30 циклов, затем 72°C в течение 5 мин и удержание при 4 °C. Условия температурного цикла для пары праймеров bceT-F / bceT-R были определены следующим образом: 94 °C в течение 5 мин; (94 °C в течение 45 с; 55 °C на 45 с; 72 °C на 2 мин) на 30 циклов, затем
Таблица 1
Пары праймеров, использованные для обнаружения генов токсинов B. cereus
|
Наименование |
Последовательность (5'-3') |
Ген |
Размер (по) |
Ссылка |
|
bceT-F |
CGT ATC GGT CGT TCA CTC GG |
Enterotoxin bceT |
662 |
[12] |
|
bceT-R |
GTT GAT TTT CCG TAG CCT GGG |
|||
|
EM1F |
GAC AAG AGA AAT TTC TAC GAG CAA GTA CAA T |
NRPS |
635 |
[13] |
|
EM1R |
GCA GCC TTC CAA TTA CTC CTT CTG CCA CAG T |
|||
|
nheAF |
TAC GCT AAG GAG GGG C |
nheA |
499 |
[14] |
|
nheAR |
GTT TTT ATT GCT TCA TCG GCT |
|||
|
nheBF |
CTA TCA GCA CTT ATG GCA G |
nheB |
769 |
|
|
nheBR |
ACT CCT AGC GGT GTT CC |
|||
|
nhCF |
CGG TAG TGA TTG CTG GG |
nheC |
581 |
|
|
nhCR |
CAG CAT TCG TAC TTG CCA A |
|||
|
hblAF |
GTG CAG ATG TTG ATG CCG AT |
hbl A |
1154 |
|
|
hblAR |
ATG CCA CTG CCT GGA CAT A |
|||
|
HbICF |
GAT ACT AAT GTG GCA ACT GC |
hbl C |
740 |
|
|
HbICR |
TTG AGA CTG CTC GTT AGT TG |
|||
|
HbIDF |
AAT CAA GAG CTG TCA CGA AT |
hbl D |
829 |
|
|
HbIDR |
CAC CAA TTG ACC ATG CTA AT |
|||
|
CytK F |
CGA CGT CAC AAG TTG TAA CA |
Cytotoxin-K |
565 |
|
|
cytK R |
CGT GTG TAA ATA CCC CAG TT |
4 Antibiotic susceptibility testing by a standardized single disk method / A.W. Bauer, W.M. Kirby, J.C. Sherris, M. Turck // Am. J. Clin. Pathol. – 1966. – Vol. 45, № 4. – P. 493–496.
Таблица 2
Уровни загрязнения бактериями B. cereus (КОЕ/г) образцов пищевой продукции, отобранных в учреждениях А и В
|
Блюдо |
Учреждение A |
Учреждение B |
|
Жареная свиная вырезка |
Н/О |
5,0 · 101 |
|
Смесь вареных овощей |
Н/О |
6,0 · 101 |
|
Лапша с яйцом и морепродуктами |
Н/О |
8,0 · 101 |
|
Пицца с говядиной |
6,0 · 105 |
6,8 · 105 |
Примечание: Н/О – не обнаружено.
72 °C в течение 10 мин и удержание при 4 °C. Условия температурного цикла для пары праймеров cytKF / cytKR были определены следующим образом: 94 °C в течение 1 мин; (95 °C в течение 45 с; 54 °C на 1 мин; 72 °C на 2 мин) на 35 циклов, затем 72 °C в течение 5 мин и удержание при 4 °C.
Смесь для мультиплексной ПЦР (25 мкл) состояла из 12,5 мкл мастер-смеси 2X PCR (Thermo Scientific), 0,5 мкл каждого прямого праймера (20 пкмоль), 0,5 мкл каждого обратного праймера (20 пкмоль), 3 мкл шаблона ДНК и 3,5 мкл деонизи-рованной воды. Условия температурного цикла для амплификации мультиплексной ПЦР генов hblA, hblC, hblD, nheA, nheB, и nheC были определены следующим образом: 94 °C / 2 мин; (95 °C / 15 с; 55 °C / 45 с; 72 °C / 2 мин) на 35 циклов, затем 72 °C / 5 мин и удержание при 4°C. Продукты ПЦР были разделены при помощи 1,5%-ного агарозного геля, приготовленного с применением буферного раствора 1X TAE и красителя Redsafe; подвергнуты процедуре электрофореза при 110 V в течение 50 мин с последующей УЗ-визуализацией. Для будущих исследований продукты ПЦР хранились при температуре -80 °C.
Результаты и их обсуждение. Выделение, идентификация и оценка загрязнения штаммами B. cereus образцов пиццы с говядиной, отобранных в дошкольных учреждениях A и B. Бактерия B. cereus была обнаружена в разных блюдах, но самые высокие ее концентрации – 6,0·105 КОЕ/г в дошкольном учреждении A и 6,8·105 КОЕ/г в дошкольном учреждении B (табл. 2) – были найдены в образцах пиццы с говядиной.
Следует отметить, что оба учреждения получали данное блюдо от одного и того же поставщика. В настоящее время во Вьетнаме отсутствуют стан- дарты безопасного уровня микроорганизмов в пицце. Что касается лимитов, установленных в других странах для уровней микробного загрязнения, следует упомянуть закон № 329 Республики Эстония, изданный в 2000 г., а также критерии микробиологической безопасности, установленные Национальным консультационным комитетом по микробиологическим стандартам для продуктов питания Департамента сельского хозяйства США. Согласно данным документам, максимальный уровень B. cereus в пицце5 или готовой еде [15] составляет 10³ КОЕ/г. Следовательно, предельно допустимый уровень был превышен в пицце с говядиной в дошкольных учреждениях А и В в 600 и 680 раз соответственно. Если же ориентироваться на допустимые уровни микробиологического загрязнения для готовой еды, установленные Кодексом пищевых стандартов Австралии и Новой Зеландии 20226, или Микробиологические рекомендации 2014 г., выпущенные Центром безопасности пищевых продуктов Гонконга7, то приемлемый уровень для готовой еды, установленный в них, составляет 105 КОЕ/г. Следовательно, уровни загрязнения в учреждениях А и В превышают этот предел в 6 и 6,8 раза соответственно. Помимо этого, концентрация B. cereus на уровне 5,0·101 КОЕ/г, 6,0·101 КОЕ/г и 8,0·101 КОЕ/г была обнаружена в жареной свиной вырезке, смеси вареных овощей и лапше с яйцом и морепродуктами соответственно в учреждении В (см. табл. 2), что говорит о потенциальной передаче бактерий из пиццы с говядиной в данные блюда. Для лучшего понимания эпидемиологических характеристик и разработки эффективных профилактических мер штаммы B. cereus, выделенные из образцов пиццы с говядиной в обоих дошкольных учреждениях, были проанализированы с целью определения уровней лекарственной устойчивости.
Результаты гемолитических тестов показали, что все выделенные штаммы продуцировали бета-гемолитические зоны, что является характерной чертой B. cereus (рис. 1). Результаты идентификации по методу MALDI-TOF, полученные для 10 колоний, выделенных из образцов пиццы с говядиной в дошкольных учреждениях А и В, показали, что для всех проанализированных колоний балльная оценка по шкале MALDI-TOF превысила 2,0, что позволяет идентифицировать все колонии как B. cereus (10/10; 100 %). Прочие биохимические характеристики штаммов оценивались при помощи набора API 50 CHE4, в результате все 100 % (10/10) штаммов B. cereus показали положительный результат
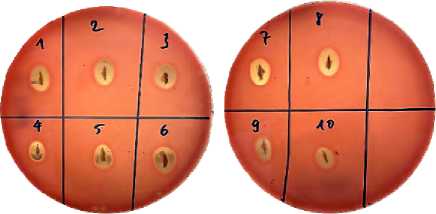
Рис. 1. Результаты гемолитического теста 10 штаммов B. cereus, выделенных из образцов пиццы с говядиной: 1–10 – выделенные штаммы B. cereus на D-рибосому, D-глюкозу, D-фруктозу, N-ацетил глюкозамин, арбутин, эскулин / железистый цитрат, салицин, D-мальтозу, D-трехалозу, крахмал (амидон) и гликоген. 80 % (8/10) штаммов показали положительный результат на D-целлобиозу; 70 % (7/10) штаммов – на D-сахарозу (сукрозу) и 50 % (5/10) – на гентиобиозу (табл. 3).
Эти результаты согласуются с данными, опубликованными в Руководстве Берджи по систематике бактерий. Ферментация глицерина, гликогена и крахмала, а также свойства редуцирования эскулина / железистого цитрата, подтвержденные в данном биохимическом тесте, как правило, применяются для дифференциации B. cereus от близкородственных бактерий Bacillus sp.8
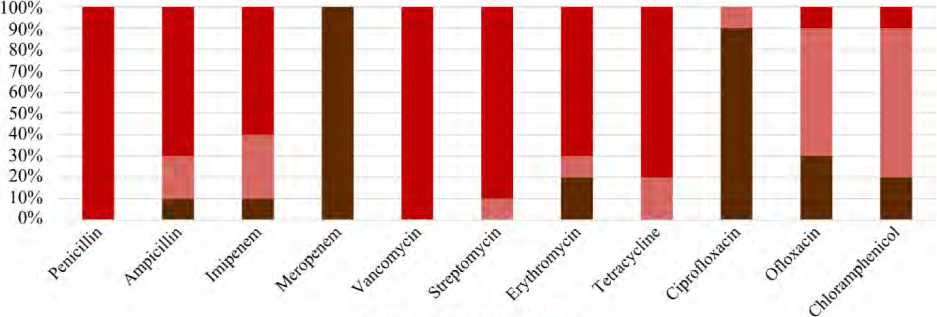
Профиль лекарственной устойчивости штаммов B. cereus, выделенных из образцов пиццы с говядиной. Все штаммы ( n = 10; 100 %) оказались чувствительны к меропенему, а также показали высокую чувствительность к ципрофлоксацину ( n = 9; 90 %). Результаты показали средний уровень устойчивости штаммов B. cereus к офлоксацину ( n = 6; 60 %) и хлорамфениколу ( n = 7; 70 %). Штаммы B. cereus, выделенные из образцов пиццы с говядиной, показали абсолютную устойчивость к пенициллину ( n = 10; 100 %) и ванкомицину ( n = 10; 100 %); также высока была устойчивость к стрептомицину ( n = 9; 90 %), тетрациклину ( n = 8; 80 %), ампициллину ( n = 7; 70 %) и эритромицину ( n = 7; 70 %); устойчивость к имипенему была средней ( n = 6; 60 %) (рис. 2).
Согласно результатам тестирования, меропе-нем и ципрофлоксацин продемонстрировали перспективный уровень антимикробной активности в отношении штаммов B. cereus . В отличие от рекомендаций M45 CLSI, которые говорят о том, что B. cereus обычно устойчив к пенициллину, но зачастую чувствителен к ванкомицину и макролидам, в нашем исследовании было обнаружено, что штаммы B. cereus , выделенные из образцов пиццы с говядиной, показали 100%-ную устойчивость к ванкомицину 70%-ную – к эритромицину. M.N.S. Abdelaziz et al. (2024) изучили лекарственную устойчивость
Таблица 3
Доля штаммов B. cereus ( n = 10) с положительным результатом тестов с применением набора API 50 CH
|
№ |
Тест |
Конц., мг |
% |
№ |
Тест |
Конц., мг |
% |
|
0 |
Отрицательный контроль |
0 |
25 |
Эскулин / железистый цитрат |
1,16 / 0,152 |
100 |
|
|
1 |
Глицерин |
1,64 |
100 |
26 |
Салицин |
1,04 |
100 |
|
2 |
Эритрол |
1,44 |
0 |
27 |
D-целлобиоза |
1,32 |
80 |
|
3 |
D-арабиноза |
1,4 |
0 |
28 |
D-мальтоза |
1,4 |
100 |
|
4 |
L-арабиноза |
1,4 |
0 |
29 |
D-лактоза |
1,4 |
0 |
|
5 |
D-рибоза |
1,4 |
100 |
30 |
D-мелибиоза |
1,32 |
0 |
|
6 |
D-ксилоза |
1,4 |
0 |
31 |
D-сахароза |
1,32 |
70 |
|
7 |
L-ксилоза |
1,4 |
0 |
32 |
D-трехалоза |
1,32 |
100 |
|
8 |
D-адонитол |
1,36 |
0 |
33 |
Инулин |
1,28 |
0 |
|
9 |
Метил-ß-D-ксилопиранозид |
1,28 |
0 |
34 |
D-мелецитоза |
1,32 |
0 |
|
10 |
D-галактоза |
1,4 |
0 |
35 |
D-раффиноза |
1,56 |
0 |
|
11 |
D-глюкоза |
1,56 |
100 |
36 |
Крахмал |
1,28 |
100 |
|
12 |
D-фруктоза |
1,4 |
100 |
37 |
Гликоген |
1,28 |
100 |
|
13 |
D-манноза |
1,4 |
0 |
38 |
Ксилитол |
1,4 |
0 |
|
14 |
L-сорбоза |
1,4 |
0 |
39 |
Гентиобиоза |
0,5 |
50 |
|
15 |
L-рамноза |
1,36 |
0 |
40 |
D-тураноза |
1,32 |
0 |
|
16 |
Дульчитол |
1,36 |
0 |
41 |
D-ликсоза |
1,4 |
0 |
|
17 |
Инозитол |
1,4 |
0 |
42 |
D-тагатоза |
1,4 |
0 |
|
18 |
D-маннитод |
1,36 |
0 |
43 |
D-фукоза |
1,28 |
0 |
|
19 |
D-сорбитол |
1,36 |
0 |
44 |
L-фукоза |
1,28 |
0 |
|
20 |
Метил-α-D-маннопиранозид |
1,28 |
0 |
45 |
D-Arabitol |
1,4 |
0 |
|
21 |
Метил-α-D-глюкопиранозид |
1,28 |
0 |
46 |
L-арабитол |
1,4 |
0 |
|
22 |
N-ацетил глюкозамин |
1,28 |
100 |
47 |
Глюконат калия |
1,84 |
0 |
|
23 |
Амигдалин |
1,08 |
0 |
48 |
Калий 2-кетоглюконат |
2,12 |
0 |
|
24 |
Арбутин |
1,08 |
100 |
49 |
Калий 5-кетоглюконат |
1,8 |
0 |
8 Bergey’s Manual of Systematic Bacteriology. Volume One: The Archaea and the Deeply Branching and Phototrophic Bacteria / ed. by D.R. Boone, R.W. Castenholz, G.M. Garrity. – NY: Springer Publ., 2001. – 2nd ed. – 722 p.
■ Nhay ■ Trung gian ■ Khang
Рис. 2. Профиль лекарственной устойчивости B. cereus , определенный на основании диаметра зоны подавления (мм): красный – устойчивость, розовый – промежуточное состояние, коричневый – чувствительность
штаммов B. cereus , обнаруженных в пищевых продуктах в Японии, и обнаружили высокие уровни устойчивости к ванкомицину [16], что согласуется с данными нашего исследования. T. Nakayama (2021) показал, что штаммы B. cereus , выделенные из куриного мяса в городе Хо Ши Мин, обладали устойчивостью к ампициллину, ципрофлоксацину и тетрациклину [17], в то время как штаммы B. cereus , изученные в данном исследовании, были чувствительны к ципрофлоксацину и обладали устойчивостью к ампициллину и тетрациклину. При сравнении профиля лекарственной устойчивости 10 штаммов B. cereus , выделенных из образцов пиццы с говядиной при инциденте с пищевым отравлением в детском саду, и глобально циркулирующих штаммов B. cereus было обнаружено, что наши результаты подобны данным исследования A.M. Algammal et al. (2022). Штаммы B. cereus , циркулирующие в Египте, обладали чувствительностью к меропенему и показали устойчивость к нескольким антимикробным препаратам, включая эритромицин, стрептомицин и тетрациклин [18], подобно штаммам B. cereus , описанным в рамках данного исследования. Необходимы дальнейшие исследования вирулентности и генов лекарственной устойчивости на уровне ДНК для тщательного изучения эпидемиологических характеристик и внедрения эффективных мер профилактики против штаммов B. cereus , обнаруженных в образцах пиццы с говядиной.
Присутствие генов токсинов B. cereus в образце пиццы с говядиной. 10 штаммов B. cereus, выделенных из образцов пиццы с говядиной, связанные с инцидентом с пищевыми отравлениями в дошкольных учреждениях А и В в Ханое, были проанализированы на наличие генов рвотных (NRPS) и диарейных (hblA, hblC, hblD, nheA, nheB, nheC, bceT и cytK) токсинов при помощи ПЦР (NRPS, bceT и cytK) и мультиплексной ПЦР (hblA, hblC, hblD, nheA, nheB, и nheC). Результаты электрофореза (рис. 3–5) показали, что 100 % штаммов B. cereus (10/10), выделенных из образцов пиццы с говядиной, дали положительный результат на наличие гена bceT, 80 % (8/10) – гена cytK, и 60 % штаммов (6/10) – на наличие генов nheA и nheC. Кроме того, 100 % штаммов, изученных в данном исследовании (10/10), дали отрицательный результат на наличие гена NRPS (данное электрофорез-изображение не включено в исследование).
M 1 2 3 4 5 6 7 8 9 10 (l) (-)
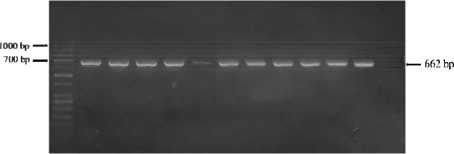
Рис. 3. Электрофорез продукта ПЦР гена токсина bceT : 1–10 – bceT – позитивен (662 по); M – лестница ДНК 50 по; (+) – положительный контроль; (-) – отрицательный контроль
Рис. 4. Электрофорез продукта ПЦР гена токсина cytK : 1, 6 – отрицательно; 2–5 и 7–10 – cytK – позитивен (565 по); M – лестница ДНК 50 по; (-) – отрицательный контроль
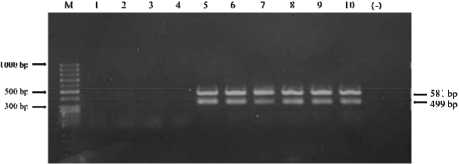
Рис. 5. Электрофорез-изображения продуктов мультиплексной ПЦР генов токсинов hbl ( hblA , hblC , и hblD ) и nhe ( nheA , nheB , и nheC ): 1–4 – отрицательно; 5–10 – nhA и nhC позитивен (581 по, 499 по);
M – лестница ДНК 50 по; (-) – отрицательный контроль
Результаты нашего исследования согласуются с данными, описанными другими авторами в разных странах. В Ираке B.M.S. Saeed et al. (2021) описали очень низкий уровень обнаружения рвотного токсина во всех образцах пищевых продуктов, примерно на уровне 7,69 %, что говорит о низкой распространенности штаммов B. cereus с рвотным типом токсинов в пищевых продуктах [14]. N. Jessberger et al. (2021) [19] и M. Bağcioğlu et al. (2019) [20] также обнаружили, что рвотный тип B. cereus обнаруживался в пищевых продуктах значительно реже, чем диарейный. Наше исследование вносит определенный вклад в базу данных по штаммам B. cereus, циркулирующим во Вьетнаме. Более того, данные о штаммах B. cereus , несущих ген диарейного токсина, идентифицированных в рамках данного исследования, являются ценным ресурсом для разработки справочных материалов, необходимых для быстрой диагностики пищевого отравления вызывающими диарею бактериями типа B. cereus .
Выводы. В рамках данного исследования 10 штаммов B. cereus были выделены из образцов пиццы с говядиной и определены в качестве причины пищевого отравления дошкольников, посещающих учреждения А и В в Ханое. Выявленные уровни загрязнения B. cereus превышали допустимые уровни, установленные международными регулирующими документами; они составили 6,0·105 КОЕ/г в учреждении A и 6,8·105 КОЕ/г в учреждении B. В тестах с использованием 11 антибиотиков с целью определе- ния уровней лекарственной устойчивости выделенных штаммов было обнаружено, что бактерии B. cereus обладали абсолютной устойчивостью (100 %) к пенициллину и ванкомицину, высоким уровнем устойчивости к стрептомицину (90 %), тетрациклину (80 %), ампициллину (70 %) и эритромицину (70 %); средним уровнем устойчивости к ими-пенему (60 %) и были чувствительны к меропенему (100 %) и ципрофлоксацину (90 %). Кроме того, 100 % штаммов B. cereus (10/10), обнаруженных в образцах пиццы с говядиной, дали положительный результат на ген токсина bceT, 80 % (8/10) – на ген токсина cytK, и 60 % штаммов (6/10) – на гены токсинов nheA и nheC, что указывает на принадлежность выделенных штаммов B. cereus к диарейному типу. Бактерия B. cereus остается основной патогенной угрозой по причине ее стремительной эволюции, носительства генов вирулентности и лекарственной устойчивости, что говорит о необходимости постоянного мониторинга генетического профиля и лекарственной устойчивости штаммов, циркулирующих во Вьетнаме, с целью предотвращения заболеваний и реагирования на возникающие вспышки отравлений.
Финансирование. Авторы выражают глубокую благодарность Национальному институту контроля пищевой продукции, Вьетнам, за предоставленное финансирование.


