Выявление ОМИК-маркеров для прогнозирования риска развития негативных эффектов у детей с повышенным содержанием меди и никеля в крови
Автор: Зайцева Н.В., Землянова М.А., Кольдибекова Ю.В., Булатова Н.И.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в гигиене
Статья в выпуске: 1 (33), 2021 года.
Бесплатный доступ
Технология протеомного профилирования является перспективным направлением для исследования и обоснования молекулярных механизмов возникновения и развития ответных реакций организма на негативные воздействия на самых ранних стадиях их формирования, до возникновения симптомов клеточного и органного поражения. Особую актуальность приобретают исследования, направленные на повышение эффективности прогнозирования развития негативных эффектов для задач раннего выявления и профилактики последствий, ассоциированных с воздействием химических факторов среды обитания, в первую очередь с атмосферным воздухом. Выявлены омик-маркеры для прогнозирования риска развития негативных эффектов у детей с повышенным содержанием меди и никеля в крови. Выполнено протеомное исследование плазмы крови у детей, моделирование причинно-следственных связей. У детей с повышенным (до 3,5 раза) содержанием в крови меди и никеля выявлено порядка двадцати белковых пятен, достоверно отличающихся от соответствующих данных детей группы контроля. Установлены зависимости увеличения относительного объема трех белковых пятен, включающих аполипопротеин A-I, якорный белок А-киназы 9, витронектин, и уменьшения относительного объема одного белкового пятна, включающего транстиретин, от повышенного содержания в крови меди и никеля (R2 = 0,30-0,44; р = 0,0001-0,008). Перечисленные белки являются прогностически значимыми для развития негативных эффектов, связанных с нарушением нейрорегуляции и эндотелиальной дисфункции. Доказана реализация риска развития прогнозируемых негативных эффектов в виде повышенной частоты развития заболеваний нервной и сердечно-сосудистой системы при повышенной концентрации в крови меди и никеля (R2 = 0,35-0,96; р = 0,0001-0,013). Установленный перечень потенциальных молекул-мишеней (аполипопротеин A-I, витронектин, якорный белок А-киназы 9, транстиретин) и генов, кодирующих их экспрессию (APOA1, VTN, AKAP9, TTR), обоснован в качестве омик-маркеров развития негативных эффектов со стороны сердечно-сосудистой и нервной систем.
Медь и никель в крови, риск здоровью, протеомный профиль плазмы крови, нервная система, сердечно-сосудистая система, аполипопротеин a-i, якорный белок а-киназы 9, витронектин, транстиретин
Короткий адрес: https://sciup.org/142229581
IDR: 142229581 | УДК: 612.12: | DOI: 10.21668/health.risk/2021.1.05
Текст научной статьи Выявление ОМИК-маркеров для прогнозирования риска развития негативных эффектов у детей с повышенным содержанием меди и никеля в крови
-
1 Об утверждении Стратегии развития медицинской науки в Российской Федерации на период до 2025 года: Распоряжение Правительства Российской Федерации от 28 декабря 2012 года № 2580-р [Электронный ресурс] // Гарант.Ру. Информационно-правовой портал. – URL: https://www.garant.ru/products/ipo/prime/doc/70192396/ (дата обращения: 20.09.2019).
В условиях особого высокого уровня загрязнения атмосферного воздуха химическими веществами, к числу которых относятся высокотоксичные соединения никеля и меди, существует риск развития негативных эффектов со стороны органов дыхания, системы крови, иммунной и нервной систем2.
В связи с этим особую значимость приобретает идентификация изменений гомеостаза на молекулярном уровне. Этим требованиям в полной мере соответствуют исследования пептидных пулов, играющих исключительную роль в биорегуляции в живых организмах. Эффективным инструментом, позволяющим выполнить анализ самих пептидов, их конечных и промежуточных метаболитов в клетке, является технология протеомного профилирования [1–4]. Данный метод позволяет исследовать и обосновывать молекулярные этиопатогенетические механизмы возникновения и развития ответных реакций организма на негативные воздействия на самых ранних стадиях их формирования, еще до возникновения симптомов клеточного и органного поражения, то есть на уровне трансформированного проте-омного профиля плазмы крови. Для прогнозирования экспрессии данных пептидов важным является определение генов, их кодирующих, что возможно с помощью существующих баз данных (например Sviss Prot). Обозначенная проблема обусловливает актуальность исследований, направленных на идентификацию молекулярных омик-маркеров с целью раннего выявления и профилактики последствий, ассоциированных с аэрогенным воздействием металлов [5, 6].
Цель исследования – выявление омик-марке-ров для прогнозирования риска развития негативных эффектов у детей с повышенным содержанием меди и никеля в крови.
Материалы и методы. Объектом исследования являлись образцы плазмы крови 20 детей в возрасте 4–6 лет, имеющих повышенное содержание меди и никеля в крови (группа наблюдения), и 10 детей этого же возраста с содержанием в крови изучаемых химических веществ, соответствующих минимальным или референтным значениям (группа контроля).
Настоящие исследования выполнены с соблюдением этических требований Хельсинкской декларации (ред. 2013 г.) и одобрены этическим комитетом ФБУН «Федеральный научный центр медикопрофилактических технологий управления рисками здоровью населения» Роспотребнадзора. Сравниваемые группы сопоставимы по гендерному признаку, возрастному критерию и не имеют различий по социально-экономическим факторам риска здоро- вью. Законные представители детей добровольно подписали информированное согласие на участие и публикацию данных несовершеннолетних, участвующих в обследовании.
Химико-аналитическое исследование крови на содержание никеля и меди осуществляли в соответствии с действующими в Российской Федерации методическими указаниями МУК 4.1.3230-14 «Измерение массовых концентраций химических элементов в биосредах (кровь, моча) методом масс-спектрометрии с индуктивно связанной плазмой»3. Использовано аналитическое оборудование: масс-спектрометр с индуктивно связанной аргоновой плазмой Agilent 7500cx (США).
Исследование протеомного профиля плазмы крови детей группы наблюдения и контроля выполнено по технологии двухмерного электрофореза в полиакриламидном геле в соответствии с методиками, рекомендованными для используемого оборудования [7–9]. Полученные электрофореграммы плазмы крови визуализировали методом окраски серебром и документировали с помощью системы для гель-документирования (BioRad, США). Анализ полученных протеомных карт проводили с помощью программного комплекса PDQuest (Bio-Rad, США). В полученной протеинограмме выделяли значимые белковые пятна по их интенсивности и проводили последующий анализ методом жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (на хроматографе UltiMate 3000 (Германия) и тандемном масс-спектрометре ABSciex 4000 QTRAP с источником ионизации Nanospray 3 (Канада)). Данные тандемных экспериментов обрабатывались программой ProteinPilot, версия 4.5 (AB SCIEX), c идентификацией по базе данных UniProt_sprot_fasta (от 24.11.2017), с выборкой по таксону Homo Sapience. Основная часть информации о полученных белках экстрагирована из баз данных UniProt. Установление гена, которому соответствует идентифицированный белок, выполнено с помощью базы данных HGNC database of human gene name.
Характеристики выборок представляли в виде среднего значения ( М ) и ошибки репрезентативности ( m ). Статистическую значимость различий переменных между группами наблюдения и сравнения определяли по критерию Манна – Уитни. Статистическую обработку данных осуществляли с помощью пакета программ Statistica 10.
Для сопоставительного анализа прогнозируемых негативных эффектов в исследуемой выборке (возраст 4–6 лет) использовали оценку заболеваемости детей в возрасте 10–12 лет (по МКБ-10) по данным углубленных исследований.
Маркерные белковые пятна обосновывали на основании полученных достоверных причинно-следственных связей, описываемых многофакторными моделями зависимости «статистически значимое пятно – концентрация никеля и меди в крови» с помощью линейной регрессии. Достоверность и адекватность полученных моделей оценивали на основе дисперсионного анализа с использованием F -критерия Фишера, коэффициента детерминации ( R 2), t -критерию Стьюдента при статистической значимости p ≤ 0,05.
Результаты и их обсуждение. Анализ результатов химико-аналитических исследований крови на содержание никеля и меди позволил установить, что у детей в группе наблюдения выявлен повышенный в 1,2 раза уровень меди (1,04 ± 0,09 мг/дм3) по сравнению с его концентрацией (0,87 ± 0,09 мг/дм3) в группе контроля ( р = 0,011), а также увеличение содержания никеля в крови (0,007 ± 0,002 мг/дм3) до 3,5 раза относительно значения показателя (0,002 ± ± 0,0001 мг/дм3) в контрольной группе ( р = 0,001). Доля проб с содержанием меди и никеля в крови выше референтных значений4 ( RfL меди = 0,09 мг/дм3,
RfL никеля = 0,001 мг/дм3) составила от 77,0 до 82,0 % от общего числа обследованных детей, в то время как в группе контроля от 10,0 до 20,0 % проб.
В результате проведения двумерного электрофореза получены протеомные карты плазмы крови детей исследуемых выборок, в которых денситометрически определены относительные объемы белковых пятен (рис. 1).
Сравнительный анализ результатов денсито-метрического измерения протеомных карт плазмы крови обследуемых детей позволил выявить наличие достоверных различий относительного объема порядка 20 белковых пятен у детей группы наблюдения относительно соответствующих данных группы контроля (табл. 1).
У детей группы наблюдения установлено увеличение в 8,0–12,2 раза объема белковых пятен № 12 и № 18, а также уменьшение в 5,4 раза объема пятна № 19 относительно аналогичных пятен у детей в группе контроля ( р = 0,0001). Выделенные белки и гены, кодирующие их экспрессию, представлены в табл. 2.

а
Рис. 1. Фрагмент 2D-геля плазмы крови детей с указанием номера белковых пятен: а – индивид группы наблюдения, ; б – индивид группы контроля

б
Таблица 1
Спектр пептидов и белков, выделенных в протеомном профиле плазмы крови детей с повышенным содержанием меди и никеля в крови
|
Номер пятна |
Спектр пептида |
Вероятность идентификации пептида, % |
Наименование белка |
|
№ 2 |
RVDGSVDFYRDWATYK |
1,0 |
Фиколин-2 |
|
VDLVDFEDNYQFAK |
56,6 |
||
|
№ 4 |
VDGSVDFYR |
88,0 |
Фиколин-2 |
|
VDLVDFEDNYQFAK |
99,0 |
||
|
VNVDEVGGEALGR |
99,0 |
Бета-субъединица гемоглобина |
|
|
№ 8 |
INGKPLPGATPAK |
40,6 |
тРНК селеноцистеин 1-ассоциированный белок 1 |
4 Тиц Н.У. Клиническое руководство по лабораторным тестам. – М.: ЮНИМЕД-пресс, 2003. – 570 c.
Окончание табл. 1
|
Номер пятна |
Спектр пептида |
Вероятность идентификации пептида, % |
Наименование белка |
|
№ 9 |
GLCVATPVQLR |
99,0 |
Дополнение C4-B |
|
GSFEFPGDVSK |
64,9 |
||
|
LGQYASPTAKRCCQDGVTR |
1,0 |
||
|
QRIEALSLMHPSISFSLR |
59,0 |
Белок репарации несоответствия ДНК Mlh3 |
|
|
DSEATR |
1,0 |
||
|
FYGFR |
1,0 |
||
|
GVGKVPR |
34,1 |
P2Y-пуриноцептор 12 |
|
|
№ 10 |
NIVQNVR |
26,1 |
Сидерофлексин-3 |
|
№ 11 |
VSFLSALEEYTK |
99,0 |
Аполипопротеин A-I |
|
QGLLPVLESFK |
33,6 |
||
|
VKDLATVYVDVLK |
3,8 |
||
|
VDTLEIQGDVTLSYVQIR |
32,2 |
Галектин-4 |
|
|
№ 12 |
DYVSQFEGSALGK |
99,0 |
Аполипопротеин A-I |
|
QGLLPVLESFK |
59,9 |
||
|
LLKILLEVVK |
52,3 |
Якорный белок А-киназы 9 |
|
|
№ 13 |
CYTAVVPLVYGGETK |
99,0 |
J-цепь иммуноглобулина |
|
FVYHLSDLCK |
99,0 |
||
|
AVHVKAQEDER |
1,0 |
||
|
NHLLFWGVLAFIK |
1,0 |
||
|
RPSTPR |
73,2 |
Белковый фагот |
|
|
EKQFLNAESAYMDPMK |
0,2 |
||
|
DRGGRDYPPLR |
1,0 |
||
|
DSTSTAPDSQR |
0,1 |
||
|
LEPLGPGSSGRPGK |
1,0 |
||
|
VLRDGGCSLPIIPNITK |
0,2 |
||
|
HRAAEAAINILK |
72,9 |
Интерферон-индуцируемый активатор двухцепочечной РНК-зависимой протеинкиназы A |
|
|
№ 15 |
GLEEELQFSLGSK |
99,0 |
Дополнение C4-B |
|
DVPRGQVVK |
1,0 |
||
|
HQDFNSAVQLVENFCR |
99,0 |
Протромбин |
|
|
LAVTTHGLPCLAWASAQAK |
18,3 |
||
|
№ 16 |
GLEEELQFSLGSK |
99,0 |
Дополнение C4-B |
|
MPYSVGFR |
23,6 |
Анкирин-1 |
|
|
CYGMTDDKVDK |
1,0 |
||
|
№ 17 |
SIAQYWLGCPAPGHLR |
77,2 |
Витронектин |
|
№ 18 |
SIAQYWLGCPAPGHLR |
95,9 |
Витронектин |
|
№ 19 |
GSPAINVAVHVFR |
99,0 |
Транстиретин |
|
TSESGELHGLTTEEEFVEGIYK |
99,0 |
||
|
ALGISPFHEHAEVVFTANDSGPR |
94,7 |
||
|
AADDTWEPFASCK |
99,0 |
||
|
№ 22 |
DALSSVQESQVAQQAR |
99,0 |
Аполипопротеин C-III |
|
GWVTDGFSSLK |
99,0 |
||
|
DLTEAVPR |
94,1 |
Миотубулярин |
|
|
RDGPGLER |
42,7 |
НАД-зависимый протеин-деацетилаза сиртуин-1 |
|
|
LKSGSGPVR |
32,4 |
Нуклеоплазмин-3 |
|
|
№ 23 |
SIAQYWLGCPAPGHLR |
99,0 |
Витронектин |
|
DALSSVQESQVAQQAR |
3,9 |
Аполипопротеин C-III |
|
|
GWVTDGFSSLK |
42,2 |
||
|
№ 24 |
ESLSSYWESAK |
99,0 |
Аполипопротеин C-II |
|
№ 27 |
FFGHGAEDSLADQAANEWGR |
96,5 |
Сывороточный амилоидный белок А-1 |
|
FFGHGAEDSLAPQAANEWGR |
1,0 |
||
|
RGPGGAWAAEVISNAR |
93,0 |
Сывороточный амилоидный белок А-2 |
|
|
№ 28 |
SFFSFLGEAFDGAR |
99,0 |
Сывороточный амилоидный белок А-2 |
|
LVAASQAALGLK |
79,1 |
Альбумин |
|
|
APLAKYIGENQDSISSK |
1,0 |
||
|
YIGENQDSISSKLK |
1,0 |
||
|
VFDEFKPLVEEPQNLIK |
99,0 |
||
|
№ 30 |
SAVTALWGK |
99,0 |
Бета-субъединица гемоглобина |
|
VNVDEVGGEALGR |
99,0 |
||
|
VLGAFSDGLAHLDNLK |
55,6 |
||
|
№ 31 |
LLVVYPWTQR |
99,0 |
Субъединица гемоглобина гамма-2 |
Таблица 2
Пример спектра одного из пептидов, имеющего связь с повышенным содержанием одновременно меди и никеля в крови, представлен на рис. 2.
При построении многофакторных моделей установлены прямые причинно-следственные связи между повышенным содержанием в крови меди, никеля и увеличением относительного объема белкового пятна № 12, включающего последовательность белка аполипопротеина A-I и якорного белка А-киназы 9 ( R 2 = 0,30; b 0 = –656,8; b 1 = 1801,1; b 2 = 63518,1; р = 0,008) и белкового пятна № 18 (витронектин) ( R 2 = 0,44; b 0 = –1372,0; b 1 = 2743,3; b 2 = 112937,0; р = 0,0001). Выявлена также обратная зависимость уменьшения относительного объема белкового пятна № 19, включающего транстиретин, от повышенного содержания меди и никеля в крови ( R 2 = 0,35; b 0 = 4870,1; b 1 = –3266,9; b 2 = –79946,5; р = 0,003).
Анализ биологической функции идентифицированных белков плазмы крови по данным отечественной и зарубежной научной литературы позволяет прогнозировать развитие ряда негативных эффектов со стороны сердечно-сосудистой и нервной систем. Так, установленные белки аполипопротеин A-I и витронектин характеризуют преимущественно дисфункцию эндотелия, что в дальнейшем может способствовать развитию артериальной гипертонии и
кардиомиопатии [10]. Аполипопротеин A-I - липопротеин высокой плотности, обеспечивает освобождение клеток от избытка холестерина, тем самым предотвращает образование атеросклеротических бляшек и способствует повышению эластичности эндотелия сосудов [11–13]. Витронектин – это клеточно-адгезивный гликопротеин, продуцируемый и секретируемый клетками печени, который в патологических условиях ассоциируется с клеточными поверхностями, например, с активированными тромбоцитами и с внеклеточными матрицами различных тканей (фибрин) [14]. В результате происходит усиление адгезии тромбоцитов и их местной агрегации, что подтверждается данными экспериментальных исследований [15, 16]. При увеличении относительного объема белкового пятна, содержащего аполипопротеин A-I и витронектин, в условиях повышенной концентрации в крови меди и никеля, можно прогнозировать повреждение эндотелиальных клеток кровеносных сосудов активными формами кислорода, запуск провоспалительной реакции и освобождение цитокинов из тканей сердца, через транскрипционные факторы NF-κB (ядерный фактор «каппа-би») и AP-1 (белок-активатор 1), что представлено в ряде зарубежных и отечественных научных работ [17, 18].
Белки и кодирующие их гены, имеющие связь с повышенным содержанием меди и никеля в крови
|
Номер белкового пятна |
Направление изменения объема белкового пятна |
Наименование белка |
Относительный объем * белкового пятна ( M ± m ), int |
Ген, кодирующий белок |
Код гена, кодирующего белок, в базе данных Sviss Prot |
|
|
группа наблюдения ( n = 20) |
группа контроля ( n = 10) |
|||||
|
12 |
увеличение |
Аполипопротеин A-I |
2099 ± 135** |
171 ± 46 |
APOA1 |
P02647 |
|
Якорный белок А-киназы 9 |
AKAP9 |
Q99996 |
||||
|
18 |
увеличение |
Витронектин |
2731 ± 337** |
340 ± 101 |
VTN |
P04004 |
|
19 |
уменьшение |
Транстиретин |
498 ± 143** |
2687 ± 746 |
TTR |
P02766 |
П р и м е ч а н и е :
int* – интенсивность белкового пятна;
**
– достоверность различий средних значений, р ≤0,05.
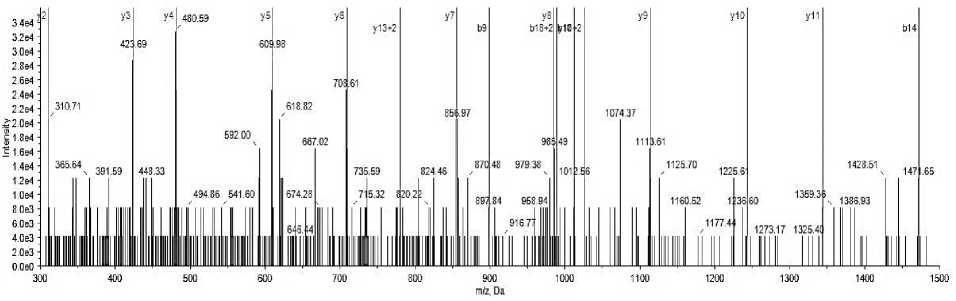
Рис. 2. Спектр пептида TSESGELHGLTTEEEFVEGIYK (Транстиретин) (база данных SwissProt) плазмы крови ребенка в пятне № 19
Якорный белок А-киназы 9 характеризует изменения в нейрорегуляции, поскольку ряд изоформ данного белка способен связываться с рецептором N-метил-D-аспартата в нервно-мышечном соединении и синапсах нейронов, что предполагает изменение в организации постсинаптической специализации [19]. По данным экспериментальных исследований избыточная экспрессия установленного белка может приводить к увеличению длины митохондрий и мембранного потенциала, что снижает чувствительность нейронов к постоянному напряжению в передаче сигналов [19, 20]. В свою очередь известно, что танстиретин – белок, играющий важную роль в развитии нервной системы, нейрональном росте и синаптогенезе, регуляции цитоархитектоники, обеспечивающих когнитивные функции центральной нервной системы (память, эмоциональное состояние, психическое здоровье) [21, 22]. Данное предположение подтверждают результаты зарубежных экспериментальных исследований [21, 23]. Следствием изменения экспрессии транстиретина являются возможные когнитивные нарушения и поведенческие отклонения [23].
По результатам сопоставительного анализа установленных изменений протеомного профиля плазмы крови детей в возрасте 4–6 лет и негативных эффектов, фактически реализованных, у детей в возрасте 10–12 лет выявлена достоверно повышенная в 2,2–3,0 раза частота встречаемости заболеваний по классу болезней сердечно-сосудистой (кардиомиопатии: I42) и нервной систем (функциональные расстройства центральной и вегетативной нервной систем: G90.9, G90.8) относительно соответствующих показателей в группе контроля ( р = 0,001–0,032). При этом у детей старшей возрастной категории установлены достоверные зависимости повышения частоты встречаемости заболеваний нервной системы в виде функциональных расстройств и кардиомиопатий от повышенного содержания в крови меди и никеля ( R 2 = 0,35–0,96; –1,94 ≤ b 0 ≥ –7,22; 1,76 ≤ b 1 ≥ 128,64; р = 0,0001–0,013).
Таким образом, обоснованные омик-маркеры (аполипопротеин A-I, витронектин, якорный белок А-киназы 9, транстиретин) и гены, кодирующие их экспрессию (APOA1, VTN, AKAP9, TTR), могут быть использованы для повышения эффективности
прогнозирования развития негативных эффектов, связанных с нарушением нейрорегуляции и эндотелиальной дисфункции с целью раннего выявления и профилактики негативных последствий со стороны здоровья у детей в условиях высокой аэрогенной нагрузки меди и никеля.
Выводы:
-
1. У детей с повышенным до 3,5 раза содержанием в крови меди и никеля выявлено порядка двадцати белковых пятен, достоверно отличающихся от таковых у детей группы контроля.
-
2. Установлены зависимости увеличения относительного объема трех белковых пятен, включающих аполипопротеин A-I, якорный белок А-киназы 9, витронектин, и уменьшения относительного объема одного белкового пятна, включающего транстиретин, от повышенного содержания в крови меди и никеля ( R 2 = 0,30–0,44; р = 0,0001–0,008).
-
3. Изменения относительного объема белковых пятен, включающих аполипопротеин A-I, якорный белок А-киназы 9, витронектин и транстиретин, являются прогностически значимыми для развития негативных эффектов, связанных с нарушением нейрорегуляции и эндотелиальной дисфункцией.
-
4. Доказана реализация прогнозируемых негативных эффектов в виде повышения частоты развития заболеваний нервной и сердечно-сосудистой системы при повышенной концентрации в крови меди и никеля ( R 2 = 0,35–0,96; р = 0,0001–0,013).
-
5. Для прогнозирования вероятности развития негативных эффектов со стороны сердечно-сосудистой и нервной систем до формирования тканевых и органных поражений обоснован перечень омик-маркеров в виде белков (аполипопротеин A-I, витронектин, якорный белок А-киназы 9, транстиретин) и генов, кодирующих их экспрессию (APOA1, VTN, AKAP9, TTR), позволяющий идентифицировать трансформированный протеомный профиль, ассоциированный с аэрогенным воздействием никеля и меди.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Выявление ОМИК-маркеров для прогнозирования риска развития негативных эффектов у детей с повышенным содержанием меди и никеля в крови
- Barbarini N., Magni P. Accurate peak list extraction from proteomic mass spectra for identification and profiling studies // BMC. Bioinformatics. - 2010. - Vol. 11, № 518. - Р. 1-14. DOI: 10.1186/1471-2105-11-518
- Шендеров Б.А. «Омик» - технологии и их значение в современной профилактической и восстановительной медицине // Вестник восстановительной медицины. - 2012. - № 3. - С. 70-78.
- Протеомные методы разделения и анализа белков / Т.А. Полунина, Ю.С. Варшавская, Г.В. Григорьева, Я.М. Краснов // Журнал микробиологии, эпидемиологии и иммунобиологии. - 2014. - № 3. - С. 107-114.
- Ahn S.-M., Simpson R.J. Body fluid proteomics: Prospects for biomarker discovery // Proteomics Clin. Appl. - 2007. -Vol. 1, № 9. - Р. 1004-1015. DOI: 10.1002/prca.200700217
- The proteome of a healthy human during physical activity under extreme conditions (Reviews) / I.M. Larina, V.A. Ivanis-enko, E.N. Nikolaev, A.I. Grigorev // A^ Naturae. - 2014. - Vol. 6, № 3 (22). - Р. 66-75.
- How many human proteoforms are there? / R. Aebersold, J. Agar, I. Amster, M.S. Baker, C.R. Bertozzi, E.S. Boja, C.E. Costello, B.F. Cravatt [et al.] // Nature chemical biology. - 2018. - Vol. 14, № 3. - Р. 206-214. DOI: 10.1038/nchembio.2576
- PROTEAN i12 IEF System. Instruction Manual. - Hercules: Bio-Rad Laboratories, Inc, 2011. - P. 60.
- PROTEAN II xi 2D cell. Instruction Manual. - Hercules: Bio-Rad Laboratories, Inc, 2011. - P. 52.
- ReadyPrep 2-D starter Kit. Instruction manual. - Hercules: Bio-Rad Laboratories, Inc, 2011. - P. 28.
- Chemical constituents of ambient particulate air pollution and biomarkers of in flammation, coagulation and homo-cysteine in healthy adults: a prospec tive panel study / S. Wu, F. Deng, H. Wei, J. Huang, H. Wang, M. Shima, X. Wang, Y. Qin [et al.] // Part. Fibre Toxicol. - 2012. - Vol. 9, № 49. - P. 1-13. DOI: 10.1186/1743-8977-9-49
- Исследование влияния рекомбинантного аполипопротеина А-I на работу сердечной мышцы в эксперименте / Р.А. Князев, Н.В. Трифонова, А.В. Рябченко, М.В. Котова, А.Р. Колпаков, Л.М. Поляков // Патология кровообращения и кардиохирургия. - 2018. - Т. 22, № 4. - С. 88-94.
- Maranhao R.C., Freitas F.R. HDL Metabolism and Atheroprotection: Predictive Value of Lipid Transfers // Advances in Clinical Chemistry. - 2014. - № 65. - Р. 1-41. DOI: 10.1016/B978-0-12-800141-7.00001-2
- Клиническое значение аполипопротеинов А и В / Г.А. Чумакова, О.В. Гриценко, Н.Г. Веселовская, Е.В. Ва-хромеева, А.А. Козаренко // Кардиоваскулярная терапия и профилактика. - 2011. - Т. 10, № 6. - С. 105-111.
- Vitronectin improves cell survival after radiation injury in human umbilical vein endothelial cells / H. Masaharu, Y. Takeshi, N. Katsuko, S.-N. Ai, F. Tomoko, M. Yuichi, G. Takaya, T. Katsushi // FEBS Open Bio. - 2012. - № 2. -Р. 334-338. DOI: 10.1016/j.fob.2012.10.002
- Ruggeri Z.M., Jackson S.P. Platelet Thrombus Formation in Flowing Blood // Platelet biology. - 2013. - № 2. -Р. 399-423. DOI: 10.1016/B978-0-12-387837-3.00020-1
- Plasminogen activator inhibitor-1 and its cofactor vitronectin stabilize arterial thrombi after vascular injury in mice / S. Konstantinides, K. Schafer, T. Thinnes, D.J. Loskutoff // Circulation. - 2001. - № 103. - Р. 576-583. DOI: 10.1161/01.cir.103.4.576
- Fine particulate matter components and emergency department visits for cardiovascular and respiratory diseases in the St. Louis, Missouri-Illinois, Metropolitan Area / S.E. Sarnat, A. Winquist, J.J. Schauer, J.R. Turner, J.A. Sarnat // Environ. Health Perspect. - 2015. - Vol. 5, № 123. - P. 437-444. DOI: 10.1289/ehp.1307776
- Колпакова А.Ф., Шарипов Р.Н., Колпаков Ф.А. Загрязнения воздуха взвешенными частицами как фактор риска сердечно-сосудистых заболеваний // Гигиена и санитария. - 2017. - Т. 96, № 2. - С. 133-137.
- Liu Yu., Merrill R.A., Strack S. A-Kinase Anchoring Protein 1: Emerging Roles in Regulating Mitochondrial Form and Function in Health and Disease (Review) // Cells. - 2020. - Vol. 9, № 298. - Р. 2-12. DOI: 10.3390/cells9020298
- AKAP1 Protects from Cerebral Ischemic Stroke by Inhibiting Drp1-Dependent Mitochondrial Fission / K.H. Flippo, A. Gnanasekaran, G.A. Perkins, A. Ajmal, R.A. Merrill, A.S. Dickey, S.S. Taylor, G.S. McKnight [et al.] // J. Neurosci. -2018. - Vol. 19, № 38. - P. 8233-8242. DOI: 10.1523/JNEUROSCI.0649-18.2018
- Thyroid hormone signaling and adult neurogenesis in mammals / S. Remaud, J.-D. Gothie, G. Morvan-Dubois, B.A. Demeneix // Front. Endocrinol. - 2014. - Vol. 5, № 62. - Р. 1-7. DOI: 10.3389/fendo.2014.00062
- Возможная роль транстиретина в биологическом механизме пептидной нейропротекции / Т.В. Вьюнова, Е.В. Медведева, Л.А. Андреева, Л.В. Дергунова, С.А. Лимборская, Н.Ф. Мясоедов // Молекулярная генетика, микробиология и вирусология. - 2016. - Т. 34, № 3. - С. 104-109.
- Brouillette J., Quirion R. Transthyretin: a key gene involved in the maintenance of memory capacities during aging // Neurobiol. Aging. - 2008. - Vol. 29, № 11. - Р. 1721-1732. DOI: 10.1016/j.neurobiolaging.2007.04.007


