Взаимодействие глобина крысы и человека с ацетилсалициловой кислотой in vitro: масс-спектрометрическая идентификация ацетилированных лизинов
Автор: Дубровский Я.А., Гладилович В.Д., Подольская Е.П., Бабаков В.Н., Гончаров Н.В., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
В работе исследовали возможность взаимодействия ацетилсалициловой кислоты (АСК) с очищенным глобином человека и крысы in vitro. Показано, что глобин крысы способен модифицироваться АСК по К-17 и К-57 в субъединице альфа и К-96 в субъединице бета, а глобин человека - по К-17, К-41, К-57 в субъединице альфа и К-18, К-121 в субъединице бета.
Ацетилсалициловая кислота, гемоглобин, аддукты, масс-спектрометрия, малди
Короткий адрес: https://sciup.org/14264688
IDR: 14264688 | УДК: 615.011.4:
Текст научной статьи Взаимодействие глобина крысы и человека с ацетилсалициловой кислотой in vitro: масс-спектрометрическая идентификация ацетилированных лизинов
Точную моноизотопную массу и форму изотопного распределения для пептидов с нестандартными модификациями получали при помощи программы MassPro.
(МС-МС)-спектры обрабатывали с помощью программы Sequence Viewer 2.0 (ИАП РАН).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При взаимодействии сложных эфиров с первичными и вторичными аминами происходит ацетилирование последних с образованием N-замещенных амидов (рис. 1). Ацетилсалициловую кислоту можно отнести к сложным эфирам (рис. 2), поэтому логично ожидать, что она способна образовывать ковалентные аддукты с гемоглобином, в состав которого входит 22 лизина, содержащих свободную аминогруппу.
Для выявления аддуктов аспирина исследовали образцы очищенного глобина крысы и человека (в результате выделения и очистки простетичная группа отщепляется и остается только сам белок — глобин) после инкубации с АСК in vitro с помощью масс-спектрометра, снабженного источником ионов MALDI. Масс-спектры цельных белков, полученные в линейном режиме, продемонстрированы на рис. 3. На рисунке показано, что в образцах, инкубированных с аспирином, появляются сигналы, смещенные в область тяжелых масс по сравнению с контролем. Из чего можно сделать выводы, что глобин способен присоединять некоторое количество остатков уксусной кислоты. Поскольку линейные спектры малоинформативны, были получены масс-спектры триптических гидролизатов модифицированных белков, в которых был проведен поиск сигналов с массами, отличающимися на величину 42 Да от расчетных значений масс триптических пептидов субъединиц альфа и бета глобинов крысы и человека.
В результате был обнаружен ряд ацетилированных пептидов (табл. 2):
для субъединицы альфа глобина крысы
NCWGKIGGHGGEYGEEALQR (МН+ 2202.35 Да), TYFSHIDVSPGSAQVKAHGK (МН+ 2171.19 Да);
для субъединицы бета глобина крысы
GTFAHLSELHCDKLHVDPENFR (МН+ 2607.33 Да);
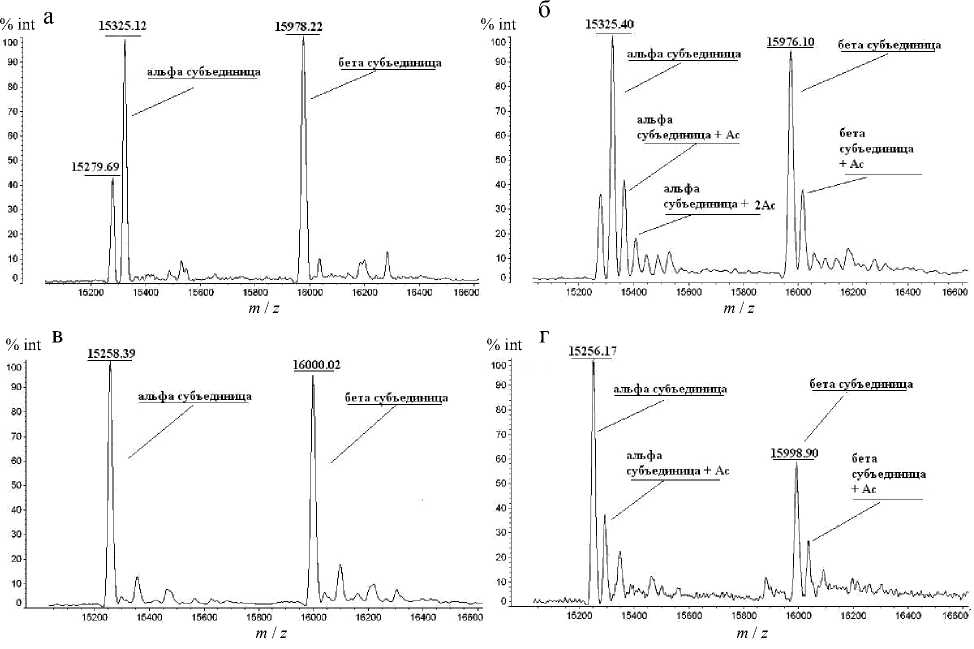
Рис. 3. Линейные масс-спектры.
а — глобин крысы (контроль); б — глобин крысы, инкубированный с АСК;
в — глобин человека (контроль); г — глобин человека, инкубированный с АСК
Табл. 2. Массы ацетилированных пептидов, обнаруженных в спектрах триптических гидролизатов глобина крысы и человека, инкубированных с АСК
|
Глобин |
MH+, Да (теор.) |
MH+ + аддукт, Да (теор.) |
MH+ + аддукт, Да (экспер.) |
№ в по-следовательно-сти |
Последовательность |
|
|
ей О |
Альфа-субъединица |
2159.98 |
2202.03 |
2202.35 |
17 |
NCWGK*IGGHGGEYGEEALQR |
|
2129.08 |
2171.12 |
2171.19 |
57 |
TYFSHIDVSPGSAQVK*AHGK |
||
|
Бета-субъединица |
2564.22 |
2606.26 |
2607.33 |
96 |
GTFAHLSELHCDK*LHVDPENFR |
|
|
О m о ^ О |
Альфа-субъединица |
2886.43 |
2928.47 |
2928.41 |
41 |
MFLSFPTTK*TYFPHFDLSHGSAQVK |
|
2213.09 |
2255.13 |
2255.18 |
57 |
TYFPHFDLSHGSAQVK*GHGK |
||
|
2043.00 |
2085.04 |
2085.12 |
17 |
AAWGK*VGAHAGEYGAEALER |
||
|
Бета-субъединица |
3078.65 |
3120.69 |
3121.63 |
121 |
LLGNVLVCVLAHHFGK*EFTPPVQAAYQK |
|
|
2228.17 |
2270.21 |
2270.30 |
18 |
SAVTALWGK*VNVDEVGGEALGR |
||
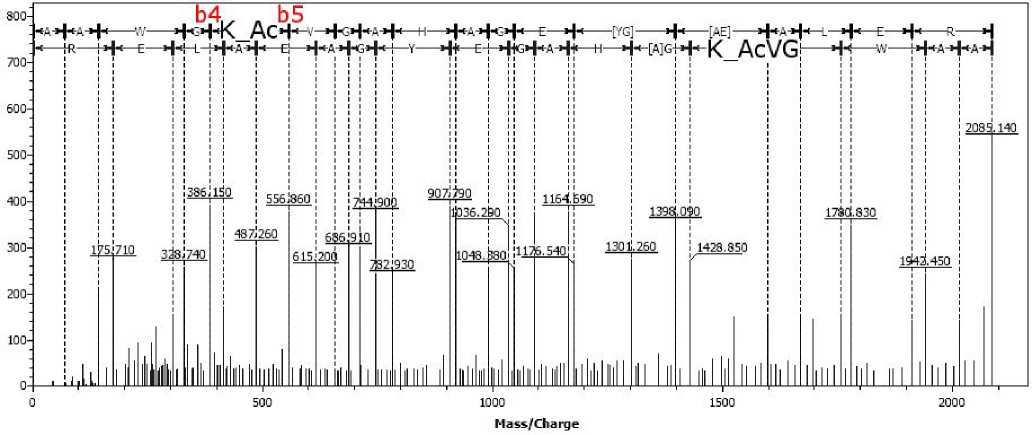
Рис. 4. (МС-МС)-спектр пептида AAWGK Ас VGAHAGEYGAEALER (2085.12 Да), входящего в состав альфа-субъединицы глобина человека, ацетилированного по лизину-17, обработанный в программе Sequence Viewer 2.0
для субъединицы альфа глобина человека
MFLSFPTTKTYFPHFDLSHGSAQVK
(МН+ 2928.41 Да),
TYFPHFDLSHGSAQVKGHGK (МН+ 2255.18 Да), AAWGKVGAHAGEYGAEALER (МН+ 2085.12 Да);
для субъединицы бета глобина человека
LLGNVLVCVLAHHFGKEFTPPVQAAYQK (МН+ 3121.63 Да) и
SAVTALWGKVNVDEVGGEALGR
(МН+ 2270.30 Да).
Следует обратить внимание, что при триптическом гидролизе разрыв аминокислотной последовательности происходит по аргинину и, что немаловажно, по лизину. Каждый из обнаруженных пептидов содержит неконцевой лизин. Можно предположить, что реакция гидролиза не прошла именно потому, что эти аминокислоты содержат модификацию остатком АСК.
Для подтверждения данного предположения обнаруженные пептиды были проанализированы методом тандемной масс-спектрометрии. (МС-МС)-анализ показал, что все обнаруженные пептиды действительно ацетилированы по лизину. В качестве примера на рис. 4 представлен (МС-МС)-спектр пептида
AAWGK Ас VGAHAGEYGAEALER.
Как показано на рисунке, по сигналам фраг-ментных ионов практически полностью восста- новлена аминокислотная последовательность пептида, а разница масс между фрагментными ионами b4 и b5 соответствует остатку лизина, модифицированного АСК. Это полностью доказывает наличие модификации на остатке неконцевого лизина в пептиде AAWGKАсVGAHAGEYGAEALER.
Таким образом, в результате работы было показано, что глобин крысы способен модифицироваться АСК по К-17 и К-57 в субъединице альфа и по К-96 в субъединице бета, а глобин человека — по К-17, К-41,К-57 в субъединице альфа и К-18, К-121 в субъединице бета.


