Взаимосвязь клинических проявлений и патоморфологических изменений в стенке мочевого пузыря при рецидивирующих инфекциях нижних мочевых путей у женщин
Автор: Галкина Н.Г., Галкин А.В., Родина О.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 3 т.18, 2025 года.
Бесплатный доступ
Введение. Профилактика хронической инфекции нижних мочевых путей (ИМП) является важным и часто, сложно решаемым вопросом. Изучение морфологической структуры стенки мочевого пузыря при хроническом бактериальном воспалении дает возможность изучить патологические изменения и назначить оптимальное лечение в каждом конкретном случае. Цель исследования: изучить особенности патоморфологии слизистой оболочки мочевого пузыря, их взаимосвязь с клиническими проявлениями хронической ИМП у женщин. Материалы и методы. Мы проспективно включили в исследование 58 пациенток с хроническим рецидивирующим циститом (ХЦР), имеющих не менее трех эпизодов обострения цистита в год или двух эпизодов за последние шесть месяцев. Диагноз бактериального цистита был подтвержден данными общего (клинического) и бактериологического анализа мочи. Всем пациентам через один-три месяца после полного разрешения последнего эпизода ХРЦ была проведена видеоцистоскопия с биопсией стенки мочевого пузыря способом «холодных» щипцов. Для оценки силы связи (корреляции) между клиническими данными, выраженностью изменений при гистологическом исследовании и суммарным баллом опросника Pelvic Pain and Urgency/Frequency Patient Symptom Scale (PUF Scale) – Шкала симптомов тазовой боли, ургентности и частоты мочеиспускания (PUF Scale) был проведен корреляционный анализ по Spearman. За статистически значимые принимали различия при p<0,05. Результаты. Морфологический анализ биоптатов подтвердил наличие хронического воспаления у всех 58 пациенток (100%) в сочетании со склерозированием в 70,1 % случаев (у 41 женщины). Результаты гистопатологического исследования показали нарушение целостности уротелия в 91,4% случаев (53 пациентки), в т. ч. в 63,8% с его уплощением вплоть до одного слоя или полной денудации. Выраженность хронического воспаления в слизистой оболочке мочевого пузыря имеет прямую сильную взаимосвязь со степенью поражения слоя зонтичных клеток, целостностью уротелия и общим баллом PUF Scale, а также с числом рецидивов цистита в течение года. Выводы. Отсутствие эффективности в лечении хронической ИМП, сокращение длительности безрецидивного периода, ухудшение качества жизни пациентов с ХРЦ могут быть обусловлены дефицитом пролиферации уротелиальных клеток и потерей уротелия, лежащей в основе рецидивирования при хроническом бактериальном цистите. Для успешного лечения ХРЦ необходима терапия, направленная на ускорение регенерации эпителия и восстановление его целостности.
Мочевой пузырь, хронический цистит, патоморфология, уротелий
Короткий адрес: https://sciup.org/142246111
IDR: 142246111 | DOI: 10.29188/2222-8543-2025-18-3-72-79
Текст научной статьи Взаимосвязь клинических проявлений и патоморфологических изменений в стенке мочевого пузыря при рецидивирующих инфекциях нижних мочевых путей у женщин
экспериментальная и клиническая урология № 3 2025
Рецидивирующая инфекция мочевыводящих путей (ИМП) является широко распространенной патологией в клинической практике урологов.
Согласно совместному отчету Международной урогинекологической ассоциации (International Urog-ynecological Association – IUGA) и Международного общества по проблемам недержания мочи (International Continence Society – ICS) о терминологии дисфункции тазового дна у женщин,рецидивирующая инфекция мочевыводящих путей (ИМП) определяется при наличии трех или более симптоматических и подтвержденных клинически случаев ИМП в течение предшествующих 12 месяцев [1]. В 2011 году Секция инфекций в урологии Европейской ассоциации урологов (European Association of Urology (EAU)) предложила систему классификации ORENUC, согласно которой рецидивирующие ИМП классифицируются при наличии рецидивов неосложненных и/ или осложненных ИМП с частотой не менее трех ИМП в год или двух ИМП за последние шесть месяцев. Рецидивиро-вание цистита происходит примерно у половины женщин, находящихся в менопаузе, и, примерно у каждой третьей женщины репродуктивного возраста [2].
Более 80% ИМП вызваны уропатогенной Uro-Pathogenic Escherichia coli (UPEC). Согласно исследованию «Дармис-2018» наиболее частым возбудителем ИМП является Escherichia coli , при неосложненных вне-больничных ИМП этот возбудитель выявляется в 74,6% случаев. При этом до 68% рецидивных ИМП вызываются штаммами UPEC, которые фенотипически или генотипически идентичны бактериальному штамму вызвавшему первоначальную инфекцию [3–5].
Ранее считалось, что UPEC являются строго внеклеточными патогенами. Однако на настоящий момент проведено достаточное количество исследований,до-казывающих, что UPEC способна к инвазии уротелиальных клеток и внутриклеточной репликации. Прежде чем выйти во внеклеточную среду для повторного заражения они могут локализоваться в уротелиальных клетках, избегая действия антибактериальных препаратов. Процесс инвазии уропатогенной E. coli возможен за счет факторов адгезии,прежде всего белка FimH, который связывается с уроплакинами экспрессируемыми на поверхности зонтичных клеток запуская процесс интернализации бактерий. Недавние данные показали, что другие уропатогены, такие как Enterococcus faecalis и стрептококки группы В, обладают одинаковым потенциалом для проникновения в уротелиальные клетки, хотя механизм, ответственный за клеточную инвазию, различен [6–7].
В ответ на проникновение UPEC возникает защитная реакция организма в виде эксфолиации поверхностных клеток уротелия с целью эрадикации возбудителя из организма. Но при определенных условиях инфицированные кишечной палочкой слущенные зонтичные клетки взаимодействуют с эпителием нижележащих отделов мочевого пузыря и инфицируют их. Этот процесс способствует рецидивированию цистита. Хроническое воспаление, апоптоз и нарушение барьерной функции уротелиальных клеток могут лежать в основе патофизиологии рецидива ИМП у женщин. Хроническое воспаление может сохраняться в слизистой оболочке мочевого пузыря после разрешения ИМП, что может способствовать дисфункции уро-телия,нарушению барьерной функции и рецидиви-рованию. Нарушение барьерной функции

уротелия в значительной степени связано с хроническим воспалением и, возможно, является причиной повышенного уротелиального апоптоза [8–9].
Наличие хронического бактериального цистита не является показанием к биопсии стенки мочевого пузыря, хотя очень важно понимать, какие патомор-фологические изменения соответствуют тем или иным особенностям клинического течения рецидивирующего цистита.
Целью нашего исследования было изучение особенностей патоморфологии слизистой оболочки мочевого пузыря, их взаимосвязи с клиническими проявлениями хронического рецидивирующего цистита у женщин.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 58 пациенток с рецидивирующими бактериальными циститами.
Все они получали лечение в соответствии с действующими стандартами и рекомендациями,утвер-жденными Минздравом России,и отмечали наличие двух обострений цистита в течение полугода или трех – в течение года.
Всем больным проводили в обязательном порядке сбор жалоб, изучение анамнеза, физикальное обследование,общий анализ и бактериологическое исследование мочи,пациентки заполняли опросник симптомов острого цистита (Acute Cystitis Symptom Score – ACSS) и непрерывно в течение 72 часов – дневник мочеиспусканий. Для исключения осложняющих факторов по показаниям выполнялось ультразвуковое исследование (УЗИ) мочевого пузыря с контролем остаточной мочи и урофлоуметрия.
Пациентки с нейрогенной дисфункцией нижних мочевых путей, инфравезикальной обструкцией, камнями мочевого пузыря, опухолью мочевого пузыря и другими осложняющими факторами были исключены. Для проведения дифференциальной диагностики с синдромом хронической тазовой боли,а также для оценки влияния дискомфорта/боли в области органов малого таза на качество жизни, использовали валидные, рекомендованные опросники: «Показатель мочеполовой боли у женщин» («Female Genitourinary Pain Index», F-GUPI), включающий 9 вопросов с максимальной суммой баллов, равной 45, и «Шкалу симптомов тазовой боли,ургентности и частоты мочеиспускания» (Pelvic Pain and Urgency/Frequency Patient Symptom Scale (PUF Scale)) [10].
Последнее обострение цистита у включенных в исследование пациенток наблюдалось за 2–3 месяца до начала исследования. После проведенного лечения включавшего антибактериальную терапию,все женщины отмечали клиническое выздоровление в течение как минимум двух недель и в общем анализе мочи число лейкоцитов было меньше 5 в поле зрения и отсутствовал рост микрофлоры при бактериологическом исследовании мочи. Госпитализация проводилась в отделение урологии ГБУЗ «Пензенская областная клиническая больница им. Н.Н. Бурденко» с целью выполнения видеоцистоскопии с биопсией стенки мочевого пузыря.
Биопсийный материал получали из боковой и задней стенок мочевого пузыря примерно на 2 см выше устья мочеточника из наиболее патологически измененных областей с использованием способа «холодных» щипцов.
Полученные биоптаты отправлялись в патологоанатомическую лабораторию после 24-часовой фиксации в нейтральном забуференном формалине. Гистологическую проводку (обезжиривание и обезвоживание, просветление, парафинирование) производили по стандартной технологии в тканевом гистопроцессоре. Срезы из парафиновых блоков толщиной 3–5 мкм получали с помощью ротационного микротома RMD 3000 (ООО «МедТехникаПоинт» Россия), окрашивали при помощи гематоксилин Майера-эозин («БиоВитрум», Россия). Микроскопию препаратов проводили с помощью прямого светового микроскопа ZEISS Primo Star («Карл Цейсс Микро-скопи ГмбХ», Германия) в разрешениях x10 0, x20 0 х400. При микроскопии препаратов оценивали состояние уротелия,определяли признаки тканевого воспаления,особенности клеточного состава инфильтратов, признаки ремоделирования и патологической трансформации тканей. Морфологическая оценка выполнялась патоморфологами без знания клинических данных.
Для статистической обработки данных использовали пакет программ Statistica 6.0 (StatSoft Inc. Tulsa,OK, USA). Нормальность распределения проверяли с помощью теста Колмогорова Смирнова-Lil-liefors. Для оценки силы связи (корреляции) между показателями был проведен корреляционный анализ по Spearman. За статистически значимые принимали различия при p < 0,05.
РЕЗУЛЬТАТЫ
Оценка возраста и менструальной функции
Средний возраст женщин составил 45+15,5 года (в возрасте от 20 до 78 лет). В возрастную группу от 20 до 29 лет вошли 11 женщин (19 %), от 30 до 39 лет – 14 (24,1 %), от 40 до 49 лет – 12 (20,7 %), от 50 до 59 лет – 8 (13,8 %), от 60 до 69 лет – 8 (13,8 %) и от 70 до 79 лет – 5 (8,6 %). Большая часть из группы наблюдения, 35 пациенток (60,3%), была в репродуктивном возрасте (34,5+8,3 года), 23 женщины (39,7 %) находились в состоянии менопаузы или постменопаузы (60,8+9,3 лет).
Менопауза и климактерическое состояние расценивались как стойкое прекращение менструаций 12 мес.
Оценка выраженности симптомов и влияния их на качество жизни
Опросники оценки выраженности симптомов и влияния на качество жизни были заполнены всеми пациентками непосредственно перед выполнением цистоскопии.
Результаты применения PUF Scale: средний балл выраженности симптомов составил 9,9+5,1, средний балл обеспокоенности симптомами – 4,9+3,1, средний общий балл шкалы – 14,7+7,9. При этом у 17 пациенток общий балл шкалы PUF был в интервале, равном 5-9 баллам, у 17 – в интервале 10-14 баллов, у 17 – в интервале 15-19 баллов и у 7 общий балл был равен 20 баллам или выше. Уровень баллов свидетельствует о наличии у всех пациенток тазовой боли и высокой вероятности ее хронизации.
При использования опросника F-GUPI были получены следующие результаты: средний балл подшкалы боли – 7,9+1,2, средний балл подшкалы расстройств мочеиспускания – 2,2+1,3, средний балл подшкалы качества жизни 4,2+0,9, общая сумма баллов шкалы, в среднем, была равна 14,2+0,7. Показатель тазовой боли, согласно опроснику GUPI, у женщин, принявших участие в исследовании, оказался средним, поскольку данная шкала оценивает выраженность симптомов в течение недели до опроса, а в нашем случае, в период ремиссии заболевания,поэтому данные применения опросника GUPI не использовались для характеристики клинических проявлений при патоморфологи-ческих изменениях слизистой мочевого пузыря.
Микробиологическое исследование мочи
Бактериологическое исследование мочи выполнялось во время рецидива хронического цистита до начала лечения и были обнаружены следующие уропатогены: Escherichia coli у 34 пациенток (58,6 %), Klebsiella pneumoniae у 15 (25,9 %), Enterococcus faecalis – 4 (6,9 %) Proteus mirabilis – 4 (6,9 %), Enterobacter cloacae у 1 (1,7 %) женщины, соответственно. Бактерии присутствовали в моче в высокой концентрации: 105 –107 КОЕ/мл.
Морфологическая оценка изменений в стенке мочевого пузыря у пациенток с рецидивирующими циститами
Была разработана и использована в работе шкала оценки гистопатологических изменений при морфологической оценке биоптатов стенки мочевого пузыря (табл. 1).
Таблица 1. Шкала оценки гистопатологических изменений в стенке мочевого пузыря при рецидивирующем цистите Table 1. Scoring scale for histopathological features of urinary bladder biopsies in recurrent cystitis
|
Шкала в баллах Scale in points |
Оценка степени выраженности Assessment of severity |
Состояние уротелия Condition of the urothelium |
Время появления АПЖ после АТП (месяц) Time of PA onset after KT (months) |
Возбудитель Pathogens |
Лечение Treatment |
|
0 |
Норма Normal |
Норма Normal |
Норма Normal |
Признаков воспаления нет No signs of inflammation |
Признаки склерозирования отсутствуют No signs of sclerosis |
|
1 |
Незначительные изменения Minor changes |
Эпителий незначительно уплощен, отмечается частичная потеря зонтичных клеток The epithelium is slightly flattened, with partial loss of umbrella cells |
Потеряно менее трети зонтичных клеток Less than one-third of umbrella cells lost |
Лимфоциты присутствуют, единичные в поле зрения* Lymphocytes present, isolated in the field of view* |
Единичные очаги склероза Isolated foci of sclerosis |
|
2 |
Умеренные изменения Moderate changes |
Уплощение уротелия вплоть до одного слоя, отсутствие слоев и/или связи между эпителиоцитами Flattening of the urothelium to a single layer, absence of layers and/or connections between epithelial cells |
Потеряно от одной до двух третей зонтичных клеток One to two-thirds of umbrella cells lost |
Лимфоидные агрегаты до 100 в поле зрения Lymphoid aggregates up to 100 in the field of view |
Склерозирование на всем протяжении, утолщение незначительное Sclerosis throughout, slight thickening |
|
3 |
Тяжелые изменения Severe changes |
Уротелий обнажен полностью Urothelium completely exposed |
Потеряно от двух третей зонтичных клеток до их полной утраты Loss of two-thirds to complete loss of umbrella cells |
Выраженные лимфоидные агрегаты, 100 и более в поле зрения Pronounced lymphoid aggregates, 100 or more in the field of view |
Выраженное утолщение на всем протяжении Marked thickening throughout |
*При увеличении микроскопа х110
* Microscope magnification х110
Учитывая, что биоптаты были получены методом щипковой биопсии,которая позволяет получить не все слои стенки мочевого пузыря, в ходе морфологического исследования предоставлялось возможным изучить слизистый и подслизистый слои.
В таблице 2 представлено распределение пациенток с рецидивирующим циститом по степени выраженности морфологических изменений в стенке мочевого пузыря.
Исследовалось состояние уротелия, слоя зонтичных клеток, оценивалось хроническое воспаление, выраженность склероза собственной пластинки. Степень хронического воспаления определялась концентрацией лимфоцитов в уротелии и субуротелиальных мезенхимальных областях, что отражало адаптивный иммунный ответ. Наиболее тяжелое хроническое воспаление определялось наличием выраженных лимфоидных скоплений, образующих зародышевые центры. Дефекты уротелия мочевого пузыря оценивались по шкале от 0 (норма) до 3 (полное оголение уротелия). Целостность зонтичных клеток уротелия оценивалась как нормальная, если они покрывали 75–100% пло-
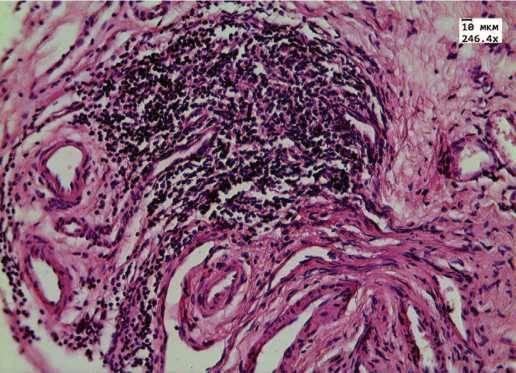
Рис. 1. Фиброз собственной пластинки в виде рубцовой трансформации. Выраженная очаговая инфильтрация лимфоцитами. Окраска гематоксилином и эозином, х 246,4
щади уротелия в полях зрения, остальные случаи считались дефектными. [11–12].
Морфологический анализ полученных в ходе видеоцистоскопии биоптатов стенки мочевого пузыря подтвердил наличие хронического воспаления у всех 58 пациенток (100%), о чем свидетельствует выявленная лимфоцитарная инфильтрация (рис.1, 2). Длительный воспалительный процесс в стенке мочевого пузыря сопровождался склерозированием в 70,1% случаев (у 41 женщины) (рис.1, 3). Результаты гистопатологического исследования показали нарушение целостности уротелия в 86,2% случаев (у 50 пациенток, соответственно), причем в 63,8% отмечалось уплощение уротелия вплоть до одного слоя,отсут-ствие слоев и/или связи между эпителиоцитами до полной денудации (рис. 2).
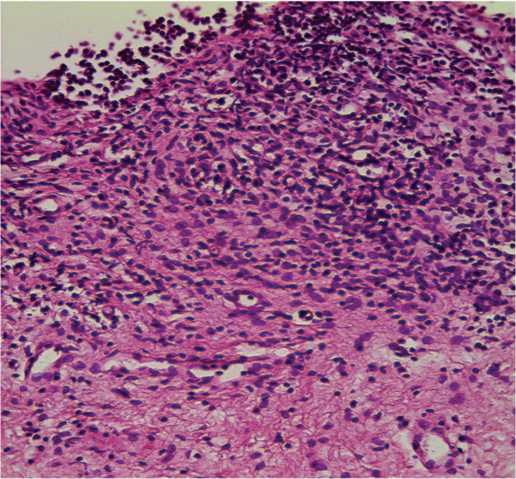
Рис. 2. Слизистая оболочка на большем протяжении представлена 1-2 слоями клеток, большинство из которых слущены и свободно лежат над базальной мембраной. Диффузная инфильтрация плазматическими клетками, лимфоцитами и гистиоцитами. Окраска гематоксилином и эозином, х 246,4
Таблица 2. Распределение пациенток с рецидивирующим циститом по степени выраженности морфологических изменения в стенке мочевого пузыря
Table 2. Distribution of patients with recurrent cystitis according to the severity of morphological changes in the bladder wall
|
Шкала в баллах Scale in points |
Состояние уротелия, n Condition of the urothelium, n |
Состояние зонтичных клеток, n Condition of umbrella cells, n |
Оценка хронического воспаления, n Assessment of chronic inflammation, n |
Выраженность склероза собственной пластинки, n Severity of sclerosis of the lamina propria, n |
|
0 |
8 |
8 |
0 |
17 |
|
1 |
13 |
12 |
15 |
19 |
|
2 |
31 |
28 |
22 |
16 |
|
3 |
6 |
10 |
21 |
6 |
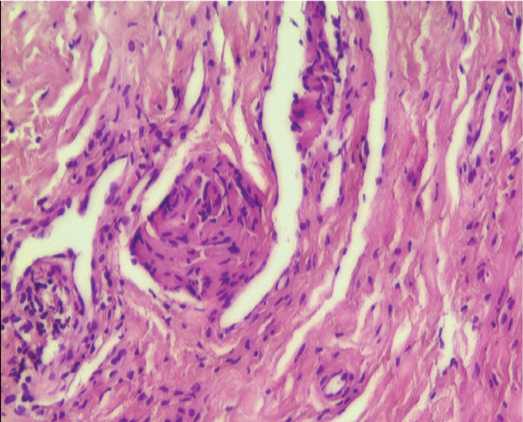
Рис. 3. Склероз собственной пластинки и подслизистой основы. Окраска гематоксилином и эозином, 246,4
Оценка взаимосвязи клинических проявлений хронического цистита и морфологических изменений в стенке мочевого пузыря
Для оценки силы взаимосвязи между гистопатологическими данными, полученными в ходе патомор-фологического анализа,и клиническими данными: общий балл опросника PUF, длительность заболевания (в годах), число обострений цистита в течение года предшествующего включению в исследование, возраст репродуктивная функция (есть менопауза или нет).
Полученные в ходе статистического анализа данные приведены в таблице 3.
Выраженность хронического воспаления в слизистой оболочке мочевого пузыря имеет прямую сильную взаимосвязь со степенью поражения слоя зонтичных клеток, целостностью уротелия и общим баллом шкалы симптомов тазовой боли, ургентности и
Таблица 3. Корреляционный анализ патоморфологических изменений и клинических данных при рецидивирующем цистите
Table 3. Correlation analysis of pathomorphological findings and clinical data in recurrent cystitis
|
Показатели Indicators |
PUF, общий балл PUF, total score |
Состояние уротелия Condition of the urothelium |
Состояние Выраженность Склероз Число рец. Длительность зонтичных хронического собственной за год заболевания клеток воспаления пластинки Number of Duration of the Condition of the Severity of chronic Sclerosis of the recurrences disease umbrella cells inflammation lamina propria per year КОЭФФИЦИЕНТ КОРРЕЛЯЦИИ / CORRELATION COEFFICIENT |
Возраст Age |
Менопауза Menopause |
||||
|
PUF, общий балл PUF, total score |
– |
0,83 |
0,84 |
0,87 |
0,56 |
0,57 |
0,86 |
0,4 |
0,295 |
|
Состояние уротелия Condition of the urothelium |
0,83 |
– |
0,81 |
0,76 |
0,58 |
0,6 |
0,7 |
0,4 |
0,26 |
|
Состояние зонтичных клеток Condition of the umbrella cells |
0,84 |
0,81 |
– |
0,75 |
0,43 |
0,51 |
0,72 |
0,45 |
0,35 |
|
Выраженность хронического воспаления Severity of chronic inflammation |
0,87 |
0,76 |
0,75 |
– |
0,52 |
0,5 |
0,77 |
0,41 |
0,35 |
|
Склероз собственной пластинки Sclerosis of the lamina propria |
0,56 |
0,58 |
0,43 |
0,52 |
– |
0,43 |
0,5 |
0,26 |
0,11 |
|
Длительность заболевания Duration of the disease |
0,57 |
0,6 |
0,51 |
0,5 |
0,43 |
– |
0,46 |
0, |
0,18 |
|
Число рец. за год Number of recurrences per year |
0,86 |
0,7 |
0,72 |
0,77 |
0,5 |
0,46 |
– |
0,47 |
0,27 |
|
Возраст Age |
0,45 |
0,4 |
0,45 |
0,41 |
0,26 |
0,3 |
0,47 |
– |
0,85 |
|
Менопауза Menopause |
0,29 |
0,26 |
0,35 |
0,35 |
0,11 |
0,18 |
0,27 |
0,85 |
– |
Примечания. 1) Красным цветом выделены достоверные значения коэффициента корреляции. В зависимости от значения коэффициента корреляции различают следующие корреляционные связи: сильная или тесная (при R> 0,70); средняя (при 0,50
Notes. 1) Reliable correlation coefficient values are highlighted in red. Depending on the correlation coefficient value, the following correlation relationships are distinguished: strong or close (when R> 0.70); moderate (when 0.50
инфекционно-воспалительные заболевания экспериментальная и клиническая урология № 3 2025 частоты мочеиспускания, а также с числом рецидивов цистита в течение года. Взаимосвязь средней силы выявлена между хроническим воспалением и склерозом собственной пластинки,умеренной силы – между длительностью заболевания,возрастом пациенток и их репродуктивной функцией. Состояние уротелия, в том числе слоя зонтичных клеток,тесно взаимосвязано с выраженностью симптоматики по шкале PUF с выраженностью хронического воспаления и числом рецидивов цистита в течение последнего роз собственной пластинки не имел тесной взаимосвязи с другими изучаемыми признаками.
Соответственно, чем более выражена потеря эпителия слизистой оболочки мочевого пузыря, тем хуже качество жизни,и короче межрецидивный период в течении хронического цистита.
ОБСУЖДЕНИЕ
Полученные нами данные свидетельствуют о том что при хронических рецидивирующих бактериальных инфекциях нижних мочевых путей, хронический воспалительный процесс ассоциирован с нарушением целостности переходноклеточного эпителия стенки мочевого пузыря.
Есть основания предполагать, что аномальная функция уротелиального барьера в значительной степени связана с хроническим воспалением и, возможно является причинным фактором повышенного уротелиального апоптоза, что ведет к дефициту уротелия и нарушению его целостности. Уротелиальная дисфункция обусловленная поврежденным химическим и клеточным барьером, является фактором способствующим облегчению проникновения кишечной палочки в уротелий, колонизации с формированием в большем количестве во всех его слоях, устойчивых как к врожденным (например, эксфолиации), так и к приобретенным механизмам защиты, а также к антибактериальной и иммунной терапии, покоящихся внутриклеточных резервуаров (QIR). Уротелий может секретировать провос-палительные цитокины и защитные гликопротеиновые бляшки, такие как уроплакин и белок Тамма-Хорс- фалла (THP), на поверхности мочевого пузыря в качестве анатомических барьеров. Известно, что у пациентов с рецидивирующей ИМП менее эффективны такие фундаментальные механизмы антибактериальной защиты, как секреция провоспалительных цитокинов и уроплакинов, ингибирование бактериальной адгезии [6, 13 – 14].
Бактериальные покоящиеся внутриклеточные резервуары в процессе регенерации эпителия мигрируют вместе с дифференцирующимися эпителиоцитами в зрелые поверхностные зонтичные клетки (длительность цикла зависит от скорости регенерации, с среднем, 2 недели после заражения. Находясь в поверхностных зонтичных клетках, UPEC трансформируется в размножающиеся внутриклеточные бактериальные сообщества, вызывая обострение рецидивирующей ИМП.
Недостаточность уротелиальной функции может быть вызвана рецидивирующей ИМП, и наоборот, дефицит уротелия стенки мочевого пузыря может является фактором риска хронизации ИМП. Формирующийся при этом «замкнутый круг» ведет к снижению эффективности стандартной терапии, уменьшению длительности безрецидивного периода и,как следствие, к значительному снижению качества жизни, что подтверждается полученными в результате нашего исследования данными. Чем тяжелее течение хронического рецидивирующего цистита,тем более поврежден слой переходноклеточного эпителия,вплоть до его полной денудации.
ЗАКЛЮЧЕНИЕ
Отсутствие эффективности в лечении хронической ИМП, сокращение длительности безрецидивного периода, ухудшение качества жизни пациентов с ХРЦ могут быть обусловлены дефицитом пролиферации уротелиальных клеток и потерей уротелия, лежащей в основе рецидивирования при хроническом бактериальном цистите. Для успешного лечения ХРЦ необходима терапия, направленная на ускорение регенерации эпителия и восстановление его целостности.
HTmiyPA/REFEREmS
ИПРАТШ/ЕШЕИШ
Сведения об авторах:
Галкина Н. Г. – к.м.н., доцент кафедры хирургии ФГБОУ ВО «Пензенский государственный университет»; доцент кафедры Онкологии и урологии, ПИУВ – филиал ФГБОУ ДПО РМАНПО Минздрава России; Пенза, Россия;
РИНЦ Author ID 58720,
Вклад авторов:
Галкина Н.Г. – концепция исследования, разработка дизайна исследования, анализ данных, критический обзор, научное редактирование, научное руководство, 45%
Галкин А.В. – обзор публикаций, сбор данных, анализ данных, статистическая обработка данных, написание статьи, 35%
Родина О.А. – сбор данных, анализ данных, 20%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Информированное согласие. Все пациенты подписали информированное согласие на участие в исследовании и обработку персональных данных
Этическое заявление. Исследование выполнено в соответствии положениями Хельсинкской декларации пересмотренной в Форталезе (Бразилия) в октябре2013 г.
Финансирование: Статья подготовлена без финансовой поддержки.


