Закономерности взаимодействия бычьего сывороточного альбумина с дифильными молекулами
Автор: Харлов А.Е., Анищук А.Н., Деркач С.Р., Левачев С.М.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 3 (38), 2012 года.
Бесплатный доступ
Методом флуоресценции исследовано взаимодействие глобулярного белка бычьего сывороточного альбумина с дифильными молекулами на примере катионных поверхностно-активных веществ (ПАВ) в водном растворе. Определены количественные параметры связывания катионных ПАВ сывороточным альбумином при образовании комплексов белок-ПАВ переменного состава.
Бычий сывороточный альбумин, поверхностно-активные вещества, флуоресценция, комплексы белок-пав, параметры связывания
Короткий адрес: https://sciup.org/142142558
IDR: 142142558 | УДК: 541.182.64:543.42.062
Текст научной статьи Закономерности взаимодействия бычьего сывороточного альбумина с дифильными молекулами
Сывороточные альбумины обладают уникальной способностью к избирательному связыванию гидрофобных веществ, например жирных кислот, липидов, билирубина, аминокислот [1, 2]. Процессы ассоциации сывороточного альбумина с ПАВ используются при разработке продуктов питания и новых лекарственных веществ, а также при селективной экстракции и очистке белка [3].
В многочисленных исследованиях взаимодействия глобулярных белков, особенно бычьего сывороточного альбумина (БСА), с ионными и неионными ПАВ [4-12] показано, что ПАВ взаимодействуют с БСА с образованием ассоциатов (комплексов) переменного состава, при этом наблюдаются существенные конформационные изменения вторичной структуры белка – доля спиральных a -цепей уменьшается [4, 5, 9, 11, 13], а термическая устойчивость вторичной структуры возрастает [7, 14]. БСА связывает либо индивидуальные молекулы ПАВ, либо образуются мицеллоподобные агрегаты (кластеры) ПАВ [4,5, 8, 10, 15]. При низких концентрациях ПАВ взаимодействие имеет электростатическую природу за счет связывания ионов ПАВ противоположно заряженными группами белка. При высоких концентрациях (в области критической концентрации ми-целлообразования (ККМ) и выше) число связанных молекул ПАВ резко возрастает в результате кооперативности процесса, определяющую роль при этом играют гидрофобные взаимодействия [6, 9, 12, 13, 16-19]. В этом случае мицеллы ПАВ формируются в различных точках частично развернутой полипептидной цепи белка. Размеры связанных агрегатов увеличиваются с ростом концентрации ПАВ вплоть до насыщения белка, причем их размер всегда меньше по сравнению с мицеллами в отсутствие БСА [5, 10, 20].
Целью данной работы является выяснение роли структурных особенностей макромолекулы БСА при связывании катионных ПАВ в смешанных растворах в широком диапазоне концентраций
ПАВ и молярного соотношения компонентов ПАВ/БСА. В работе использовали флуоресцентный метод, который успешно применяется для подобных исследований [11-13, 21-25]. БСА, как и многие белки, содержит флуорофоры: два триптофана ( Trp 135, Trp 214). Триптофан весьма чувствителен к полярности окружения, и спектры флуоресценции могут дать существенную информацию о процессе связывания молекул ПАВ и конформационных изменениях белка.
Материалы и методы
Бычий сывороточный альбумин (БСА) производства « Sigma», глобулярный белок, содержание белка 97 % , молярная масса 6,7∙104 Da, изоэлектрическая точка 4,9. Катионные ПАВ: октаде-кенилдигидроксоэтилметиламмоний хлорид (ОДМАХ) (С 23 Н 48 О 2 NCI), KKМ 1,5 ⋅ 10-4 М, хроматографически чистый, цетилтриметиламмоний бромид (ЦТАБ) (С 19 Н 42 NBr), ККМ 8 ⋅ 10-4 М, производства « Sigma».
Для приготовления растворов БСА, ПАВ и их смесей использовали бидистиллят с удельной электрической проводимостью (22 оС) 6,7 ⋅ 10-6 Ом-1 м-1. Смеси белка с ПАВ получали смешением исходных растворов компонентов. Концентрацию БСА в исследуемых смесях варьировали от 5∙10-6 до 2∙10-5 М. Концентрацию ПАВ варьировали в широком диапазоне до и после ККМ. рН растворов смесей БСА и ПАВ устанавливали равным 5,8.
Концентрацию белка определяли спектрофотометрически по оптической плотности растворов при длине волны 280 нм, используя молярный коэффициент поглощения для БСА 44720 М-1см-1 [24]. Измерения стационарной флуоресценции проводили с применением спектрофлуоримет-ра «Элюмин-2М». Длина волны возбуждения составляла 280 нм. Время жизни флуоресценции определяли из кинетики флуоресценции, измеренной с помощью наносекундного спектрометра «SP-70».
Результаты и их обсуждение
На рисунке 1 представлены зависимости относительной интенсивности флуоресценции БСА I / I 0 (где I 0 , I – интенсивность флуоресценции в отсутствие и в присутствии тушителя соответственно) от концентрации ПАВ при постоянной концентрации белка в растворе C БСА =2 ⋅ 10-5 М. Как видно из рисунка 1, относительная интенсивность флуоресценции резко уменьшается в определенном диапазоне концентраций ПАВ, что свидетельствует о сильном тушении флуоресценции БСА при введении катионных ПАВ.
Можно выделить 3 участка, характерных для обоих катионных ПАВ. В области низких концентраций ЦТАБ (рис. 1а) интенсивность флуоресценции уменьшается с ростом концентрации ПАВ. При концентрации ЦТАБ, равной 6 ⋅ 10-4 М, что соответствует соотношению 30 молекул ЦТАБ на одну молекулу белка, интенсивность флуоресценции достигает наименьшего значения и составляет 26% от исходного значения интенсивности. Далее с увеличением концентрации ЦТАБ интенсивность флуоресценции растет и при 5 ⋅ 10-3 М ЦТАБ составляет 40% от исходного значения I 0 , соотношение компонентов при этом равно 250 молекул ПАВ на молекулу белка. При дальнейшем увеличении концентрации ЦТАБ относительная интенсивность флуоресценции не меняется.
1,1 I / I0
1•
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
(а)
1,1 I / I0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
1∙10-8 1∙10-7 1∙10-6 1∙10-5 1∙10-4 1∙10-3 1∙10-2
(б)
0,2
1∙10-8 1∙10-7 1∙10-6 1∙10-5 1∙10-4 1∙10-3 1∙10-2
CЦТАВ, М
CОДМАХ, М
Рис. 1. Зависимость относительной интенсивности флуоресценции БСА от концентрации добавленного в раствор белка катионного ПАВ: ЦТАБ (а) и ОДМАХ (б), С БСА = 2 ⋅ 10-5 М, рН= 5.8, Т=293К
Аналогичная зависимость получена и при введении катионного ПАВ ОДМАХ (рис. 1б). Первоначально с ростом концентрации ОДМАХ интенсивность флуоресценции уменьшается, достигая наименьшего значения при 5 - 10-4 М ОДМАХ, при этом она составляет 32% от исходной интенсивности флуоресценции БСА, что соответствует 25 молекулам ПАВ на одну молекулу БСА. С увеличением концентрации ОДМАХ до 1 - 10-3 М интенсивность флуоресценции несколько увеличивается, достигая 38% от I 0 , что соответствует 50 молекулам ОДМАХ на молекулу белка, и далее остается постоянной. Необходимо отметить, что максимальное тушение флуоресценции в обоих случаях при введении ЦТАБ и ОДМАХ наблюдается при концентрациях катионных ПАВ в области ККМ.
Тушение флуоресценции может протекать по механизму динамического или статического тушения [25]. В обоих случаях зависимость относительной интенсивности от концентрации тушителя описывается уравнением Штерна-Фольмера (1):
I o /I = 1 + k q T o [Q, I o /I = 1 + K sv [Q], (1) где I0 , I - интенсивность флуоресценции флуорофора в отсутствие и в присутствии тушителя соответственно; kq - константа скорости реакции тушения; т0 - истинное время жизни флуоресценции (в отсутствие тушителя); [ Q ] - концентрация тушителя; K SV - константа Штерна-Фольмера (константа тушения).
Тушение происходит в результате образования в основном состоянии нефлуоресцирующего комплекса белок-ионное ПАВ. Если спектр поглощения такого комплекса близок к спектру поглощения белка, то возбуждающий свет будет поглощаться как свободными, так и связанными в комплекс молекулами БСА, а флуоресцировать будут лишь свободные молекулы БСА. При тушении по статическому механизму константа Штерна-Фольмера представляет собой константу равновесия образования комплекса в основном состоянии [26].
Полученные экспериментальные данные в области низких концентраций катионных ПАВ (см. рис. 1) проанализированы в рамках уравнения Штерна-Фольмера (1) (рис. 2 и табл. 1).
Линейный характер зависимости интенсивности флуоресценции БСА от концентрации ПАВ свидетельствует об образовании комплекса БСА-катионное ПАВ. Константы комплексообразования, вычисленные по уравнению (1), для обоих ПАВ близки и равны (4,7 ± 0,2) - 103 М ' 1 для ЦТАБ и (4,3 ± 0,4) - 103 М-1 для ОДМАХ (см. табл. 1). Истинное время жизни флуоресценции БСА т0 равно 3.9 - 10-9 с и не зависит от концентрации ПАВ, что свидетельствует о статическом тушении. Эти данные совпадают с литературными данными [12, 21]. В работе [21] при измерении времени жизни флуоресценции БСА в присутствии додецилсульфата натрия показано, что тушение флуоресценции протекает преимущественно по механизму статического тушения и обусловлено появлением молекул ионных ПАВ в ближайшем окружении триптофановой группы Trp 135. Для определения значимости механизма статического тушения в работе [23] построена зависимость ln ( I 0 /I) от числа связанных молекул цетилпиридиний хлорида. Полученная линейная зависимость позволила авторам сделать вывод о преимущественно статическом тушении флуоресценции БСА катионным ПАВ.
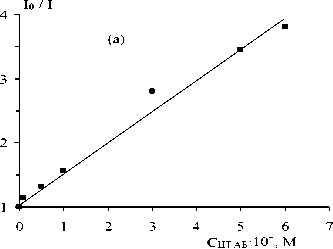
Рис. 2. Тушение флуоресценции БСА катионными ПАВ: ЦТАБ (а) и ОДМАХ (б), С бса = 2 - 10-5 М, рН =5.8, Т=293К
На рисунке 3 приведены спектры флуоресценции БСА и комплексов БСА-ЦТАБ. Длина волны максимума флуоресценции БСА без ПАВ Х м=340 нм. В области низких концентраций ПАВ образование комплексов (в диапазоне молярных соотношений ПАВ/белок от 2,5 до 30 моль
ЦТАБ/моль БСА) сопровождается постепенным сдвигом длины волны максимума флуоресценции в коротковолновую область и уменьшением интенсивности флуоресценции. Максимальный сдвиг на 8 нм ( λ м =332 нм) наблюдается при образовании комплексов БСА-ЦТАБ с молярным соотношением 30 моль ЦТАБ/моль БСА, что соответствует минимальному значению I/I 0 (рис. 1 а). Далее при увеличении соотношений компонентов в области высоких концентраций ПАВ длина волны максимума флуоресценции остается практически постоянной.
Таблица 1
Параметры связывания цетилтриметиламмоний хлорида (ЦТАБ), октадекенилдигидроксоэтилметиламмоний хлорида (ОДМАХ) и цетилтриметиламмоний хлоридом (ЦТАХ) бычьим сывороточным альбумином (БСА), рассчитанные по уравнению Штерна – Фольмера и по изотермам связывания, рН 5,8, Т=293К
|
ПАВ |
K SV ⋅ 10-3, М-1 |
n |
n н |
K ⋅ 10-3, М-1 |
|
ЦТАБ |
4.7 ± 0.2 |
75 ± 3 |
1.57 ± 0.01 |
1.2 ± 0.1 |
|
ОДМАХ |
4.3 ± 0.4 |
70 ± 26 |
1.38 ± 0.06 |
1.2 ± 0.4 |
|
ЦТАХ* |
8.9 ± 0.1 |
133 ± 20 |
1.91 ± 0.02 |
4.0 ± 0.4 |
* – данные работы [11].
Сдвиг максимума спектра флуоресценции комплексов БСА-ОДМАХ равен 4 нм и соответствует образованию комплексов при соотношении 25-50 моль ОДМАХ/моль БСА (рис. 1 б). Необходимо отметить, что присутствие ПАВ приводит к сдвигу длины волны максимума спектров поглощения на 1-3 нм в коротковолновую область.
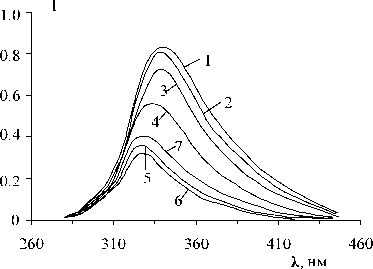
Рис. 3. Спектры флуоресценции БСА при различных концентрациях ЦТАБ, добавленного в раствор белка. С БСА = 2 ⋅ 10-5 М, С ЦТАБ ⋅ 104, М: 0(1), 0.1(2), 0.3(3), 1(4), 3(5), 5(6), 7(7), рН = 5.8, Т=293К
Полученные данные согласуются с результатами работ [11, 21, 27], в которых изучено взаимодействие БСА с додецилсульфатом натрия и цетилтриметиламмоний хлоридом и высказано предположение о существовании в растворе трех равновесных форм белка: собственно белок, комплекс белок-ПАВ и «частично денатурированный» белок. Использование кругового дихроизма показало уменьшение доли a –спиралей во вторичной структуре белка при ассоциации с ПАВ при больших концентрациях [11, 12]. Количественное соотношение между равновесными формами зависит от концентрации ионного ПАВ.
Экспериментальные данные по тушению флуоресценции БСА катионными ПАВ (см. рис. 1) позволяют рассчитать число ν (моль ПАВ/моль БСА) молекул ПАВ, связанных одной молекулой белка при разных молярных соотношениях компонентов в растворе. В области низких концентраций при С ЦТАБ < 6 ⋅ 10-4 М и С ОДМАХ < 5 ⋅ 10-4 число связанных молекул рассчитывали по формуле:
ν = a C S / C P ; (2)
a = ( I - I 0)/( I min - I 0) или a = ( I - 1) /( I min - 1) , (3) I 0 I 0
где a – степень связывания ПАВ белком; С S , С Р – общая концентрация ПАВ и белка, соответственно; I 0 , I и I min – интенсивность флуоресценции БСА, смесей БСА с ПАВ при различных концентрациях ПАВ и минимальная интенсивность.
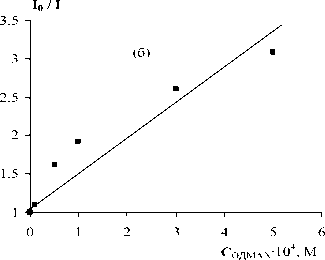
На рисунке 4 приведены изотермы связывания катионных (зависимость среднего числа молекул ПАВ, связанных одной молекулой БСА) в области низких концентраций ПАВ. В соответствии с [28, 29] образование комплексов белок-ПАВ переменного состава может быть представлено в виде ступенчатого равновесного процесса присоединения молекулы ПАВ (S) к макромолекуле белка (P), уже имеющей некоторое количество связанных молекул ПАВ.
Каждое из этих превращений характеризуется соответствующей константой равновесия. Константы комплексообразования каждой стадии в общем случае не равны, поскольку процесс связывания следующей молекулы зависит от числа уже присоединенных к белку молекул ПАВ.
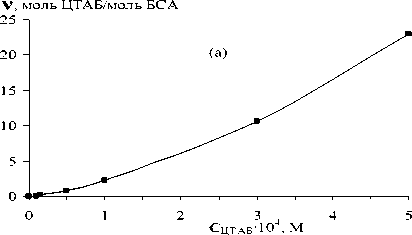
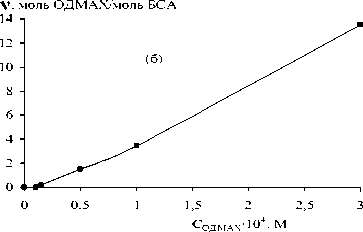
Рис. 4. Изотермы связывания ЦТАБ (а) и ОДМАХ (б) БСА при низких концентрациях катионных ПАВ.
На графиках: точки - экспериментальные данные, линии - обработка экспериментальных данных по уравнению (4), рН 5,8, Т=293К
С учетом кооперативности процесса число v молекул ПАВ, связанных макромолекулой белка, в зависимости от концентрации ПАВ может быть выражено следующим уравнением (4) [28, 29]:
v = n ( K [ S ]) n н , (4)
1 + ( K [ S ]) n н где n - число связанных лигандов (ПАВ); K - константа связывания ПАВ белком; пн - коэффициент кооперативности; [ S ] - концентрация лиганда (ПАВ). Параметры связывания ЦТАБ и ОДМАХ сывороточным альбумином представлены в таблице 1. Интересно отметить, что число n связанных в комплекс молекул катионного ПАВ приблизительно равно числу анионных групп макромолекулы белка. Сумма аминокислотных остатков аспарагиновой и глутаминовой кислот в БСА равна 100 [24].
Для сравнения в таблице 1 приведены константы образования комплекса БСА с цетилтриметиламмоний хлоридом (ЦТАХ) при рН 7.0 [11]. Константы для всех катионных ПАВ примерно одинаковы, более высокие значения KSV и K для ЦТАХ можно объяснить величиной рН. Депротонирование кислотных групп БСА при увеличении рН (от 5,8 до 7,0) приводит к конформационным изменениям белка, что способствует доступности молекул ПАВ к гидрофобным областям связывания, электростатические взаимодействия также увеличиваются. Соответственно коэффициент кооперативности и число связанных молекул в случае ЦТАХ выше аналогичных параметров для ЦТАБ и ОДМАХ при меньшем значении рН.
Рассмотрим влияние концентрации БСА на флуоресцентные характеристики его смесей с ЦТАБ. На рисунке 5 приведены зависимости относительной интенсивности флуоресценции от концентрации ЦТАБ при различных концентрациях БСА. Видно, что с увеличением концентрации белка необходима более высокая концентрация ПАВ, чтобы достичь одинакового уменьшения интенсивности флуоресценции (одинакового значения I / 1 0 ).
Полученные данные позволяют провести количественную оценку процесса связывания поверхностно-активного вещества белком способом, предложенным в работе [22]. Процесс связывания описывается суммарным упрощенным равновесием ( S - ПАВ, БСА - белок) S + БСА о- EGAS. Константа равновесия (эффективная константа связывания) равна (5):
K b = [ EGAS ]/{[ S ][ БСА ]} . (5)
При низких концентрациях ПАВ (до насыщения белка) равновесная концентрация комплекса в уравнении (5) равна концентрации связанного ПАВ ([EGAS]=[S]связ.), а равновесная концентра- ция белка равна концентрации белка в растворе. С учетом того, что [S]связ./[БСА] равно числу молекул, связанных одной молекулой БСА, последнее уравнение преобразуется в (6):
K b = V /[ S ] своб. , (6)
где V - число молекул ПАВ, связанных одной молекулой белка, [ S ] своб . - концентрация ПАВ, несвязанного белком.
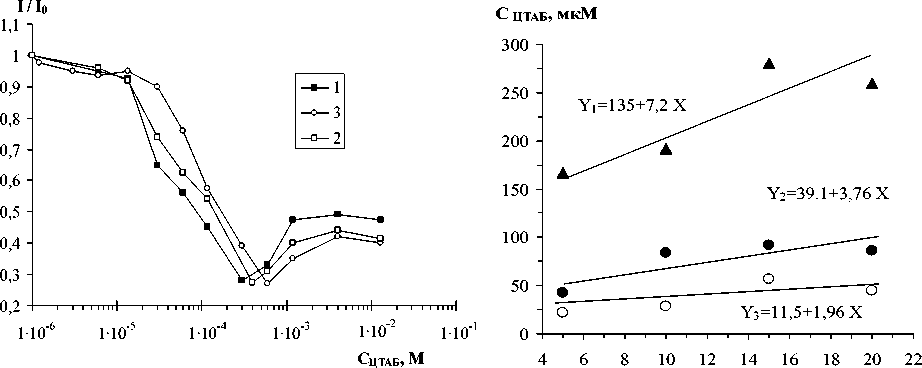
C БСА , мкМ
Рис. 5. Относительная интенсивность флуоресценции БСА Рис. 6. Концентрации ЦТАБ, в зависимости от концентрации ЦТАБ при концентрациях необходимые для достижения данного
БСА С БСА - 105, М: 0,5(1), 1,0(2), 1,5(3), рН =5,8, Т=293К значения относительной интенсивности
I/I 0 флуоресценции БСА, в зависимости от концентрации БСА в растворе, для I/I 0 : 0,77(1), 0,60(2), 0,40(3), рН= 5,8, Т=293К
Влияние концентрации БСА на изменение флуоресценции с ростом концентрации ЦТАБ (см. рис. 5) обусловлено равновесным распределением молекул ПАВ между комплексом белок-ПАВ и водной средой, что совпадает с литературными данными [22]. Очевидно следующее соотношение (7):
[ S = [ S своб. + V .[ БСА ]. (7)
На рисунке 6 в координатах уравнения (7) представлены зависимости концентрации ЦТАБ от концентрации БСА в смеси при постоянных значениях I/I 0 . Среднее число молекул ПАВ, связанных одной молекулой БСА, рассчитывается по тангенсу угла наклона прямой к оси абсцисс, а концентрация ЦТАБ, несвязанного белком, определяется по точке пересечения прямой с осью ординат. Рассчитанные параметры связывания приведены в таблице 2.
Необходимо подчеркнуть, что образование комплексов белок-ионное ПАВ переменного состава является сложным процессом, сопровождающимся постепенным присоединением молекул ПАВ до насыщения белка и конформационными изменениями макромолекул [5, 10, 20], и вообще говоря, этот процесс не может быть охарактеризован одной константой. Поэтому рассчитанные величины эффективной константы связывания ЦТАБ альбумином (см. табл. 2) позволяют обсуждать лишь оценочные характеристики взаимодействия белка с ПАВ.
Как видно из таблицы 2, константа K b не возрастает с увеличением числа связанных молекул ЦТАБ, что свидетельствует о низкой кооперативности процесса. Этот вывод совпадает с данными таблицы 1, индекс кооперативности для системы ЦТАБ-БСА равен п н =1.57 ± 0.01. Незначительное уменьшение K b при увеличении V может быть обусловлено или конформационными изменениями белка и/или увеличением электростатического отталкивания между заряженными группами ЦТАБ при увеличении числа связанных молекул в условиях низкой кооперативности (при низкой концентрации ПАВ, недостаточной для формирования мицеллоподобных агрегатов на по-липептидной цепи белка).
Таблица 2
Параметры связывания ЦТБА белком при различных значениях относительной интенсивности флуоресценции БСА, рН 5,8, Т=293К
|
I/I 0 |
[ S ] своб ⋅ 106, М |
ν , моль ЦТАБ/моль БСА |
K b ⋅ 10-5, М-1 |
|
0,77 |
12 |
2,0 |
1,7 ± 0,7 |
|
0,60 |
39 |
3,8 |
1,5 ± 0,5 |
|
0,55 |
38 |
4,4 |
1,1 ± 0,6 |
|
0,40 |
135 |
7,2 |
0,53 ± 0,04 |
Выводы
Флуоресценция БСА тушится катионными ПАВ ЦТАБ и ОДМАХ в водном растворе. Константа тушения, представляющая собой константу равновесия связывания молекул ПАВ белком и рассчитанная по уравнению Штерна–Фольмера, равна (4,7 ± 0,2) ⋅ 103 и (4,3 ± 0,4) ⋅ 103 М-1 для ЦТАБ и ОДМАХ соответственно. Тушение происходит преимущественно по статическому механизму [24]. Тушение флуоресценции БСА обусловлено взаимодействием макромолекул белка с молекулами ПАВ, сопровождающимся образованием комплексов БСА – катионное ПАВ. При низких концентрациях ПАВ комплексообразование характеризуется низкой кооперативностью 1 < n н < 2, общее число связанных молекул ПАВ примерно равно числу анионных групп в молекуле БСА. В процессе последовательного увеличения числа молекул ПАВ в комплексе эффективная константа связывания несколько уменьшается. Существенный вклад, наряду с электростатическими взаимодействиями, вносят гидрофобные взаимодействия между молекулами катионного ПАВ и БСА. Длина волны максимума флуоресценции комплекса БСА – катионное ПАВ сдвинута на 4-8 нм в коротковолновую область по сравнению со спектром флуоресценции БСА.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант РФФИ № 10-03-00310-а.


