Значение факторов риска заражения вирусными гепатитами В и С у детей с онкогематологическими заболеваниями и иммунодефицитными состояниями
Автор: Сацук А.В., Солопова Г.Г., Плоскирева А.А., Акимкин В.Г., Новичкова Г.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в эпидемиологии
Статья в выпуске: 1 (45), 2024 года.
Бесплатный доступ
Пациенты онкогематологического профиля являются группой высокого риска заражения нозокомиальными гемоконтактными инфекциями (гепатит В, С и ВИЧ) по причине их иммуносупрессивного состояния и массивного инвазивного воздействия. В связи с этим определены ведущие факторы риска заражения гемоконтактными инфекциями пациентов онкогематологического профиля и выявлены причины неравномерности пораженности гепатитом В и С основных клинических групп пациентов. Период исследования - с 2021 по 2023 г. Выборка анализируемой группы составила 500 пациентов, по 100 пациентов из каждой клинической группы: пациенты с первичными иммунодефицитами (ПИД), болезнями крови и кроветворных органов, гемобластозами, солидными злокачественными образованиями, доброкачественными новообразованиями. Инвазивная нагрузка на одного пациента с гемобластозами, злокачественными новообразованиями, болезнями крови, доброкачественными новообразованиями и первичными иммунодефицитами составила соответственно (медианы): 10,9, 6,2, 5,1, 4,1, 2,2 инвазивных вмешательств в день. Инфузионная / инъекционная нагрузка составила соответственно (медианы): 8,3, 4,0, 2,7, 2,7, 0,6 лекарственных препаратов в день. Инвазивная нагрузка при взятии крови на анализ (медианы): 2,0, 1,7, 1,7, 1,3, 1,6 проб крови в день. Трансфузионная нагрузка (медианы): 0,14, 0,07, 0,25, 0,0 переливаемых компонентов крови в день. Хирургическая нагрузка (медианы): 0, 0,15, 0, 0,17, 0,0 оперативных вмешательств в день соответственно. Медианы для остальных манипуляций во всех клинических группах составили 0. Пациенты с ПИД, являющиеся самой высокопораженной клинической группой пациентов в отношении гепатита В (2,5 %) и гепатита С (2,3 %), имели самый низкий уровень инвазивной нагрузки. Следует предположить, что ведущим фактором риска заражения вирусными гепатитами В и С пациентов онкогематологического профиля является уровень иммунокомпетентности пациентов в сочетании с воздействием инвазивных факторов риска, таких как: гемотрансфузии, использование венозного катетера (внутривенное введение лекарственных препаратов, взятие крови на анализ), выполнение обширных хирургических вмешательств.
Факторы риска, гемоконтактные инфекции, пораженность вгв, пораженность вгс, серопревалентность вгв, серопревалентность вгс, дети онкогематологического профиля, трасфузионный гепатит, факторы внутрибольничного заражения вгв, вгс
Короткий адрес: https://sciup.org/142240729
IDR: 142240729 | УДК: 616-002 | DOI: 10.21668/health.risk/2024.1.10
Текст научной статьи Значение факторов риска заражения вирусными гепатитами В и С у детей с онкогематологическими заболеваниями и иммунодефицитными состояниями
Новичкова Галина Анатольевна – доктор медицинских наук, профессор, генеральный директор (e-mail: ; тел.: 8 (985) 923-51-78; ORCID: .
связанного с основным заболеванием и специфической терапией [1–8]. Наиболее обсуждаемые факторы передачи гемоконтактных инфекций среди пациентов онкогематологического профиля – это гемотрансфузии, небезопасные инъекции и инфузии, хирургические вмешательства и другие инвазивные диагностические и лечебные манипуляции [9–19].
При оценке инфицированности гепатитом С (ВГС) пациентов онкогематологического профиля, поступающих на лечение в ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России (далее – Центр) из разных регионов страны, выявлена высокая их пораженность, которая в период с 2014 по 2020 г. составила 1,7 %, что превысило среднероссийский показатель среди детей в 50 раз. При оценке уровня пораженности среди нозологических групп онкоге-матологических пациентов выявлена высокая пораженность пациентов с первичными иммунодефицитами (ПИД) – 2,8 %, болезнями крови (БК) – 2,2 %, солидными злокачественными новообразованиями – 1,9 %, гемобластозами (ГБ) – 1,6 % [20].
Цель исследования – определить вероятные причины неравномерности пораженности гепатитами В и С пациентов онкогематологического профиля, а именно высокого уровня пораженности пациентов с первичным иммунодефицитом, и других исследованных клинических групп пациентов. Задачи исследования: провести оценку инвазивной нагрузки и сопоставить с показателями пораженности основных клинических групп пациентов, выдвинуть теории о вероятных причинах и факторах заражения.
Материалы и методы. В ходе исследования оценивалась инвазивная нагрузка, которой подвергались пациенты, проходившие лечение в Центре в период с 2021 по 2023 г. Выборка анализируемой группы составила 500 пациентов: по 100 пациентов из каждой клинической группы (ПИД, БК, ГБ, солидные злокачественные образования (СЗО), доброкачественные новообразования (ДНО)). Для оценки инвазивной нагрузки пациентов была проведена оценка инфузионной нагрузки (количество введенных лекарственных препаратов), частоты диагностического взятия проб крови (количество забираемых пробирок с кровью), гемотрансфузионной нагрузки (количество доз крови и ее компонентов), хирургической нагрузки (количество операций), частоты проведения костномозговых и люмбальных пункций, диагностических эндоскопических исследований с подсчетом числа инвазивных вмешательств на одного пациента в день.
С целью сопоставления полученных результатов оценки инвазивной нагрузки с уровнем пораженности вирусом гепатита В (ВГВ) и вирусом гепатита С (ВГС) пациентов Центра были использованы данные ретроспективного анализа пораженности пациентов, проходивших лечение в Центре в период с 2014 по 2022 г. (13 500 человек). Анализ включал результаты лабораторных исследований на маркеры: HBsAg, анти-НCV, РНК ВГС, ДНК ВГВ в момент госпитализации пациентов в Центр. Все пациенты когорты инфицированных пациентов были заражены до госпитализации в Центр. Случаев заражения ВГВ и ВГС в Центре в анализируемый период зарегистрировано не было.
К особенностям анализируемой выборки относились: предшествующая госпитализации пациентов по месту жительства, потребность в проведении сложных и высокотехнологичных этапов диагностики и лечения в Центре, не доступных в других регионах страны, тяжелое состояние пациентов на момент поступления в Центр.
Статистическую обработку полученных данных проводили с использованием пакетов компьютерных программ Microsoft Exсel. Для расчета достоверности различий качественных показателей использовали таблицы сопряженности с расчетом показателей χ2 (доверительные интервалы (ДИ) – 95 %). Статистическое сравнение медиан проводилось с использованием теста Манна – Уитни.
Результаты и их обсуждение. Выявлено, что наибольшему инвазивному воздействию были подвержены пациенты с ГБ, медиана ежедневной инвазивной нагрузки пациентов с ГБ в 2 раза больше, по сравнению с соответствующими данными всех пациентов Центра (10,9 против 5,4 соответственно, р < 0,001). Медиана инвазивной нагрузки пациентов с ПИД являлась самой низкой и составила 2,2 инвазивных вмешательства в день на одного пациента, что в 5 раз меньше, чем у пациентов с ГБ ( р < 0,001), и в 2,5 раза меньше, чем средняя инвазивная нагрузка в Центре на одного пациента в день ( р < 0,001) (табл. 1, рис. 1).
Таблица 1
Среднее количество (медианы) инвазивных вмешательств на одного пациента в день (2022 г.)
|
Клинич. диагноз |
Инвазивные манипуляции |
Общая нагрузка |
|||||
|
инъекции, инфузии (препараты) |
взятие крови на анализ (пробирки) |
гемотрансфузии (дозы) |
хирургические вмешательства |
пункции люмбальные / костномозговые |
эндоскопия диагностическая |
||
|
ГБ |
8,3 |
2,0 |
0,1 |
0 |
0 |
0 |
10,9 |
|
СЗО |
4,0 |
1,7 |
0,1 |
0,15 |
0 |
0 |
6,2 |
|
БК |
2,7 |
1,7 |
0,3 |
0 |
0 |
0 |
5,1 |
|
ДНО |
2,7 |
1,3 |
0 |
0,17 |
0 |
0 |
4,1 |
|
ПИД |
0,6 |
1,6 |
0 |
0 |
0 |
0 |
2,2 |
|
Все клинич. группы |
3,3 |
1,6 |
0 |
0 |
0 |
0 |
5,4 |
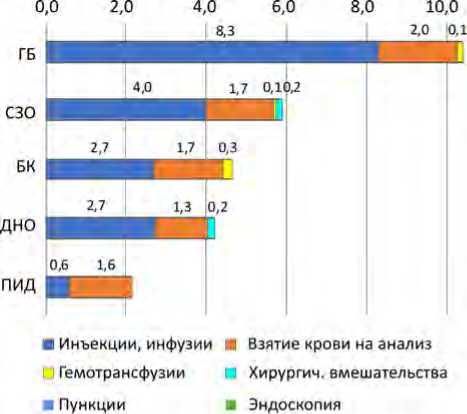
Рис. 1. Среднее количество (медианы) инвазивных вмешательств на одного пациента в день в зависимости от вида манипуляции и клинической группы пациентов
Проведена подробная оценка каждого вида инвазивного вмешательства у всех клинических групп пациентов. Парентеральное введение лекарственных препаратов являлось наиболее частой инвазивной манипуляцией у пациентов с онкогема-тологической патологией. Оценка инъекционной и инфузионной нагрузки включала подсчет количества лекарственных препаратов при следующих способах парентерального введения: внутривенная (в/в) короткая инфузия (струйное или капельное введение), в/в длительная (суточная) инфузия, подкожное (п/к), внутримышечное (в/м), интратекаль-ное (и/т), интравентрикулярное (и/в) введение препаратов.
Медиана количества препаратов у всех пациентов Центра составила 3,3 лекарственных препарата в день на одного пациента, при этом у пациентов с гемобластозами – 8,3, у пациентов с солидными злокачественными образованиями – 4,0, с болезнями крови и доброкачественными новообразованиями – по 2,7, первичными иммунодефицитами – 0,6. Наибольшее количество инъекций и инфузий в ходе лечения получали пациенты с ГБ, что в 2,5 раза больше, чем у всех пациентов Центра, и достоверно больше, чем у пациентов других клинических групп ( р < 0,05). Пациенты с ПИД получали наименьшее количество парентеральных препаратов, что в 14 раз меньше, по сравнению с пациентами, у которых диагностирован ГБ ( р = 0,00028), и в 6 раз меньше, чем у всех пациентов Центра (см. табл. 1, рис. 1).
В Центре основным венозным доступом введения лекарственных препаратов являлся центральный венозный катетер (ЦВК) для назначения коротких и длительных инфузий препаратов.
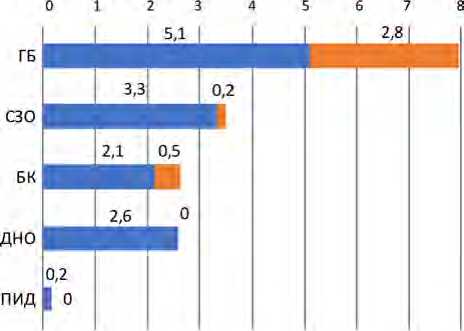
Пациенты с гемобластозами путем коротких инфузий получали по 5,1 лекарственного препарата в день, пациенты с СЗО – 3,3, ДНО – 2,6, БК – 2,2,
ПИД – 0,2. Пациентам с ГБ путем коротких инфузий вводилось самое большое число лекарственных препаратов, что превысило среднее количество препаратов, вводимых данным способом в Центре (2,6), в 2 раза. Пациенты с ПИД внутривенно путем коротких инфузий получали наименьшее количество лекарственных препаратов, что в 16 раз меньше, чем среднее число препаратов, вводимых данным способом в Центре, и в 31 раз меньше, чем пациентам с ГБ ( р = 0,00028). Путем внутривенного длительного введения препаратов пациентам с ГБ вводилось по 2,8 препарата в день, пациентам с БК – по 0,5, СЗО – 0,2, ДНО – 0, ПИД – 0 (рис. 2). Наибольшее количество препаратов, вводимых путем длительных инфузий, отмечалось у пациентов с ГБ.
• в/в инфузия короткая • в/в инфузия длительная ■ и/т и/в ■ п/к ■ в/м
Рис. 2. Среднее количество (медианы) вводимых лекарственных препаратов на одного пациента в день в зависимости от клинической формы заболевания и способа введения
Медианы количества препаратов, вводимых подкожно, интратекально, внутримышечно, интра-вентрикулярно, – 0 (рис. 2). Интратекальное и интравентрикулярное введение препаратов, как правило, проводилось у пациентов с ГБ.
Наибольшей инвазивной нагрузке при парентеральном введении лекарственных препаратов были подвержены пациенты с ГБ, как в отношении количества вводимых препаратов, так и способа их введения. При этом пациенты с ПИД имели наименьшую инъекционную и инфузионную нагрузки.
Взятие крови на анализ являлось второй по частоте выполнения инвазивной манипуляцией после парентерального введения лекарственных препаратов. С целью снижения инвазивной и психологической нагрузки взятие крови у пациентов Центра проводилось из ЦВК с использованием данного доступа в 89–99 % случаев.
При оценке инвазивной нагрузки при взятии крови выявлено, что диагностическое исследование образцов крови в большей степени проводилось пациентам с ГБ – медиана составила 2 образца крови
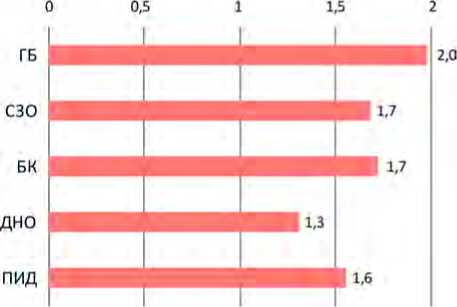
Рис. 3. Среднее количество (медианы) проб крови, забираемой на анализ, на одного пациента в день в зависимости от клинической формы заболевания
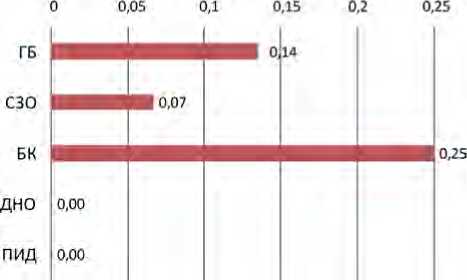
Рис. 4. Среднее количество (медианы) гемотрансфузий (доз крови и ее компонентов) на одного пациента в день в зависимости от клинической группы пациентов в день на одного пациента, пациентам с ПИД – в 1,3 раза меньше (1,6 против 2 соответственно, р = 0,017) (табл. 1, рис. 3). Все клинические группы пациентов были подвержены высокой инвазивной нагрузке, но в большей степени – пациенты с ГБ.
При оценке трансфузионной нагрузки, а именно медиан количества переливаемых компонентов крови, было выявлено, что наибольшее количество гемотрансфузий получали пациенты с БК и ГБ – по 0,25 и 0,14 дозы крови или ее компонентов на одного пациента в день соответственно. Пациенты с СЗО – по 0,07, ПИД и ДНО – 0. Пациенты с БК получали в 1,8 раза больше гемотрансфузий, чем пациенты с ГБ (p > 0,05), и в 3,8 раза больше, чем пациенты с СЗО (р < 0,001) (табл. 1, рис. 4).
В связи с тем, что к наиболее эпидемически опасным относятся некарантинизируемые компоненты донорской крови с коротким сроком хранения (концентрат тромбоцитов, эритроцитсодержащие компоненты, гранулоцитный концентрат), было проведено исследование по количеству их трансфузий в сравнении с карантинизируемыми компонентами у пациентов разных клинических групп. Медианы количества вводимых эритроцитсодержащих компонентов у пациентов с ГБ, СЗО и БК были равны и составили по 0,06 дозы. Медианы количества вводимых концентратов тромбоцитов у пациентов с ГБ и БК составили 0,03 и 0,06 дозы на одного пациента в день ( р = 0,89656) соответственно. Медианы остальных компонентов у пациентов с ГБ, СЗО и БК, а также медианы количества доз у остальных групп (ДНО и ПИД) – 0 (табл. 2, рис. 5). В отношении переливания эпидемически небезопасных компонентов крови
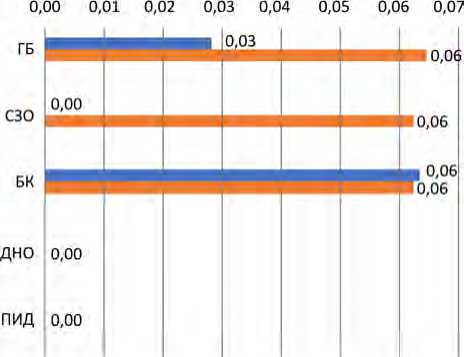
■ Концентрат тромбоцитов * Эритроцит-содержащие Гранулоцитный концентрат Плазменные комп.
Рис. 5. Среднее количество (медианы) доз крови и ее компонентов, перелитых одному пациенту в день, в зависимости от клинической группы пациентов и видов компонентов крови
Таблица 2
Среднее количество (медианы) доз крови и ее компонентов, перелитых одному пациенту в день, в зависимости от клинической группы пациентов и видов компонентов крови
|
Клинич. диагноз |
Вид компонента крови |
Все компоненты крови |
|||
|
концентрат тромбоцитов |
эритроцит-содержащие |
гранулоцитный концентрат |
плазменные компоненты |
||
|
ГБ |
0,03 |
0,06 |
0 |
0 |
0,14 |
|
СЗО |
0 |
0,06 |
0 |
0 |
0,07 |
|
БК |
0,06 |
0,06 |
0 |
0 |
0,25 |
|
ДНО |
0 |
0 |
0 |
0 |
0 |
|
ПИД |
0 |
0 |
0 |
0 |
0 |
|
Все пациенты |
0 |
0 |
0 |
0 |
0 |
Таблица 3
Среднее количество (медианы) оперативных вмешательств на одного пациента в день в зависимости от клинического диагноза и категории сложности оперативного вмешательства
Таким образом, наибольшая трасфузионная нагрузка была у пациентов с БК и ГБ в связи с массивной заместительной терапией компонентами крови, небезопасными в отношении передачи гемоконтактных инфекций.
При оценке хирургической нагрузки выявлено, что медиана хирургических вмешательств у пациентов с СЗО составила 0,15, у пациентов с ДНО – 0,17 оперативных вмешательств в день на одного пациента ( р = 0,5485). В остальных клинических группах пациентов медианы количества проводимых операций равны 0. Медиана количества операций среди всех пациентов Центра также составила 0 (табл. 3).
Учитывая тот факт, что более массивные операции сопряжены с большим риском заражения гемоконтактными инфекциями, была проведена оценка медиан количества операций по степени их тяжести согласно классификации оперативных вмешательств, используемой в Центре:
-
• I категория. Операции малой степени риска – операции на поверхности тела без вовлечения внутренних структур.
-
• II категория. Операции умеренной степени риска – операции на поверхности тела с несколькими разрезами, полостные операции без заинтересованности внутренних органов, лапароскопии, операции в полости рта, реконструктивные операции на конечностях.
-
• III категория. Операции средней степени риска – операции на внутренних органах и кишечнике, открытые операции на суставах, лапароскопии с вовлечением паренхиматозных органов, торакоскопии, микрохирургия.
-
• IV категория. Операции большой степени риска – обширные хирургические вмешательства, затрагивающие несколько органов и систем, операции на ЦНС.
-
• V категория. Операции чрезвычайной степени риска – хирургические вмешательства на жиз-
- ненно важных органах и системах у больных с тяжелыми нарушениями витальных функций.
При анализе количества выполненных операций по уровню их сложности выявлено, что только у пациентов с СЗО медиана операций V категории сложности имеет значение и составила 0,08 операции в день на одного пациента, у остальных клинических групп пациентов медианы количества операций разных категорий сложности равны 0 (см. табл. 3).
Поскольку медианы равны 0, для оценки уровня оперативной нагрузки среди пациентов разных клинических групп было проанализировано соотношение количества проведенных операций разных категорий сложности (рис. 6). Установлено, что все пациенты в той или иной степени испытывали хирургическую нагрузку, однако значимую хирургическую нагрузку испытывали только пациенты с СЗО и ДНО, в том числе согласно значениям медиан. В связи с проведением обширных операций V категории хирургическая нагрузка у пациентов с СЗО выше, чем у пациентов с ДНО. Удельный вес операций V категории сложности, проводимых пациентам с СЗО, составил 50 %, при этом пациенты с ПИД испытывали самую низкую хирургическую инвазивную нагрузку (см. рис. 6).
Медианы количества люмбальных и костномозговых пункций – 0 у всех клинических групп пациентов. Поскольку медиана равна 0, было проведено сравнение соотношения количества пункций у разных клинических групп. При оценке соотношения количества выявлено, что самое большое воздействие испытывали пациенты с ГБ – более 0,1 пункции в день проводилось у 18 % (рис. 7).
Медианы количества эндоскопических диагностических исследований составили 0 у всех клинических групп пациентов. При оценке соотношения количества проведенных эндоскопических исследований выявлено, что самое большое воздействие испытывали пациенты с ПИД – более 0,1 эндоскопического исследования в день было проведено у 24 % (рис. 8).
Таким образом, наибольшей инвазивной нагрузке при проведении эндоскопических диагностических исследований подвержены пациенты с ПИД, остальные клинические группы пациентов испытывали минимальную инвазивную нагрузку.
О 10 20 30 40 50 60 70 80 90 100% 0 10 20 30 40 50 60 70 80 90 100%
|
1 кат. |
__ 98 ___________________________21 1кат. _____________________________ 97 _____________________________| |
|
II кат. |
____________________________ш_____________________________11 кат 95 4 1 |
|
Ill кат. |
93 4 3 III кат. 77 7 16 |
|
IV кат. |
100 J IV кат.____99_____1 |
|
V кат. |
100 V кат. 100 СО DSO.1 и >0.1 ио OS0.1 И>0.1 а б |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100% |
0 |
10 |
20 30 40 50 60 70 80 90 |
100% |
|
|
1 кат. |
88 |
■ |
11 1 |
1 кат. |
94 |
si |
|||||||||
|
II кат. |
61 |
8 |
31 |
■ |
II кат. |
77 17 |
6 |
||||||||
|
Ill кат. |
67 |
9 |
24 |
Ill кат. |
60 33 |
?J |
|||||||||
|
IV кат. |
83 |
6 |
11 |
IV кат. |
74 | 23 |
3 |
|||||||||
|
Vkot |
100 |
V кат. |
19 |
58 23 |
м |
||||||||||
|
0 <0.1 ■ |
>0.1 |
□ 0 СКОЛ • >0.1 |
|||||||||||||
|
в |
г |
||||||||||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100% |
|||||
|
1 кат. |
100 |
о |
|||||||||||||
|
II кат. |
97 |
а |
Рис. |
6. Соотношение количества оперативных |
|||||||||||
|
Ill кат. |
99 |
в |
|||||||||||||
|
В |
зависимости от категории сложности оперативного |
||||||||||||||
|
IV кат. |
100 |
_» |
вмешательств ц—iv у и клинический группы пациентов: а - ГБ; б - БК; в - Д1Ю; г - СЗО; д - ПИД |
||||||||||||
|
V кат. |
100 |
0 |
|||||||||||||
О 5 0.1 ■ >0.1
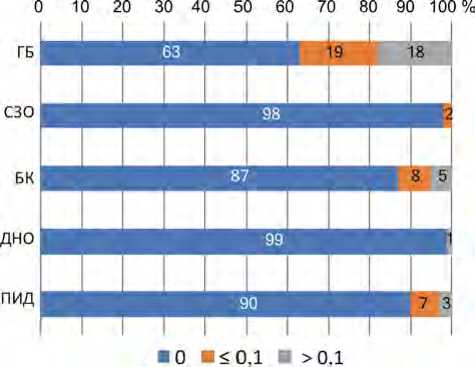
Рис. 7. Соотношение количества пункций (люмбальных и костномозговых) на одного пациента в день в зависимости от клинического диагноза пациента
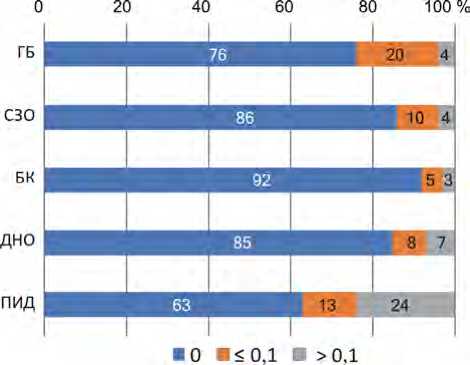
Рис. 8. Соотношение количества эндоскопических исследований на одного пациента в день в зависимости от клинического диагноза пациента
При анализе пораженности ВГВ и ВГС основных клинических групп пациентов наиболее инфицированной являлась группа пациентов с ПИД (ВГВ – 2,5 %, ВГС – 2,3 %). Пораженность ВГВ и ВГС пациентов с ПИД была достоверно выше, чем у пациентов с ГБ, БК и СЗО ( р < 0,05). Пациенты с ГБ, БК и СЗО не имели достоверных различий в пораженности ВГС (1,3; 1,3; 1,2 % соответственно, р > 0,05). Пораженность ВГВ у пациентов с ГБ и БК не имела достоверных различий (0,9; 0,8 % соответственно, р > 0,05), но была выше, чем у пациентов с СЗО (0,2 %) ( р < 0,05) (рис. 9).
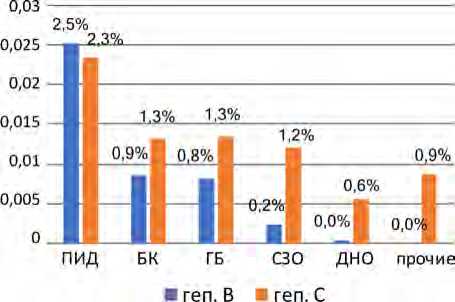
Рис. 9. Инфицированность ВГВ и ВГС пациентов Центра в основных клинических онкогематологических группах (2014–2022 гг.)
Проведенный анализ демонстрирует значение видов инвазивного воздействия на пациентов с он-когематологическими заболеваниями и иммунодефицитными состояниями в зависимости от клинической группы согласно особенностям организации работы Центра. Несмотря на возможные отличия в других клиниках, полученные данные могут быть приняты во внимание при расследовании случаев заражения гемоконтактными инфекциями и в организации комплекса профилактических и противоэпидемических мероприятий среди иммунокомпро-метированных пациентов.
В анализе было продемонстрировано, что наибольшую инвазивную нагрузку среди основных клинических групп с онкогематологическими заболеваниями и иммунодефицитными состояниями испытывали пациенты с ГБ, которые подвергались 10,9 инвазивного вмешательства ежедневно, тогда как у пациентов с ПИД отмечалась самая низкая нагрузка – 2,2 вмешательства в день, что в 5 раз меньше, чем у пациентов с ГБ, и в 2,5 раза меньше средней инвазивной нагрузки в Центре (5,4 вмешательства на одного пациента в день).
При оценке отдельных видов инвазивных вмешательств было установлено, что пациенты с ГБ имели самую высокую инфузионную / инъекционную нагрузку по количеству вводимых лекарственных препаратов. Способы введения лекарственных препаратов имеют разную степень инвазивности и, следовательно, риска передачи гемоконтактных инфекций. Наибольший риск инфицирования отмечается при внутривенном введении лекарств посредством катетера методом коротких инфузий, поскольку сопряжен с множественными манипуляциями как с катетером, так и с дополнительными инфузионными доступами. Так, у пациентов с ГБ самое большое число препаратов вводилось короткими внутривенными инфузиями.
Другим видом инвазивных манипуляций, имеющих многофакторные риски передачи гемоконтактных инфекций, является взятие крови. Все клинические группы пациентов были подвержены высокой инвазивной нагрузке при взятии крови на анализ, но в большей степени – пациенты с ГБ.
Пациенты с БК и ГБ имели самую высокую гемотрансфузионную нагрузку как по количеству переливаемых доз компонентов крови, так и по их эпидемической безопасности – количеству некаран-тинизируемых концентрата тромбоцитов и эритро-цитсодержащих компонентов.
Наиболее высокая хирургическая нагрузка была отмечена у пациентов с СЗО и ДНО, кроме того, пациентам с СЗО больше проводилось обширных операций, чем пациентам других клинических групп. Доля пациентов с СЗО, которым проводились операции V категории сложности, составила 50 %.
Пациентам с ГБ осуществлялось самое большое количество люмбальных и костномозговых пункций.
Минимальная инфузионная / инъекционная нагрузка отмечалась у пациентов с ПИД и была в 14 раз меньше, чем у пациентов с ГБ, и в 6 раз меньше, чем у всех пациентов Центра. У пациентов с ПИД ежедневно забирали в 1,3 раза меньше проб крови на анализ, чем у пациентов с ГБ. Медианы количества гемотрансфузий, хирургических вмешательств, пункций и эндоскопических исследований у пациентов с ПИД – 0. При анализе соотношения количества оперативных вмешательств и люмбальных / костномозговых пункций можно отметить, что пациенты с ПИД были подвержены минимальному инвазивному воздействию, тогда как при проведении эндоскопических обследований у них отмечалась самая высокая инвазивная нагрузка среди всех клинических групп.
Проведенный ретроспективный анализ пораженности продемонстрировал высокий уровень ин-фицированности гемоконтактными инфекциями пациентов с онкогематологической патологией и иммунодефицитными состояниями, поступивших в Центр из разных регионов страны. Показатели пораженности пациентов Центра ВГВ и ВГС являлись высокими, наиболее пораженной являлась группа с ПИД.
При сопоставлении полученных результатов оценки инвазивной нагрузки с уровнем пораженности ВГВ и ВГС пациентов Центра было выявлено, что лица с ПИД, подверженные минимальной инвазивной нагрузке, имели самые высокие показатели пораженности ВГВ и ВГС. Можно предположить, что для инфицирования пациентов с ПИД в связи с иммунодефицитным состоянием требуется более низкая доза инфекционного агента. Кроме того, анализ медицинской документации выявил более затянутый период постановки диагноза на первичных этапах оказания медицинской помощи для пациентов с ПИД, в сравнении с ГБ и СЗО: пациенты с ПИД длительно подвергаются инвазивному воздействию в ходе лечения до установления диагноза в клиниках, не специализирующихся на иммуноком-прометированных пациентах.
В исследованиях, проведенных ранее, ведущими факторами риска заражения гемоконтактными инфекциями пациентов онкогематологического профиля были определены гемотрансфузии и медицинские манипуляции1. Из полученных данных нашего исследования следует предположение, что ведущим фактором риска заражения ВГВ и ВГС пациентов онкогематологического профиля является уровень иммунокомпетентности пациентов в сочетании с воздействием инвазивных факторов риска.
Следующей категорией по уровню пораженности ВГС явились пациенты с ГБ, БК, СЗО – наиболее вероятно, вследствие высокой инвазивной нагрузки при введении лекарственных препаратов и взятии крови на анализ. На фоне индуцированной иммуносупрессии фактором риска могла быть недостаточная инфекционная безопасность при приготовлении инфузий, взятии крови и работе с венозными катетерами, являющимися основным венозным доступом для введения лекарственных препаратов у данной категории пациентов. Лица с ГБ имели дополнительный инфекционный риск – большое число люмбальных и костномозговых пункций, тогда как пациенты с СЗО – большое число обширных оперативных вмешательств. У пациентов с ДНО, несмотря на отсутствие иммуносупрессивной и / или химиотерапии, уровень пораженности ВГС составил 0,6 %, что превышало пораженность общей популяции детского населе- ния. К ведущим факторам риска данной категории пациентов были отнесены высокие показатели хирургической и инфузионной нагрузки, что подчеркивает небезопасность манипуляций, проводимых в медицинских учреждениях на всех уровнях оказания медицинской помощи. Высокая пораженность ВГВ пациентов с БК и ГБ, получавших массивную гемозаместительную терапию, свидетельствует об остаточном риске заражения трансфузионным ВГВ, имеющим свойства «ускользать» от возможностей диагностических тест-систем в связи с наличием мутантных форм вируса. У пациентов с БК, несмотря на отсутствие индуцированной иммуносупрессии, пораженность ВГС находилась на одном уровне с таковой у лиц с ГБ и СЗО, а пораженность ВГВ – на уровне пациентов с ГБ и выше, чем у пациентов с СЗО. Ведущими факторами риска у пациентов с БК были высокая трансфузионная нагрузка небезопасными компонентами крови, а также инфузионная / инъекционная нагрузки и взятие крови на анализ. Пораженность ВГВ и ВГС группы пациентов с БК ярко демонстрирует значение гемотрансфузий в передаче ВГВ, а также подчеркивает небезопасность медицинских манипуляций.
Выводы. Проведение инвазивных манипуляций и гемотрансфузий некарантинизируемых компонентов крови на фоне иммуносупрессии является фактором, определяющим пациентов с онкогемато-логическими заболеваниями и иммунодефицитными состояниями в группу высокого риска по заражению гемоконтактными инфекциями. Особое значение имеют такие инвазивные манипуляции, как внутривенное введение лекарственных препаратов, взятие крови на анализ, выполнение обширных хирургических вмешательств.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Значение факторов риска заражения вирусными гепатитами В и С у детей с онкогематологическими заболеваниями и иммунодефицитными состояниями
- Styczynski J., Kruszewska N., Wysocki M. Przeglad systematyczny i meta-analiza epidemiologii, profilaktyki i terapii zakazen wirusami zapalenina watroby typu B i C w Polskich osrodkach onkologii dzieciecej [Systematic review and meta-analysis of epidemiology, prophylaxis and therapy of infections with viral hepatitis B and C in Polish paediatric oncology centres]. Med. Wieku Rozwoj., 2008, vol. 12, no. 4, pt 2, pp. 1056-1061 (in Polish).
- Styczynski J., Wysocki M., Koltan S., Kuiylak A. Epidemiologic aspects and preventive strategy of hepatitis B and C viral infections in children with cancer. Pediatr. Infect. Dis. J., 2001, vol. 20, no. 11, pp. 1042-1049. DOI: 10.1097/00006454-200111000-00008
- Koltan S., Styczynski J., Wysocki M., Koltan A., Kurylak A., Debski R. Decrease of dual hepatitis B and C virus infections in children with cancer: changes in risk factors over 30 years. Haematologica, 2004, vol. 89, no. 2, pp. 251-252.
- Brasseur M., Heurgué-Berlot A., Barbe C., Brami C., Rey J.-B., Vella-Boucaud J., Dabouz F., Deslée G. [et al.]. Prevalence of hepatitis B and C and sensibility of a selective screening questionnaire in patients receiving chemotherapy for solid tumors. BMC Cancer, 2015, vol. 15, pp. 999. DOI: 10.1186/s12885-015-2033-z
- Stikleryte A., Griskeviciene J., Magnius L.O., Zagminas K., Norder H., Ambrozaitis A. Characterization of HCV strains in an oncohematological pediatric department reveals little horizontal transmission but multiple introductions by unscreened blood products in the past. J. Med. Virol., 2006, vol. 78, no. 11, pp. 1411-1422. DOI: 10.1002/jmv.20713
- Locasciulli A., Testa M., Pontisso P., Benvegnù L., Fraschini D., Corbetta A., Noventa F., Masera G., Alberti A. Prevalence and natural history of hepatitis C infection in patients cured of childhood leukemia. Blood, 1997, vol. 90, no. 11, pp. 4628-4633.
- Silini E., Locasciulli A., Santoleri L., Gargantini L., Pinzello G., Montillo M., Foti L., Lisa A. [et al.]. Hepatitis C virus infection in a hematology ward: evidence for nosocomial transmission and impact on hematologic disease outcome. Haema-tologica, 2002, vol. 87, no. 11, pp. 1200-1208.
- Malaguarnera M., Gargante M.P., Risino C., Ranno S., Berretta M., Cannizzaro M.A., Costanzo M., Fricia T. [et al.]. Hepatitis C virus in elderly cancer patients. Eur. J. Intern. Med., 2006, vol. 17, no. 5, pp. 325-329. DOI: 10.1016/j.ejim.2006.02.004
- Akyol H., Sarialioglu F., Buyukpamuku M. Hepatitis B virus infection in pediatric cancer patients receiving anticancer chemotherapy. Turk. J. Cancer, 1990, vol. 20, pp. 104-108.
- Kebudi R., Ayan I., Yilmaz G., Akici F., Gorgun O., Badur S. Seroprevalence of hepatitis B, hepatitis C, and human immunodeficiency virus infections in children with cancer at diagnosis and following therapy in Turkey. Med. Pediatr. Oncol., 2000, vol. 34, no. 2, pp. 102-105. DOI: 10.1002/(sici)1096-911x(200002)34:2<102::aid-mpo5-3.0.co;2-#
- Berberoglu S. The seroprevalence of hepatitis B, hepatitis C and human immunodeficiency virus infections in paediat-ric oncology patients in Turkey. Postgrad. Med. J., 1996, vol. 72, no. 852, pp. 609-611. DOI: 10.1136/pgmj.72.852.609
- Kocaba§ E., Aksaray N., Alhan E., Tanyeli A., Koksal F., Yarkin F. Hepatitis B and C virus infections in Turkish children with cancer. Eur. J. Epidemiol., 1997, vol. 13, no. 8, pp. 869-873. DOI: 10.1023/A:1007420725704
- Sevinir B., Meral A., Gunay U., Ozkan T., Ozuysal S., Sinirtas M. Increased risk of chronic hepatitis in children with cancer. Med. Pediatr. Oncol., 2003, vol. 40, no. 2, pp. 104-110. DOI: 10.1002/mpo.10090
- Tavil B., Cetin M., Tuncer M., Gumruk F., Yuce A., Demir H., Aytac S., Kuskonmaz B. [et al.]. The rate of hepatitis B and C virus infections and the importance of HBV vaccination in children with acute lymphoblastic leukemia. Hepatol. Res., 2007, vol. 37, no. 7, pp. 498-502. DOI: 10.1111/j.1872-034X.2007.00079.x
- Kose S., Olmezoglu A., Gozaydin A., Ece G. Seroprevalence of hepatitis B and C among oncology patients in Turkey. J. Health Popul. Nutr., 2011, vol. 29, no. 6, pp. 652-655. DOI: 10.3329/jhpn.v29i6.9903
- Kebudi R., Agasoy T., Kizilocak H., Ozdemir G.N. Seroprevalence of Hepatitis B, Hepatitis C, and HIV in children with cancer at diagnosis and following therapy in Turkey: progress within the last 25 years. Turk Pediatri Ars., 2019, vol. 54, no. 2, pp. 82-85. DOI: 10.14744/TurkPediatriArs.2019.88261
- Oguz A., Aykas F., Unal D., Karahan S., Uslu E., Basak M., Karaman A. Hepatitis B and C seroprevalence in solid tumors - necessity for screening during chemotherapy. Asian Pac. J. Cancer Prev., 2014, vol. 15, no. 3, pp. 1411-1414. DOI: 10.7314/apjcp.2014.15.3.1411
- Akdemir I., Demirci A., Çinar G., Çelen M.K. Seroprevalence Investigation of Hepatitis B and Hepatitis B Core Antigen in Oncology Patients. Viral Hepatitis Journal, 2020, vol. 26, no. 3, pp. 110-113. DOI: 10.4274/vhd.galenos.2020.2020.0036
- Said Z.N., El-Sayed M.H., El-Bishbishi I.A., El-Fouhil D.F., Abdel-Rheem S.E., El-Abedin M.Z., Salama I.I. High prevalence of occult hepatitis B in hepatitis C-infected Egyptian children with haematological disorders and malignancies. Liver Int., 2009, vol. 29, no. 4, pp. 518-524. DOI: 10.1111/j.1478-3231.2009.01975.x
- Satsuk A.V., Solopova G.G., Churilova N.S., Vlasenko N.V., Panasiuk Ya.V., Ploskireva A.A., Akimkin V.G. Hepatitis C in immunocompromised pediatric patients: an epidemiological analysis of data from a center of pediatric hematology, oncology and immunology. Klinicheskaya mikrobiologiya i antimikrobnaya khimioterapiya, 2021, vol. 23, no. 4, pp. 340-346. DOI: 10.36488/cmac.2021.4.340-346 (in Russian).


