Значение индекса ALPS и способы оценки глимфатической системы - современное состояние
Автор: Ахлестина А.В., Петряйкин А.В., Владзимирский А.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 3 т.25, 2025 года.
Бесплатный доступ
В данной работе представлен глубокий анализ научных исследований и публикаций, посвящённых методам оценки глимфатической системы головного мозга. Особое внимание уделяется неинвазивным способам её анализа с использованием индекса ALPS, который рассчитывается на основе диффузионно-взвешенных МРТ-изображений. В процессе исследования были изучены как российские, так и зарубежные публикации, касающиеся этой темы. Ключевые результаты этих исследований были проанализированы и сопоставлены. В заключение предложены направления для дальнейшего научного поиска в данной области.
Глимфатическая система, индекс ALPS, МРТ, диффузионно-взвешенные изображения, нейродегенеративные заболевания, болезнь Альцгеймера
Короткий адрес: https://sciup.org/149149280
IDR: 149149280 | DOI: 10.24412/1999-7264-2025-3-40-50
Текст научной статьи Значение индекса ALPS и способы оценки глимфатической системы - современное состояние
Долгое время считалось, что в головном мозге человека и других млекопитающих отсутствует лимфообращение, поскольку не было обнаружено гистологических доказательств наличия в нём лимфатических сосудов [1,2]. Кроме того, гематоэнцефалический барьер, расположенный в головном мозге, значительно снижает процесс транскапиллярной фильтрации и образования тканевой жидкости, которая впоследствии становится лимфой [3]. Это предполагаемое отсутствие лимфообращения вызывало значительные вопросы, поскольку мозг — это орган с активным метаболизмом, который производит большое количество продуктов распада и токсинов, включая крупные белковые соединения. Определенная роль в выведении продуктов метаболизма отводилась цереброспинальной жидкости (ликвору), тем не менее, оставалось не до конца изученным, как именно продукты метаболизма, выделяемые паренхимой мозга, достигают крупных ликворных пространств — желудочков мозга, цистерн. Однако в 2012 году международная группа учёных из Рочестерского университета под руководством Майкен Недергаард (Дания), провела эксперимент на мышах, доказав, что ликвор циркулирует не только в желудочках мозга, но и в его паренхиме. Используя флуоресцентные метки, исследователи выяснили, что ликвор проникает в паренхиму через периваскулярные пространства, которые окружают артерии, проникающие в ткань мозга. Точно так же он выводится из мозга через периваскулярные пространства вокруг мелких вен. Эту систему, обнаруженную учёными, они назвали «глимфатической». Такое название было выбрано из-за важной роли глиальных клеток в её функционировании и её роли в выведении продуктов метаболизма, что характерно для лимфатической системы.
Исследователи считают, что движение жидкости в периваскулярных пространствах осуществляется благодаря пульсации сосудов, расположенных в этих пространствах, осмотическому давлению, а также активной роли глиальных клеток, особенно астроцитов.
Следует отметить что функция глимфатической системы, по мнению исследователей, тесно связана с активностью белков аквапоринов, в частности аквапорина-4. Аквапорины представляют собой белки, образующие каналы, по которым вода проходит через клеточные мембраны. Эти каналы помогают молекулам воды преодолеть липидный бислой. Аквапорин-4 является преобладающим водным каналом клеток мозга. Наиболее высокая концентрация данного белка обнаруживается в ножках астроцитов — глиальных клеток, формирующих гематоэнцефалический барьер.
В исследованиях на лабораторных животных было обнаружено, что отсутствие белка аквапорин-4 (AQP4) приводит к замедлению тока ликвора по периваскулярным пространствам. В результате клиренс растворенных веществ снижается примерно на 70%. Это открытие позволяет предположить, что астроциты играют важную роль в интрапаренхиматозном токе ликвора [1]. В настоящее время остаётся открытым вопрос о том, как именно аквапорин-4 регулирует поток жидкости в глимфатической системе. Согласно одной из гипотез, вода и растворённые вещества попадают из периартериальных пространств в паренхиму через промежутки между концевыми отростками астроцитов. При этом поток в этих промежутках каким-то образом регулируется AQP4, который является водным каналом, поэтому молекулы растворённых веществ не могут проходить через него напрямую.
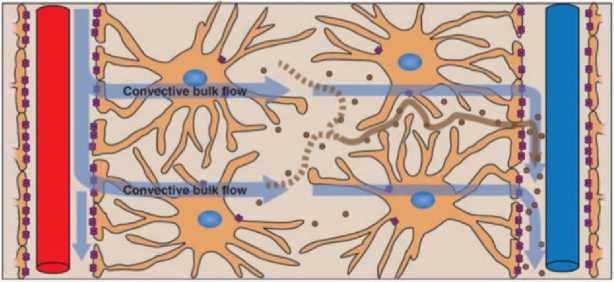
По мнению исследователей, образовавшись в желудочках головного мозга и проникнув в паренхиму мозга, ликвор частично смешивается с тканевой интерстициальной жидкостью, а оттекая от паренхимы, обеспечивает тем самым клиренс метаболитов. Затем основная его масса всасывается в кровоток через арахноидальные грануляции [1,2], а отчасти также и в 41
лимфатическую систему через влагалища нервов, в которые продолжаются мозговые оболочки (Рис. 1).
Отмечается, что флуоресцентно-меченный в-амилоид (белок, предположительно, участвующий в патогенезе болезни Альцгеймера) в эксперименте выводился из паренхимы головного мозга по периваскулярным пространствам, а генетически заданное отсутствие AQP4 у лабораторных мышей существенно снижало клиренс в-амилоида, что позволило исследователям предположить о значительной роли дисфункции открытой ими системы в развитии нейродегенеративных заболеваний, в том числе, болезни Альцгеймера [1,4].
По мнению исследователей, этот же механизм обеспечивает удаление тау-белков, накопление которых также характерно для нейродегенеративных заболеваний, таких как упомянутая болезнь Альцгеймера и таупатий. Также этот процесс способствует выведению глиофиламентов — крупных белковых структур, которые образуются в процессе мозговой активности [2].
Interstitial fluid and solute clearance
AQP4
Para-arterial influx
Paravenous efflux
Interstitial solutes Solute clearance
Рис. 1. Современное представление о функционировании глимфатической системы на клеточном уровне. Голубыми стрелками продемонстрировано направление тока жидкости в системе, фиолетовым цветом выделены молекулы белка-аквапорина. (Цит. по [1]).

Water flux
Отдельно стоит отметить тот факт, что скорость обмена по глимфатической системе варьирует вместе с циклом сон-бодрствование. Микроскопическая оценка движения флуоресцентных индикаторов, введенных в большую цистерну, выявила увеличение на ~ 95% периартериального притока красителя в мозг мышей во время сна или под наркозом по сравнению с бодрствующими животными [5]. Особое значение при этом имела фаза медленного сна.
Наличие лимфатических сосудов в оболочках головного мозга было многократно подтверждено гистологически, и не отрицается широким кругом исследователей, однако функционально оболочки головного мозга не относятся к паренхиме мозга и не являются его частью.
Способы оценки глимфатической системы
В течение последующих пяти лет после ее открытия оценка глимфатической системы проводилась с помощью двухфотонной микроскопии или введения гадолиний-содержащего контраста и носила исключительно инвазивный характер, что затрудняло изучение ее закономерностей, в том числе в рамках исследования человеческого мозга. Введение индикаторов людям не проводилось, за исключением ограниченного числа исследований [6,7]. За этот период в некоторых исследованиях была установлена взаимосвязь между снижением функции глимфатической системы и рядом патологических состояний, например, нормотензивной гидроцефалией [8].
В 2017 году группа исследователей из Японии [9] предложила новый неинвазивный метод изучения функции глимфатической системы, допускающий оценку ее активности у 42
человека. Данный метод “Diffusion tensor image analysis along the perivascular space (DTI-ALPS)” – анализ изображений тензора диффузии вдоль периваскулярных пространств – предполагал оценку движения молекул воды в трех взаимно перпендикулярных плоскостях (x, y, z) по латеральному краю боковых желудочков мозга по ходу основных проводящих волокон (то есть, прежде всего, в белом веществе головного мозга). В области ассоциативных и проекционных волокон в правом и левом полушарии выделялись точки интереса (ROI), затем подсчитывался индекс ALPS: ALPS = (Dxxpro + Dxxass) / (Dyypro + Dzzass) где Dxxpro, Dxxass, Dyypro, Dzzass – компоненты тензора диффузии, измеренные в областях проекционных и ассоциативных волокон. Исходя из формулы, в идеальной математической системе значение индекса ожидаемо должно быть равно единице, тем не менее на практике значения индекса отклоняются в большую либо меньшую сторону (Рис. 2).
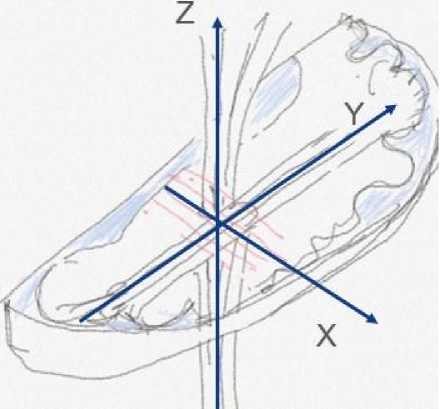
Рис. 2. Взаиморасположение проводящих пучков в головном мозге, перивентрикулярных сосудов (выделены красным) и их соответствие осям Х, Y, Z.
В исследование были включены пациенты с болезнью Альцгеймера, а также пациенты с когнитивными нарушениями разной степени тяжести. Всего в исследовании принял участие 31 пациент (14 мужчин и 17 женщин; возрастной диапазон составил 51–89 лет; медиана — 76 лет). Из 31 пациента 16 страдали болезнью Альцгеймера, остальные имели различные невыраженные когнитивные нарушения, такие как снижение памяти [9]. Была подтверждена значительная корреляция между тяжестью проявления болезни Альцгеймера (степенью выраженности когнитивных нарушений согласно опроснику «MMSE» - mini–mental state examination) и снижением индекса ALPS, отражающего функциональность глимфатической системы. Опросник MMSE – это широко применяемая методика для оценки когнитивных нарушений. Он представляет собой анкету, которую пациент заполняет самостоятельно. В зависимости от набранных баллов – от 0 до 30 – определяется степень выраженности деменции.
Прикладные исследования
Открытие японских ученых позволило расширить спектр изучения глимфатической системы. Появились, в том числе российские работы, посвященные изучению активности данной системы. В российском исследовании, посвященном закономерностям развития перитуморозного отека при менингиомах [10] значение индекса ALPS в группе пациентов без отёка составило 1,510±0,19, при менингиомах с отеком — 1,308±0,19, различие статистически значимо (p=0,014). Таким образом, установлено снижение индекса ALPS при менингиомах с отеком. В другой российской работе, посвященной общим закономерностям развития перитуморозного отёка при различных новообразованиях мозга (менингиомах, глиомах Grade III—Grade IV, метастазах, лимфомах) [11] было выявлено значимое снижение индекса ALPS у пациентов с вызывающими перитуморозный отек новообразованиями головного мозга. Отдельным достоинством данного исследования [11] следует назвать участие в нем контрольной группы здоровых добровольцев. Так было выявлено, что при опухолях без перитуморзного отека значения ALPS были близки к таковым для неизмененного мозга, что может свидетельствовать о более высокой глимфатической функции, которая способствует клиренсу интерстициальной жидкости и предотвращению возникновения отека.
В 2021 году была опубликована работа [12], посвященная исследованию индекса ALPS в когорте пожилых пациентов. В исследование были включены пациенты без когнитивных нарушений, пациенты с болезнью Альцгеймера и пациенты c начальными когнитивными нарушениями. Для оценки состояния данных пациентов также был использован вышеназванный опросник MMSE (краткая шкала оценки психического статуса). Также в данной работе использовалась шкала ADAS-Cog 11 – тест оценки тяжести болезни Альцгеймера, состоящий из 11 пунктов, как это следует из его названия, широко используемый в практической медицине и клинических испытаниях с 1984 года, входящий в «золотой стандарт» диагностики болезни Альцгеймера. В ходе исследования было выявлено, что показатели этих шкал имеют обратную зависимость от изменений индекса ALPS. Также было обнаружено, что колебания индекса ALPS значительно различаются в трёх исследуемых группах пациентов: без признаков деменции, с лёгкими когнитивными нарушениями, с диагностированной болезнью Альцгеймера.
Была установлена взаимосвязь между отложениями амилоида и тау-белка и изменениями индекса ALPS у пациентов с сахарным диабетом [13]. Тау-протеин – белковое соединение, в норме присутствующее в головном мозге, но также его избыточное накопление характерно для болезни Альцгеймера и других форм деменции. Содержание данных соединений в головном мозге устанавливалось путём позитронно-эмиссионной томографии (ПЭТ). Значимые отрицательные корреляции между значениями индекса ALPS и накоплением амилоида (по данным ПЭТ) были обнаружены в коре височных и теменных долей с обеих сторон, а также в задней поясной извилине слева (серое вещество головного мозга). Поясная извилина (лат. gyrus cinguli) является частью поясной коры и расположена непосредственно над мозолистым телом. Поясная кора считается частью лимбической доли. В этой же анатомической области, по данным российских исследований, происходят изменения морфометрических показателей головного мозга при деменции — наиболее значимыми зонами, отличающими группы пациентов с деменцией и умеренными когнитивными расстройствами, является кора задних отделов поясных извилин и надкраевая извилина слева [14]. Кроме того, у всех испытуемых была обнаружена сильная отрицательная корреляция между индексом ALPS и накоплением тау-белка. Удивительно, что индекс ALPS связан с отложением тау-белка и амилоида в областях мозга, которые не связаны с белым веществом вокруг боковых желудочков, что обычно оценивается с помощью метода ALPS.
Были предприняты попытки установить взаимосвязь колебаний индекса с болезнью Паркинсона, которая также является нейродегенеративным заболеванием и связана с накоплением белка альфа-синуклеина – небольшого белкового соединения, состоящего из ~140 аминокислот. Данный белок, как известно, патологически накапливается в нейронах черной субстанции, чем вызывает их дисфункцию и гибель нервных клеток [15,16]. Поскольку данная патология также связана с избыточным накоплением белковых веществ, было выдвинуто предположение, что её возникновение может быть обусловлено сбоями в работе глимфатической системы и нарушениями циркуляции жидкости в головном мозге.
Исследование, в котором проводилось сравнение между группами пациентов с болезнью Паркинсона и группой пациентов с эссенциальным тремором показало более низкие значения индекса ALPS в группе пациентов с болезнью Паркинсона и более высокие значения индекса в группе пациентов, страдающих от эссенциального тремора [17].
В исследовании были проанализированы значения индекса ALPS у пациентов с артериальной гипертензией и сравнены с показателями контрольной группы людей без признаков гипертонии [18]. Результаты показали, что значения индекса в группе с артериальной гипертензией значительно ниже, чем в контрольной группе. Кроме того, у всех испытуемых наблюдалась достоверная отрицательная корреляция между ALPS-индексом и значениями артериального давления, а также с пульсовым давлением — разницей между систолическим и диастолическим артериальным давлением. Это может означать, что артериальная гипертензия, которая приводит к очаговым сосудистым изменениям в головном мозге, вызывает их косвенно, через нарушение динамики тока жидкости в мозге.
В исследовании, в котором приняли участие 133 пациента с проявлениями болезни малых сосудов различной степени выраженности [19], была выявлена корреляция между снижением внимания и памяти и низкими значениями индекса ALPS. В исследовании с более чем двумя тысячами участников [20] были получены данные о том, что чем ниже значения индекса, тем более выражены проявления болезни малых сосудов на МР-изображениях. Независимо от проявлений болезни малых сосудов, низкий индекс ALPS был достоверно ассоциирован с другими неблагоприятными МР-признаками, такими как наличие на изображениях расширенных периваскулярных пространств (в том числе в области базальных ядер [20,21]), сосудистыми лакунами [21] и корковой атрофией [20].
Как уже было сказано выше [8], инвазивные исследования показали снижение функциональности глимфатической системы у пациентов с идиопатической нормотензивной гидроцефалией – нейродегенеративным заболеванием, которое клинически характеризуется снижением когнитивных способностей, нарушением походки и недержанием мочи, а по данным МР-изображений – расширением желудочковой системы на фоне внутричерепного давления, находящегося в пределах возрастной нормы. Идиопатическая нормотензивная гидроцефалия зачастую является состоянием, коморбидным болезни Альцгеймера. Неинвазивные исследования, основанные на расчете индекса ALPS [22], продемонстрировали значительно более низкие значения индекса в группе пациентов с истинной идиопатической нормотензивной гидроцефалией и более высокие значения индекса в группе пациентов, не подходящих под критерии истинной нормотензивной гидроцефалии. При этом при дифференциальной диагностике истинной нормотензивной гидроцефалии и имитирующих ее состояний различия индекса ALPS показали более высокую диагностическую значимость, чем индекс Эванса или изменения угла мозолистого тела, которые обычно используются для дифференциальной диагностики данного состояния [22].
Так как одним из способов лечения нормотензивной гидроцефалии является проведение шунтирования, была предпринята попытка измерения индекса до операции и в послеоперационной когорте пациентов [23]. При этом усредненные значения для группы послеоперационных пациентов оказались выше, чем значения индекса до проведения шунтирования. Стоит отметить, что повышение индекса определялось исключительно в той части послеоперационной когорты пациентов, которая демонстрировала улучшение симптоматического состояния после операции. В группе пациентов после операции, у которых не было улучшения их симптоматического состояния, повышения индекса ALPS достоверно не отмечалось.
Были предприняты попытки установить взаимосвязь между колебаниями индекса и возрастом пациентов. В некоторых работах, посвященных взаимосвязи возраста и индекса ALPS, была установлена отрицательная корреляция между возрастом и значениями индекса. Однако в данные исследования также включались предпочтительно пациенты с болезнью Альцгеймера, эссенциальным тремором и другими нейродегенеративными состояниями. Можно назвать лишь отдельные работы, в которых анализировались данные условно здоровых участников исследования в возрасте от 50 лет и старше [24] (по итогам работы была установлена отрицательная корреляция), однако лица более молодого возраста в когорту испытуемых включены не были.
Также были предприняты попытки изучить изменения этого индекса у детей и молодых людей в возрасте от 12 до 46 лет, страдающих эпилепсией. Однако не все специалисты считают эту работу объективной. Дело в том, что у детей не все волокна белого вещества полностью сформированы, и некоторые авторы не считают корректным включать их в исследование наравне со взрослыми. Кроме того, в данной работе анализировались только пациенты, у которых уже были эпилептические проявления, в то время как условно здоровые люди не рассматривались в большом количестве.
Кроме многократно упомянутого нами выше опросника MMSE (краткая шкала оценки психического статуса) и шкалы ADAS-Cog 11, используемой для диагностики болезни Альцгеймера, снижение индекса ALPS коррелировало в других работах со снижением показателей по тестам Time Up and Go test (TUG) – тест для оценки подвижности пациента и его способности поддерживать равновесие [25] и Montreal Cognitive Assessment (MoCA-J) – форме скрининга когнитивных нарушений [21].
Заключение
В апреле 2024 года группа японских исследователей, возглавляемая Taoka, основоположником метода, опубликовала объемный обзор, посвященный индексу ALPS [26], его применению с момента внедрения, предположительным достоинствам и недостаткам метода. В данной работе было указано, что, несмотря на все достоинства метода ALPS-DTI, данный метод не может быть однозначным критерием оценки глимфатической системы, так как при его использовании объективно измеряется исключительно диффузия воды вдоль периваскулярных пространств в белом веществе головного мозга в ограниченной анатомической области (по краям боковых желудочков головного мозга). Функциональность глимфатической системы может нарушаться при нейродегенеративных заболеваниях, опухолях и других патологиях как в белом, так и в сером веществе головного мозга, затрагивая различные анатомические области. Это создает определённые ограничения в исследованиях. Однако, как уже упоминалось ранее, в некоторых работах изменения индекса в белом веществе коррелировали со структурными изменениями в сером веществе [13]. К сожалению, как считают авторы метода ALPS, в настоящее время не существует единого метода, который мог бы полностью оценить работу глимфатической системы. Этот метод должен включать в себя оценку циркуляции жидкости как на микроуровне в сером и белом веществе, так и в крупных ликворных пространствах. Taoka и его коллеги надеются, что в будущем будет разработан метод, который объединит все существующие на данный момент способы изучения глимфатической системы и циркуляции жидкости в центральной нервной системе.
Несмотря на ограничения метода, измерение индекса ALPS остается наиболее дешевым, быстрым, безопасным методом оценки глимфатической системы, позволяющим по изменению ее функциональности в белом веществе, судить об общем состоянии данной системы в головном мозге. Многочисленные работы, подтвердившие статистическую значимость колебаний данного индекса при нейродегенеративных и других заболеваниях головного мозга, подтверждают высокую актуальность дальнейшего изучения возможностей метода. Так как во всех проанализированных нами работах не было предпринято попыток установить эталонное значение индекса в популяции и его нормальное распределение по возрастным группам, в том числе в зависимости от пола и других легко определяемых критериев, дальнейший научный поиск должен продолжаться, включая данное направление. Необходимо определить статистически обоснованные нормы изменений этого индекса в зависимости от пола и возраста пациентов. Также важно выяснить, как на ALPS влияют наиболее распространенные в популяции изменения головного мозга: болезнь малых сосудов, расширение наружных ликворных пространств, увеличение желудочков и другие.
Такое масштабное исследование возможно благодаря технологиям искусственного интеллекта, которые активно применяются в лучевой диагностике, в том числе для научных целей [27].
Как уже было отмечено, в идеальной математической модели значение индекса должно быть равно единице. Однако на практике у пациентов этот индекс может отклоняться от единицы как в сторону увеличения, так и в сторону уменьшения. Чтобы оценить адекватность математической модели, необходимо провести испытания на упрощённом фантоме, который имитирует движение жидкости в мозге человека, исключая индивидуальные особенности каждого пациента [28]. Таким образом, при анализе степени изменчивости индекса, мы будем отталкиваться не от идеальной модели, где индекс равен 1,00, а от значений фантома, который будет отражать реальные идеальные значения индекса в клинической практике.
Выводы
-
1. Получены доказательства наличия в головном мозге так называемой «глимфатической системы», аналогичной лимфатической системе других органов и тканей, ответственной за выведение из головного мозга токсинов и крупных белковых соединений. Установлена важная роль этой системы в удалении крупных белковых соединений. Это позволяет предположить, что она играет ключевую роль в развитии многих нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и различные виды деменции, которые характеризуются накоплением белков в мозге.
-
2. Активность глимфатической системы можно измерить как инвазивными, так и неинвазивными методами. Одним из таких неинвазивных способов является измерение индекса ALPS-DTI. На данный момент этот индекс считается одним из самых простых, доступных и безопасных способов оценки глимфатической системы.
-
3. Многие исследования подтвердили взаимосвязь между снижением индекса ALPS и развитием нейродегенеративных заболеваний. Кроме того, было установлено, что снижение индекса может быть связано с некоторыми другими патологическими состояниями, такими как образование отёков при опухолях.
-
4. Индекс ALPS не отражает функционирование глимфатической системы в целом, поскольку он измеряется в определённом анатомическом регионе головного мозга — в белом веществе по краю тел боковых желудочков. Тем не менее индекс ALPS продемонстрировал свою эффективность в качестве диагностического критерия, и требуется дальнейшее исследование его возможностей. В частности, необходимо определить значения индекса для различных возрастных групп условно здоровых пациентов. Также важно сравнить математическую модель индекса с данными «идеального» фантома, который имитирует движение жидкости в головном мозге человека.
-
5. Перспективным выглядит проведение популяционного исследования данного индекса для различных возрастных групп.
Вклад авторов . А.В. Петряйкин: формулирование идеи, подбор иллюстраций, редактирование и утверждение окончательного варианта статьи; А.В. Ахлестина: формулирование идеи, сбор, обработка и анализ материала, интерпретация результатов исследования, редактирование текста рукописи; А.В. Владзимирский: редактирование и утверждение окончательного варианта статьи. Все авторы прочли и одобрили окончательный вариант статьи.
Финансирование. Данная статья подготовлена авторским коллективом в рамках НИР «Научное обеспечение стандартизации, безопасности и качества магнитно-резонансной томографии», (№ ЕГИСУ: № 123031500007-6) в соответствии с Приказом от 17.12.2024 г. № 1184 "Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счет средств бюджета города Москвы государственным бюджетным (автономным) учреждениям подведомственным Департаменту здравоохранения города Москвы, на 2025 год и плановый период 2026 и 2027 годов" Департамента здравоохранения города Москвы.
Заявление об информационном согласии. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


