Значение протеомного состава мочи при заболеваниях мочевыводящих путей (обзор литературы)
Автор: Захарова Н.Б., Пастушкова Л.Х., Ларина И.М., Каширина Д.Н., Лях Р.Н., Попков В.М.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Одним из направлений совершенствования методов персонализированной медицины является клиническая протеомика, участвующая в работе по открытию биомаркеров различных заболеваний. Внедрение в клиническую практику методов иммуноферментного анализа показало, что целый ряд мочевых белков может быть использован для оценки состояния почечной паренхимы, мочевыводящих путей, заболеваний сердечно-сосудистой системы и др. Новой и одной из самых мощных и широко применяемых в целях поиска биомаркеров технологий является масс-спектрометрия, позволяющая получать информацию сразу о сотнях белков. Современная диагностика изменений белкового состава мочи с помощью MALDI-TOF масс-спектрометрии в течение ряда лет успешно применяется в исследованиях протеомного состава мочи при действии реальных и моделируемых факторов космического полета. Успешно решен ряд сложных проблем, сдерживающих продвижение исследований в физиологии и медицине. Отработана система пробоподготовки, стандартизирован её преаналитический этап применительно к такому клиническому биоматериалу, как моча. Нивелирован целый ряд недостатков программного обеспечения, затрудняющих достоверную интерпретацию результатов. В настоящее время требуется разработка требований по стандартизации условий сбора образцов мочи для количественного протеомного исследования с целью «продольного» или группового сравнения, а также для различных актуальных условий деятельности почки пациента. Исследования протеомного состава мочи можно считать перспективными с точки зрения возможности выявления новых, надёжных и специфических маркеров в моче у пациентов с хроническими заболеваниями почек в начальных стадиях их доклинического повреждения.
Клиническая протеомика, биомаркеры, протеом мочи, масс-спектрометрия
Короткий адрес: https://sciup.org/142188394
IDR: 142188394
Текст обзорной статьи Значение протеомного состава мочи при заболеваниях мочевыводящих путей (обзор литературы)
экспериментальная и клиническая урология № 1 2 0 17
Высокочувствительные масс-спектрометрические методы способствовали получению новых данных о белковом составе жидкостей тела человека как в норме, так и при патологии. Считается, что наиболее значимые успехи в плане практического применения масс-спектрометры имеют в области исследований протеома мочи [34]. Современные методы разделения белковых смесей и определения отдельных компонентов этих смесей с применением масс-спектрометрии позволили определить в образцах мочи человека до 3500 различных белков [35]. Современная диагностика изменений белкового состава мочи с помощью MALDI–TOF масс-спектрометрии в течение ряда лет успешно применяется сотрудниками лаборатории «Протеомики» Института медико-биологических проблем в исследованиях протеом-ного состава мочи при действии реальных и моделируемых факторов космического полета. Успешно решен ряд сложных проблем, сдерживающих продвижение исследований в физиологии и клинике. Отработана система пробоподготовки, стандартизирован ее преаналитиче-ский этап применительно к такому клиническому биоматериалу, как моча.
Нивелирован целый ряд недостатков программного обеспечения, затрудняющих достоверную интерпретацию результатов. Тщательно разработан весь процесс, требуемый для исследования протеомного состава мочи, включающий:
– Преаналитический этап – сбор мочи, методы проведения про-боподготовки. Установлено, что аналитическая воспроизводимость исследования белкового состава мочи масс-спектрометрическими методами не зависит от продолжительности замораживания, образец остается стабильным в течение нескольких лет, даже при хранении при -20 °C. Воспроизводимость поддерживается и в образцах, сохраняемых до 5-6 часов при комнатной темпера- туре, или до трех дней при 400С, за счет небольшого количества протеаз в данном биологическом материале. Пробоподготовку для дальнейшего анализа протеомного состава мочи осуществляют согласно стандартному протоколу (протокол обработки мочи для скрининга, HUPO-2007, Сеул, Корея) [36].
– Аналитический этап – при получении масс-спектров применяют различные хромато-масс-спектрометрические системы. Например, система может состоять из хроматографа Agilent 1100 (Agilent Technologies Inc., США) и гибридного масс-спектрометра LTQ-FT Ultra (Thermo, Германия). В этом случае хроматографическое разделение смеси белков после трипсинолиза проводят на базе нанопоточ-ного высокоэффективного жидкостного хроматографа (нано-ВЭЖХ) Agilent 1100 (Agilent Technologies Inc., Санта-Клара, США). Для градиентной хроматографии применяют home-made колонку с использованием капилляра-эммитера (Pico-tip, New Objective Inc., США), описанную Y. Ishihama и др. [37].
Как правило, из каждого образца мочи получают два образца триптической смеси, которую анализируют трижды на масс-спектрометре. Для последующего анализа отбираются лишь те белки, которые были обнаружены в двух или трех повторах. Целесообразность такой «строгости» оспаривается рядом специалистов, работающих с образцами мочи (частные дискуссии). Их аргументация сводится к доводу, что если в образце однажды (в одном из прогонов) был достоверно идентифицирован тот или иной белок, то это свидетельствует о том, что он есть в образце, и скорее надо критиковать те масс-спектрометрические прогоны, в которых он не выявлялся. В качественной протеомике мочи о динамике изменения протеома судят по частоте встречаемости белков в образцах, считая, что факт обнаружения белка в образце, при сохранении чувствитель- ности LC/MS метода, связан с его концентрацией.
-
- Постаналитический этап – применение комплекса современных биоинформационных технологий, включающих в себя: 1. Поиск и идентификация белков по базе данных IPI-human при помощи программы Mascot; 2. Обработка с помощью уникальной программы, разработанной в лаборатории профессора Е.Н. Николаева [38], результатов Mascot-поиска; 3. Применение комплекса биоинформационных ресурсов для определения места образования, функции выявленных в моче белков, а также для анализа биологических процессов, в которых они участвуют; 4. Анализ ткане-специфичности экспрессии и тканевой локализации белков; определение молекулярных функций, биологических процессов и клеточной локализации; сверхпредставленности биологических процессов, молекулярных функций, связанных с выявленными белками; построение ассоциативных генных сетей между белками.
Для определения места образования в организме и биологической функции выявленных белков, а также для анализа биологических процессов, в которых они участвуют, применяют следующие био-информационные ресурсы: UniPro-tKB [], TiGER [], Gene Ontology [http://geneontology. org/]. Для определения сверхпред-ставленных биологических процессов используют программу BiNGO со следующими параметрами: статистический критерий — гипергеометрический критерий; поправка на множественное сравнение Бен-жамина Хохберга; уровень значимости: 0,05; референсная выборка – полная аннотация, как референсная выборка; файл онтологии — Custom, Gene Ontology (format-version:1.2 data-version: 2013– 08–21); организм/аннотация: GO Annotation_Human (Submission Date: 8/5/2013).
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ ИЗУЧЕНИЯ БЕЛКОВОГО СОСТАВА МОЧИ ЧЕЛОВЕКА
ПРОТЕОМНЫМИ МЕТОДАМИ
Существуют объективные и до сих пор не преодоленные трудности в интерпретации результатов исследования протеома мочи, в определенной степени сдерживающие широкое использование технологий протеомики в клинической области. Их можно условно разделить на следующие категории.
-
1. Высокая индивидуальная («продольная») вариабельность про-теома мочи. При сопоставлении белкового состава образцов мочи одного и того же человека (здорового или пациента в процессе диагностики, или мониторинга терапии) необходимо увидеть значимые изменения в составе и по ним сделать заключение того или иного характера. При этом нельзя не принимать во внимание, что белковый состав мочи, главным образом, зависит от:
-
- белкового состава крови (вариабельность которого, при изучении методами протеомики на основе масс-спектрометрии, составляет около 25% [38]. По данным О.М. Трифоновой индивидуальная вариабельность белкового состава крови здоровых добровольцев в контролируемых условиях, исследованная на протяжении 3 недель, составила 22±13% [39].
-
- вариабельность белкового состава мочи зависит также от актуальной функции почки, как эффекторного органа поддержания водноэлектролитного гомеостаза внутренней среды организма. Этот аспект практически не исследован, за исключением небольшого числа работ, выполненных с участием здоровых добровольцев или пациентов разных нозологических групп.
Сообщается, что «продольная» вариабельность белкового состава мочи при маcс-спектрометрическом исследовании составляет 45%, или достигает 58% [40, 41]. По нашим данным, полученным при исследовании здоровых добровольцев в контролируемых условиях потребления основных нутриентов, жидкости, двигательной активности, состава атмосферы в замкнутом объекте – даже численный состав белков в моче может сильно варьировать при сравнении двух последовательных недель наблюдения (рис. 1) [42]. При исследовании проб мочи 30,7% из числа выявляемых прямым профилированием пиков у здорового человека имеют «продольную» вариабельность, вдвое превышающую аналитическую на протяжении времени обследования в 3 месяца [43].
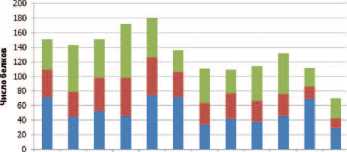
1-2 2-3 3-4 4-5 5-6 6-7 7-8 8-10 10-11 11-12 12-13 13-14
Сравниваемые недели
■ только 1-ая неделя ■ пересечение “ только 2-ая неделя
Рис. 1. Изменения белкового состава мочи, собранной еженедельно (при сравнении двух последовательных недель)
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ КОЛИЧЕСТВЕННОЙ ПРОТЕОМИКИ МОЧИ
Получение количественных данных об экскреции различных белков почкой методами протеомики на основе масс-спектрометрии сейчас абсолютно реально. Разработано множество методических подходов, дающих воспроизводимые и точные, в том числе количественные, данные по протеому мочи человека [44,45,46]. Тем не менее, эти прорывы в приборостроении, разработке различных методов намного опередили возможности использования их результатов медиками в диагностических и других целях.
Еще два десятилетия назад были получены результаты исследований, которые говорили о возможности увеличения экскреции белка, зависящей от некоторых непатологических факторов, таких как интенсивная физическая нагрузка, ортостаз, лихорадка, эмоциональный стресс. Увеличение экскреции некоторых белков почкой может наступать и при изменении скорости мочеотделения. Тем не менее, факторы регуляции уровня экскреции белка почкой не описаны. Остаются открытыми вопросы о пределах вариабельности и механизмах влияния процессов, лежащих в основе мочеобразования, на уровень экскреции белка в норме. Это обстоятельство не дает возможности установить референсные интервалы для экскреции различных белков с мочой. Выяснение условий развития физиологической протеинурии представляет безусловный интерес, как для нормальной физиологии, так и для практической медицины.
экспериментальная и клиническая урология № 1 2 0 17
Резюме:
Одним из направлений совершенствования методов персонализированной медицины является клиническая протеомика, участвующая в работе по открытию биомаркеров различных заболеваний. Внедрение в клиническую практику методов иммуноферментного анализа показало, что целый ряд мочевых белков может быть использован для оценки состояния почечной паренхимы, мочевыводящих путей, заболеваний сердечно-сосудистой системы и др. Новой и одной из самых мощных и широко применяемых в целях поиска биомаркеров технологий является масс-спектрометрия, позволяющая получать информацию сразу о сотнях белков. Современная диагностика изменений белкового состава мочи с помощью MALDI–TOF масс-спектрометрии в течение ряда лет успешно применяется в исследованиях протеомного состава мочи при действии реальных и моделируемых факторов космического полета. Успешно решен ряд сложных проблем,
Список литературы Значение протеомного состава мочи при заболеваниях мочевыводящих путей (обзор литературы)
- Сучков С.В., Гнатенко Д.А., Костюшев Д.С., Крынский С.А., Пальцев М.А. Протеомика как фундаментальный инструмент доклинического скрининга, верификации анализов и оценки применяемой терапии. Вестник Российской академии медицинских наук. 2013;68(1):65-71 DOI: 10.15690/vramn201368165-71
- Ozer JS., Dieterle F, Troth S, Perentes E, Cordier A, Verdes P. et al. A panel of urinary biomarkers to monitor reversibility of renal injury and a serum marker with improved potential to assess renal function. Nature Biotechnology 2010;28:486-494. doi:10.1038/nbt. 1627.
- Coca SG, Parikh CR. Urinary biomarkers for acute kidney injury: perspectives on translation. Clinical J American Society of Nephrology. 2008;2(3):481-490 DOI: 10.2215/cjn.03520807
- Thongboonkerd V, Chutipongtanate S, Kanlaya R. Systematic evaluation of sample preparation methods for gel-based human urinary proteomics: quantity, quality and variability. Journal of Proteome Research 2006;1(5):183-191 DOI: 10.1021/pr0502525
- Yoshida Y, Miyazaki K, Kamiie J, Sato M, Okuizumi S, Kenmochi A. et al. Two-dimensional electrophoretic profiling of normal human kidney glomerulus proteome and construction of an extensible markup language (XML)-based database. Proteomics 2005;4(5):1083-1096 DOI: 10.1002/pmic.200401075
- Merchant M, Klein JB. Proteomics and diabetic nephropathy. Seminars in Nephrology 2007;6(27):627-636 DOI: 10.1016/j.semnephrol.2007.09.003
- Алексеев А.В., Гильманов А.Ж., Гатиятуллина Р.С., Ракипов И.Г. Современные биомаркеры острого повреждения почек. Практическая медицина 2014;79(3):22-27.
- Вельков В.В., Резникова О.И. Новые возможности для лабораторной диагностики хронической и острой ренальной дисфункции. Научно-практический журнал «Клинико-лабораторный консилиум» 2011;39(3):26-30.
- Глыбочко П.В., Захарова Н.Б., Понукалин А.Н., Гражданов Р.А., Россоловский А.Н., Вараксин Н.А. и др. Диагностическое значение подъема уровня провоспалительных цитокинов в моче при обострении хронического калькулезного пиелонефрита. Саратовский научно-медицинский журнал 2011;7(S2):143.
- Новоселова О.В., Волынчик Е.П., Кононова С.В, Вельков В.В., Ми хайлов Ю.Е. Клиническое значение качественного и количественного анализа белкового состава мочи. Лаборатория 2006;1:7-9.
- Пролетов Я. Ю., Саганова Е. С., Галкина О. В. Роль некоторых биомаркеров в оценке характера хронического повреждения почек у пациентов с первичными гломерулопатиями. Нефрология 2013;1:60-69.
- Ребров А.П., Захарова Н.Б., Оксеньчук А.Н., Карпова О.Г., Патрикеева Д.А., Попыхова Э.Б. Диагностическое значение определения биомаркеров в сыворотке крови и моче больных системной красной волчанкой. Клиническая нефрология 2014;1:10-14.
- Сереженков А.В., Горелов А.И. Цитокиновый профиль крови пациентов с хроническим пиелонефритом. Здоровье -основа человеческого потенциала -проблемы и пути их решения 2013;8(1):510-512.
- Крайдашенко О.В., Долинная М.А. Роль биомаркеров в оценке характера повреждений почек у больных с гипертонической болезнью. Клиническая нефрология 2014;3:23-25.
- Decramer S. de Peredo AG, Breuil B, Mischak H, Monsarrat B, Bas-cands J. et al. Urine in clinical proteomics Molecular Ш Cellular Proteomics 2008;10(7):1850-1862 DOI: 10.1074/mcp.r800001-mcp200
- Gayathri Gopalan, Veena S. Rao,Vijay V. Kakkar. An overview of urinary proteomics applications in human diseases. International Journal of High Throughput Screening 2010;1:183-192 DOI: 10.2147/ijhts.s13129
- Николаев А.Ю. Анализ ведущих факторов прогрессирования хронической болезни почек. Нефрология и диализ 2011;13(4):396-400.
- Вельков В.В. Новые представления о диабетической нефропатии: гиперфильтрация, прерывистая микроальбуминурия, солевой парадокс. Медицинский алфавит 2013;3(16):18-36.
- Захарова Н.Б., Долгов А.Б., Иноземцева Н.Д., Блюмберг Б.И. Биомаркеры инфекционно -воспалительных заболеваний почек и мочевыводящих путей. Справочник заведующего КДЛ. 2013;2:48-59.
- Бобкова И.Н. Клиническое значение определения в моче маркеров эндотелиальной дисфункции и факторов ангиогенеза в оценке тубулоинтерстициального фиброза при хроническом гломерулонефрите. Терапевтический архив 2007;6:10-15.
- Вараксин Н.А., Захарова Н.Б., Понукалин А.Н., Россоловский A.Н., Рябичева Т.Г., Офицеров В.И. Цитокины и С-реактивный белок при первичном пиелонефрите: сравнение диагностической значимости концентрации в моче и сыворотке крови. Новости «Вектор-Бест» 2012;64(2):3-9.
- K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification and Stratification. Am J Kid Dis 2002;39 (suppl 1).
- Глыбочко П.В., Захарова Н.Б., Понукалин А.Н., Гражданов Р.А., Россоловский А.Н., Вараксин Н.А., Полозов А.Б., Блюмберг Б.И. Значение подъема уровня провоспалительных цитокинов в моче при обострении хронического калькулезного пиелонефрита. Уральский медицинский журнал 2011;6(84):121-123.
- Mischak H, Thongboonkerd V, Schanstra JP, Vlahou A. Renal and urinary proteomics. Proteomics -Clinical Applications 2011;5-6(5):211-213 DOI: 10.1002/prca.v5.5/6
- Thongboonkerd V. Study of diabetic nephropathy in the proteomic era. Contributions to Nephrology 2011;170:172-183 DOI: 10.1159/000325657
- Попков В.М., Долгов А.Б., Захарова Н.Б., Понукалин А.Н., Вараксин Н.А. Мочевые биомаркеры при остром пиелонефрите. Саратовский научно-медицинский журнал 2013;9(1):110-115.
- Морозов Д.А., Морозова О.Л., Захарова Н.Б., Лакомова Д.Ю. Патогенетические основы и современные проблемы диагностики хронического обструктивного пиелонефрита у детей. Урология 2013;2:129-134.
- Jungbauer CG, Birner C, Jung B, Buchner S, Lubnow M, von Bary C, et al. Kidney injury molecule-1 and N-acetyl-ß-D-glucosaminidase in chronic heart failure: possible biomarkers of cardiorenal s yndrome. European Journal of Heart Failure 2011;10(13):1104-1110 DOI: 10.1093/eurjhf/hfr102
- Ko GJ, Grigoryev DN, Linfert D, Jang HR, Watkins T, Cheadle C. et al. Transcriptional analysis of kidneys during repair from AKI reveals possible roles for NGAL and KIM-1 as biomarkers of AKI to CKD transition. Am J Physiol Renal Physiology 2010;6(298):1472-1483 DOI: 10.1152/ajprenal.00619.2009
- Nejat M, Pickering JW, Walker RJ, Endre ZH. Rapid detection of acute kidney injury by plasma cystatin C in the intensive care unit. Nephrology Dialysis Transplantation 2010;10(25):3283-3289 DOI: 10/1093/ndt/gfq176
- Белохвостикова Т.С., Орлова Г.М., Фатахова О.А. и др. Липокаин, ассоциированный с желатиназой нейтрофилов, у больных с хронической болезнью почек: клинико-лабораторные взаимосвязи. Нефрология и диализ 2011;13(3):268-269.
- Shen SJ, Hu ZX., Li QH, Wang SM, Song CJ, Wu DD. et al. Implications of the changes in serum neutrophil gelatinase-associated lipocalin and cystatin C in patients with chronic kidney disease. Nephrol (Carlton) 2014;3(19):29-35 DOI: 10.1111/nep.12203
- Zubowska M, Wyka K, Fendler W, Mlynarski W, Zalewska-Szewczyk B. Interleukin -18 as a Marker of Chronic Nephropathy in Children after Anticancer Treatment. Disease Markers 2013;35:811-818 DOI: 10.1155/2013/369784
- He JC, Chuang PY, Ma'ayan A, Iyengar R. Systems biology of kidney diseases. Kidney International 2012;1(81):22-39. doi:10.1038/ki.2011.314.
- Court M, Selevsek N, Matondo M, Allory Y, Garin J, Masselon CD et al., Toward a standardized urine proteome analysis methodology. Proteomics 2011;6(11):1160-1171 DOI: 10.1002/pmic.201000566
- Fiedler GM, Baumann S, Leichtle A. Standardized peptidome profiling of human urine by magnetic bead separation and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Clinical Chemistry 2007;3(53):421-428 DOI: 10.1373/clinchem.2006.077834
- Ishihama Y, Rappsilber J, Mann M. Modular stop and go extraction tips with stacked disks for parallel and multidimensional Peptide fractionation in proteomics. Journal Proteome Research 2006;4(5):988-994 DOI: 10.1021/pr050385q
- Агрон И.А., Автономов Д.М., Кононихин А.С., Попов И.А., Мошковский С.А., Николаев Е.Н. База данных по точным массововременным меткам для хромато-масс-спектрометрического анализ протеома мочи. Биохимия. 2010;75(4):598-605. doi: 10.1134/S0006297910050147
- Corzett TH, Fodor IK, Choi MW, Walsworth VL, Turteltaub KW, McCutchen-Maloney SL, et al. Statistical analysis of variation in the human plasma proteome. Journal of Biomedicine and Biotechnology 2010;2010:1-12 DOI: 10.1155/2010/258494
- Трифонова О. П. Оценка пластичности протеома плазмы крови здорового человека в экстремальных условиях жизнедеятельности: Автореф. дис. канд. биол. наук. Москва; 2011. Доступно по: http://medical-diss.com/docreader/348178/a#. Ссылка активна на 05.04.2017.
- Nagaraj N, D'Souza RC, Cox J, Olsen JV, Mann M. Feasibility of large-scale phosphoproteomics with higher energy collisional dissociation fragmentation. Journal of Proteome Research 2010;12(9):6786-6794 DOI: 10.1021/pr100637q
- Oh J, Pyo JH, Jo EH, Hwang SI, Kang SC, Jung JH. et al. Establishment of a near-standard two-dimensional human urine proteomic map. Proteomics 2004;11(4):3485-3497 DOI: 10.1002/pmic.200401018
- Larina IM, Pastushkova LKh, Tiys ES, Kireev KS, Kononikhin AS, Popov IA, et al. Permanent proteins in the urine of healthy humans during the mars-500 experiment. Journal of Bioinformatics and Computational Biology 2015;1(13):1540001 DOI: 10.1142/s0219720015400016
- Валеева О.А., Пастушкова Л.Х., Пахарукова Н.А., Доброхотов И.В., Ларина И.М. Вариабельность протеома мочи здорового человека в эксперименте с 105 суточной изоляцией в гермообъекте. Физиология человека 2011;37(3):351-354 DOI: 10.1134/s0362119711030157
- Miyamoto M, Yoshida Y, Taguchi I, Nagasaka Y, Tasaki M, Zhang Y. et al. In-depth proteomic profiling of the normal human kidney glomerulus using two-dimensional protein prefractionation in combination with liquid chromatography-tandem mass spectrometry. Journal of Proteome Research 2007;9(6):3680-3690 DOI: 10.1021/pr070203n
- Smith MP, Banks RE, Wood SL, Lewington AJP, Selby PJ. Application of proteomic analysis to the study of renal diseases. Nature Reviews Nephrology 2009; 12(5):701-712 DOI: 10.1038/nrneph.2009.183
- Mischak H, Rossing P. Proteomic biomarkers in diabetic nephropathyreality or future promise? Nephrol Dial Transplant 2010;9(25):2843-2845 DOI: 10.1093/ndt/gfq363
- Kutina AV, Natochin IuV. An increase in the secretion of total protein and albumin by the human kidney during water diuresis. Human Physiology 2009;5(35):612-615 DOI: 10.1134/s0362119709050144
- Marina AS, Kutina AV, Natochin IuV. Physiological analysis of various types of osmotic diuresis. Ross. Fiziol Zh Im I. M. Sechenova 2011;97(12):1309-1318. doi:
- Polkinghorne KR. Detection and measurement of urinary protein. Current Opinion in Nephrology and Hypertension 2006;6(15):625-630 DOI: 10.1097/01.mnh.0000247502.49044.10


