Активация биокаталитических свойств коллагеназы, предназначенной для применения в технологии мясопродуктов
Автор: Тихонов Сергей Леонидович, Брашко Иван Сергеевич, Тихонова Наталья Валерьевна, Тихонова Мария Сергеевна, Мотовилов Олег Константинович
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 12, 2020 года.
Бесплатный доступ
Цель исследований - изучение влияния света синего спектра на биокаталитическую активность и стабильность фермента коллагеназы. Исследовано влияние света синего спектра с мощностью светового потока 35 мкВт/см2 на биокаталитическую активность фермента протеолитического назначения при изменении температуры, рН, концентрации поваренной соли и нитрита натрия в субстрате. В качестве объекта исследований использован стерильный мелкодисперсный порошок коллагеназы первого типа, продуцируемой культурой Clostridium histolyticum. Для эксперимента сформированы две группы образцов фермента коллагеназы - контрольная и опытная. Образцы коллагеназы опытной группы обрабатывали светом синего спектра с мощностью светового потока 35 мкВт/см2 с помощью биолампы на протяжении 50-60 минут. Исследования проведены на кафедре пищевой инженерии Уральского государственного экономического университета (г.Екатеринбург). Установлено, что обработка раствора коллагеназы светом с длиной волны 420-450 нм и мощностью светового потока 35 мкВт/см2 расширяет оптимум активности в диапазоне рН от 7 до 8 и температуры от 28 до 54 °С. Активность фермента, обработанного синим светом, выше на 19,7 %. В результате исследований по ингибированию каталитической активности коллагеназы в присутствии компонентов посолочных смесей (поваренной соли и нитрита натрия) установлено, что с увеличением концентрации поваренной соли в субстрате (желатин) активность фермента существенно снижается. У обработанного фермента синим светом выше на 33 %. Доказано, что нитрит натрия, присутствующий в субстрате в концентрациях от 0,1 до 0,7 ммоль/дм3, снижает активность фермента до 46 %. Обработка фермента коллагеназы светом синего спектра с мощностью светового потока 35 мкВт/см2 в течение 50-60 минут способствует ослаблению отрицательного влияния компонентов посолочной смеси для мяса.
Фермент, активность, посол, поваренная соль, нитрит натрия
Короткий адрес: https://sciup.org/140250588
IDR: 140250588 | УДК: 637.5 | DOI: 10.36718/1819-4036-2020-12-184-194
Текст научной статьи Активация биокаталитических свойств коллагеназы, предназначенной для применения в технологии мясопродуктов
Sergey L. Tikhonov
Ural State Economic University, head of the chair of food engineering, doctor of technical sciences, professor, Russia, Ekaterinburg
Ivan S. Brashko
Ural State Economic University, post-graduate student of the chair of food engineering, Russia, Ekaterinburg
Natalya V. Tikhonova
Ural State Economic University, professor of the chair of food engineering, doctor of technical sciences, professor, Russia, Ekaterinburg
Ural State Economic University, a student of the 2-nd course, Russia, Ekaterinburg
Oleg K. Motovilov
Siberian Research and Development Institute of Technology Institute of agricultural production processing of Siberian Federal Research Center of Agrobiotechnologies RAS, head, doctor of technical sciences, associate professor, Russia, Novosibirsk Region, Novosibirsk area, s. Krasnoobsk
THE ACTIVATION OF BIOCATALYTIC PROPERTIES OF COLLAGENASEINTENDED FOR USING IN MEAT TECHNOLOGY
The purpose of the researches was studying the influence of light of a blue range on biocatalytic activity and the stability of collagenase enzyme. The influence of light of a blue range with a power of light stream of 35 mW/cm2 biocatalytic activity of enzyme of proteolytic appointment at the change of temperature, pH, the concentration of table salt and nitrite of sodium in the substratum was investigated. Sterile fine powder of collagenase type 1 produced by Clostridium histolyticum culture was used as the object of research. Two groups of collagenase enzyme samples were formed for the experiment: a control group and an experimental group. Collagenase samples of experimental group were treated with blue light with a luminous flux of 35 mW/cm2 using a biolamp for 50–60 minutes. The researches were conducted on the department of food engineering of the Ural State Economic University (Ekaterinburg). It was established that collagenase solution processing by light with the wavelength of 420–450 nanometers and light stream 35 mW/cm2 had expanded the optimum activity in the pH range pH from 7 to 8 and temperature from 28 to 54 °C. The activity of the enzyme treated with blue light is 19.7 % higher. As a result of the studies on the inhibition of catalytic activity of collagenase in the presence of components of brine mix (salt and sodium nitrite) it was found that with increasing concentration of salt in substrate (gelatin) enzyme activity significantly decreased. Blue-light treatment was 33 % higher. It was proved that sodium nitrite present in the substrate at concentrations of 0.1 to 0.7 mmol/dm3 reduced the activity of the enzyme by up to 46 %. The treatment of collagenase enzyme with blue light with luminous flux of 35 mW/cm2 for 50–60 minutes helped to reduce negative effect of the components of the salting mixture for meat.
Введение. Применение ферментов и ферментных препаратов на их основе в технологии мясопродуктов способствует увеличению выхо- да, биологической ценности и усвояемости готовой пищевой продукции [13, 26].
Для обработки мясного сырья с высоким содержанием коллагена применяются щелочные протеазы, полученные путем культивирования микроорганизмов Bacillus licheniformis и Acremonium chrysogenum. Эффективность использования указанных протеаз в производстве мясопродуктов связано с их гидролитическими свойствами и активностью, сохраняющимися на технологических этапах производства мясопродуктов с учетом реакции среды и термической обработки сырья [8]. Большинство протеолиоти-ческих ферментов гидролизируют миофибриляр-ные белки, а коллагеновые белки в меньшей степени. Высокая биокаталитическая активность в отношении гидролиза коллагена характерна для коллагеназы, что связано с макроструктурой белка коллагена, образованной тройной спиралью трипетида, в частности глицином, пролином и его остатком или гидроксипролином. Коллагеназа позволяет расщеплять тройную спираль коллагена [17, 18, 23, 25] путем разрыва связи между глицином и пролином, характеризующую последовательность аминокислот в коллагенном белке [16]. Следовательно, коллаген может являться только субстратом для коллагеназы как для специфического фермента.
Коллагеназу получают путем культивирования патогенного микроорганизма Clostridium histolyticum и Vibrio alginolyticus [15].
Аминокислотную последовательность в ферменте коллагеназа определяет связь двух гистидиновых цинковых лиганд – специфический HEXXH-мотив [19]. Но вместе с тем ограниченность использования штаммов бактерий в качестве продуцентов коллагеназы связана с активной выработкой и других ферментов, что приводит к сложности выделения необходимого фермента.
Авторами [11] разработана технология чистой коллагеназы как продукта метаболизма бактерии Clostridium hystolyticum. Достоинство технологии заключается в высокой степени очистки фермента, но вместе с тем увеличивается стоимость полученного фермента, что не позволяет его широко использовать в пищевой промышленности. Разработаны доступные технологии получения коллагеназы из млекопитающих и ракообразных [24], продуктов переработки рыбы [14], различных грибов и бактерий, в том числе рекомбинантных [10].
Бактериальные коллагеназы отличаются высокой специфичностью в сравнении с эукариотическими и могут гидролизовать как исходный, так и коагулированный коллаген [7, 22]. Фермент коллагеназу получают путем культивирования бактерий на питательных средах, содержащих мясопептонный бульон. Следует заметить, что отмечается тенденция замены питательных сред на основе мясного сырья альтернативными – растительными [12, 20]. Разработан ряд технологий культивирования бактерий для получения коллагеназ на растительных пептонах [21, 22].
В России на предприятии ЗАО «Завод эндокринных ферментов» (Московская область) и ЗАО «Биопрогресс» (г. Щелково) разработана технология производства коллагеназы из гепатопанкреаса камчатского краба. Коллагеназа российского производства успешно используется в технологиях колбасных изделий, полуфабрикатов и для гидролиза коллагенового сырья. В Воронежском государственном технологическом университете разработаны копченые колбасные изделия с использованием в рецептуре коллагеназы путем ее введения на стадии посола мясного сырья из расчета 1000 мг ферментного препарата коллагеназы на 1 кг сырья и временем обработки в течение 4 часов [1].
Актуальным направлением исследований в пищевой промышленности является разработка способов, позволяющих усилить активность ферментов.
Активность и стабильность ферментов зависят от условий внешней среды, в первую очередь от температуры, рН и других факторов [5].
Исследованиями [4] установлено, что γ-облучение семян ячменя дозами от 8 до 50 г усиливает активность каталазы, пируваткиназы, глюкозо-6-фосфатдегидрогеназы и гваяколовой пероксидазы. Авторами [3] доказано положительное влияние электромагнитного излучения на активность протеолитических ферментов. Полученные данные согласуются с результатами исследований [6], доказывающих, что активность протеолитических ферментов в проростках гречихи посевной под влиянием режимов низкоинтенсивного электромагнитного излучения (ЭМИ) возрастает. Особое внимание заслу- живает влияние поглощенных квантов видимого света биологическим веществом на способы реализации поглощенной энергии в развитии химических реакций. Вместе с тем существенное значение имеют спектр, интенсивность светового потока и время экспозиции. Доказано, что воздействие коротковолновых оптических излучений (410–520 нм) с интенсивностью 0,12– 0,20 Вт/м2 приводит к значительной активации алкогольдегидрогеназы, изоцитратдегидрогеназы, сукцинатдегидрогеназы, альдегидцегидро-геназы [9].
Цель исследований . Изучение влияния света синего спектра на биокаталитическую активность и стабильность фермента коллагеназа.
Объект исследований – коллагеназа 1-го типа, продуцируемая культурой Clostridium histolyticum (оптимум активности 37-45 ° С, рН -6–9 – по данным производителя).
Материалы и методы исследований . Исследуемый объект представляет стерильный мелкодисперсный порошок белого цвета с активностью 125 ед/мг. Для эксперимента сформировали две группы образцов фермента коллагеназы. Первая группа контрольная (фермент светом не обрабатывали), вторая группа опытная – коллагеназу обрабатывали светом синего спектра (420–450 нм) с мощностью светового потока 35 мкВт/см2 с помощью биолампы «Аверс-сан» производства ЗАО «НПК «Аверс» (г. Москва) в течение 50–60 минут. Исследования проведены на кафедре пищевой инженерии Уральского государственного экономического университета (г. Екатеринбург).
Активность фермента определяли методом Ансона [2] и экспресс-методом [7], заключающимся в гидролизе желатина раствором коллагеназы. В указанной методике предлагается исследовать активность фермента при температуре 37 °С, но данная температура приводит к потере структуры желатина, что не позволяет точно определить активность фермента. В связи с этим активность коллагеназы определяли при температуре 24 °С. Согласно методике, предварительно нами был приготовлен раствор коллагеназы в дистиллированной воде в соотношении 1:10, 1:20, 1:30 и т.д. Для определения активности капли полученные растворы наносили на желатиновую пленку и оставляли на 5– 10 минут, смывали проточной водой и визуально наблюдали участки растворения желатина в местах нанесения растворов. Активность коллагеназы оценивали по гидролизу желатина в единицах, например: если фермент расщепляет желатин в разведении 1:320, то его активность составляет 320 ед. Единицей измерения протеолитической активности фермента по методике Ансона является ед/г.
Результаты исследований и их обсуждение. Биокаталитическая активность ферментов зависит от рН среды, в которой протекает химическая реакция. Для каждого фермента характерно индивидуальное значение рН, при которой отмечается его максимальная активность. При отклонении от оптимального значения рН скорость ферментативной реакции снижается. Это объясняется тем, что активность фермента связана с изменением ионизации функциональных аминокислотных остатков молекулы белка. Например, при сдвиге реакции среды в кислую сторону от оптимального значения происходит протонирование свободных аминогрупп, что обуславливает изменение конформации активного центра фермента, соответственно замедляет присоединение субстрата и может изменить специфичность фермента. Так, при значительном изменении рН происходит денатурация фермента и потеря его биокаталитической активности. Проведены исследования по влиянию рН на активность фермента коллагеназы при температурном оптимуме 42 ° С.
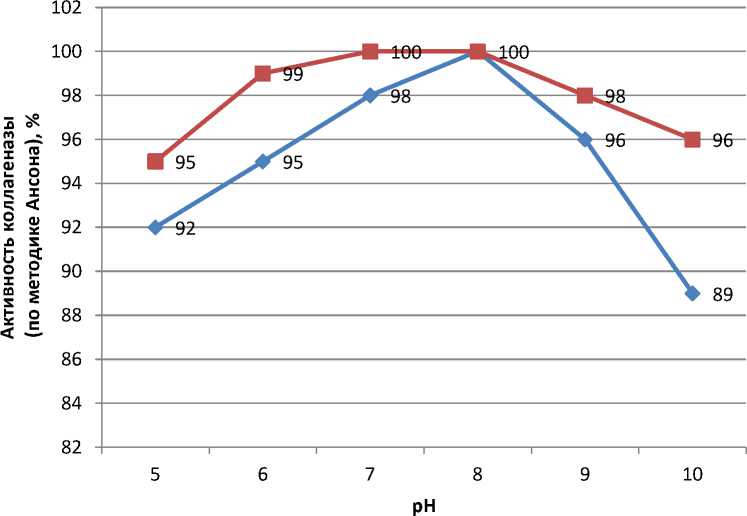
контроль опыт
Рис. 1. Влияние рН на активность фермента коллагеназы контрольных и опытных образцов при температуре 42 °C, %
Из рисунка 1 следует что, активность фермента, обработанного синим светом, имеет более широкий оптимум рН. Так, 100%-я активность у опытных образцов фермента отмечается при рН в диапазоне от 7 до 8, является высокой (95 %) при рН от 5 до 10. В то время как максимальная активность контрольных образцов фермента отмечается при рН, равной 8.
При исследовании активности ферментов по методике [7] установлено, что активность опытных образцов фермента при температуре 42 ° С отмечается при разведении 1:320, в то время как у контрольных образцов 1:270. Полученные данные согласуются с результатами исследований активности фермента по методике [2], при использовании которой установлено, что наибольшая активность отмечена у образцов фермента опытной группы – 147000 ед/г и выше, чем у контрольных образцов (118000 ед/г), на 19,7 %.
Получены аналогичные результаты по влиянию рН на активность фермента, определенной по методике Л.Я. Телишевской (рис. 2).
Оптимум активности опытных образцов коллагеназы отмечается при pH, близкой к нейтральной (от 7 до 8), при сдвиге рН в щелочную сторону снижается до 96 %, в то время как активность контрольных образцов фермента – 89 %.
Повышение температуры до определенных пределов увеличивает скорость любой химической реакции. Так как с повышением температуры увеличивается скорость движения молекул и, соответственно, взаимодействие химических веществ, ускоряется скорость реакции. Но для реакции с участием фермента-катализатора характерен температурный оптимум, при превышении которого происходит денатурация активного центра фермента.
На рисунке 3 представлено влияние температуры на активность фермента при установленном нами оптимуме рН – 8.
о
о
05 I ф I— 05
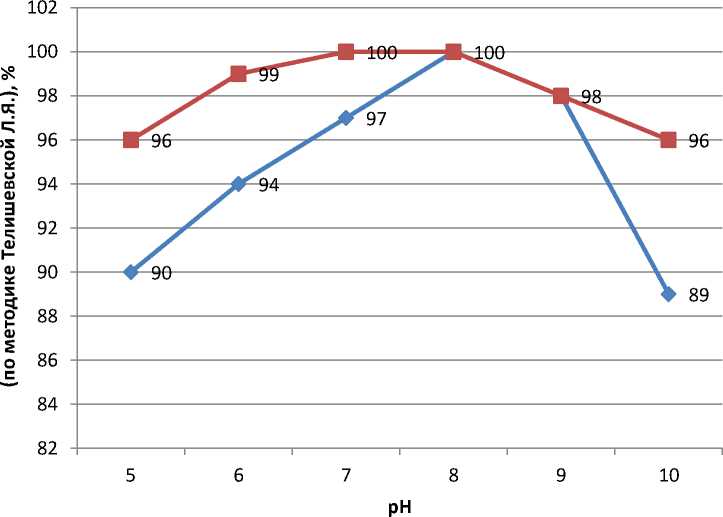
опыт
Рис. 2. Влияние рН на активность контрольных и опытных образцов фермента коллагеназы при температуре 42 °C, %
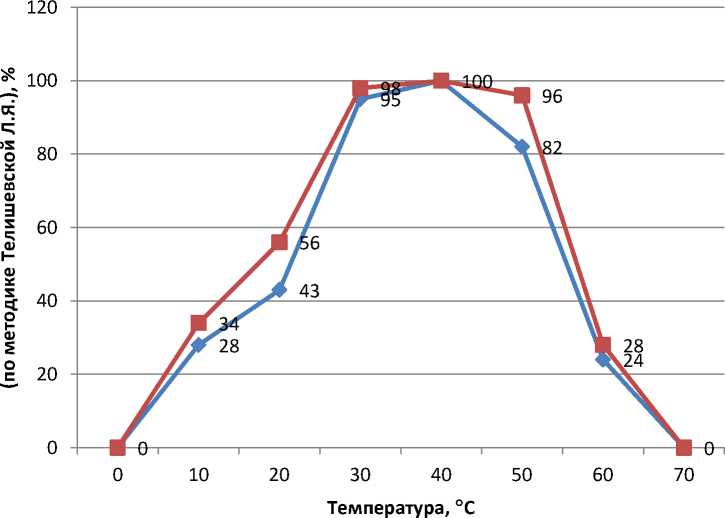
контроль
опыт
Рис. 3. Влияние температуры на активность контрольных и опытных образцов фермента коллагеназы при оптимуме рН 8
Установлено, что оптимум каталитической активности контрольных образцов коллагеназы находится при температурном режиме от 35 до 45 ° С, в то время как у опытных образцов фермента температурный оптимум составил от 28 до 54 ° С.
Таким образом, облучение раствора с ферментом светом синего спектра с мощностью светового потока 35 мкВт/см2 в течение 50–60 минут расширяет оптимум биокаталитической активности фермента коллагеназы, что подтверждается исследованиями с помощью двух альтернативных методик.
Полученные данные согласуются с информацией производителя фермента коллагеназы (фирма «Пан-Эко»): оптимальная активность при рН от 6,0-9,0 и температура от 37 до 45 ° С.
Проведены исследования по ингибированию каталитической активности коллагеназы в присутствии компонентов посолочных смесей (поваренной соли и нитрита натрия). Активность фермента определяли по методу Ансона путем нанесения на субстрат (желатин), приготовленный на 0,5–4,0%-м растворе поваренной соли.
Динамика активности фермента представлена на рисунке 4.
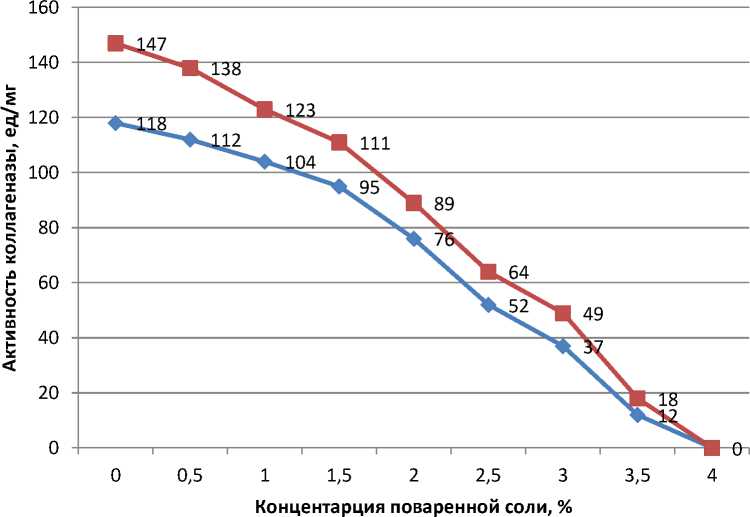
контроль
опыт
Рис. 4. Влияние на активность контрольных и опытных образцов фермента коллагеназы поваренной соли при оптимуме рН 8 и температуре 41 °C, %
Из полученных данных следует, что поваренная соль является неконкурентным ингибитором реакции расщепления желатина и взаимодействует с ферментом или с субстратом. Присутствие поваренной соли в растворе с ферментом изменяет конформацию его молекулы путем влияния на степень ионизации фермента, что приводит к снижению его активности.
Начальная активность образцов ферментов составляет 125 ед/мг, с увеличением концентрации поваренной соли в субстрате (желатин) существенно снижается. Следует отметить, что у образцов фермента опытной группы активность выше. Так, в опытной группе активность фермента при концентрациях поваренной соли 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 и 3,5 на уровне 138, 123, 111, 89, 64, 49, 18 ед/мг, в контрольных образцах фермента составляет, 112, 104, 95, 76, 52, 37 и 12 ед/мг соответственно.
Таким образом, активность опытных образцов фермента коллагеназы при воздействии поваренной соли в концентрациях до 4 % выше на 10–20 %.
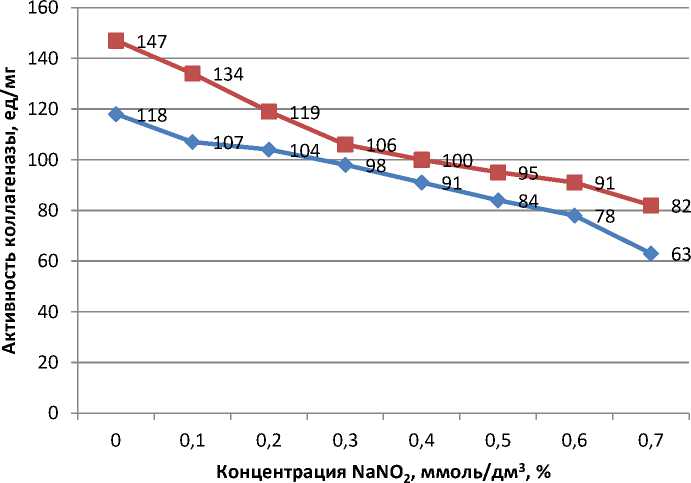
контроль
опыт
Рис. 5. Влияние нитрита натрия на активность контрольных и опытных образцов фермента коллагеназы при оптимуме рН 8 и температуре 41 °C, %
Нитрит натрия, присутствующий в субстрате в концентрации до 0,7 ммоль/дм3, снижает активность фермента в контрольных образцах на 46,6 %, в опытных – 44,2 %. Следовательно, обработка фермента коллагеназы светом синего спектра с мощностью светового потока 35 мкВт/см2 в течение 50–60 минут позволяет расширить оптимум его активности и ослабляет отрицательное действие химических веществ (поваренная соль, нитрит натрия) посолочной смеси.
Заключение. В результате исследований доказано, что обработка раствора коллагеназы светом с длиной волны 420–450 нм и мощностью светового потока 35 мкВт/см2 расширяет оптимум активности в диапазоне рН от 7 до 8 и температуры от 28 до 54 °С. Активность фермента, обработанного синим светом, выше на 19,7 %. В результате исследований по ингибированию каталитической активности коллагеназы в присутствии компонентов посолочных смесей (поваренной соли и нитрита натрия) установлено, что с увеличением концентрации поваренной соли в субстрате (желатин) активность фермента существенно снижается. У обработанной синим светом выше на 33 %. Доказано, что нитрит натрия, присутствующий в субстрате в концентрациях от 0,1 до 0,7 ммоль/дм3, снижает активность фермента до 46 %. Обработка фермента коллагена- зы светом синего спектра с мощностью светового потока 35 мкВт/см2 в течение 50–60 минут способствует ослаблению отрицательного влияния компонентов посолочной смеси для мяса.
Список литературы Активация биокаталитических свойств коллагеназы, предназначенной для применения в технологии мясопродуктов
- Антипова Л.В., Подвигина Ю.Н., Косенко И.С. Применение ферментных препаратов в технологии производства мясных изделий // Современные проблемы науки и образования. 2008. № 6. С. 134-135.
- Апраксина С.К. Разработка технологии белкового продукта из коллагенсодержащего сырья и его использование в производстве вареных колбасных изделий: дис.... канд. техн. наук: 05.18.04. М.: МГАПБ, 1996. 160 с.
- Беденко О.А., Косоголова Л.А., Решетняк Л.Р. [и др.]. Влияние физических методов обработки на активность протеолитических ферментов a. Oryzae // Проблеми екологiчної бiотехнологiї. 2014. № 2. С. 128-136.
- Волкова П.Ю., Чурюкин Р.С., Гераськин С.А. Влияние γ-облучения семян на активность ферментов в проростках ячменя // Радиационная биология. Радиоэкология. 2016. Т. 56. № 2. С. 190.
- Голета М.В. Влияние физических факторов и pH среды на активность амилолитических и протеолитических ферментов при производстве солода // Биотехнология: достижения и перспективы развития: мат-лы II междунар. науч.-практ. конф. / Полесский государственный университет. Пинск, 2017. С. 5-6.
- Мазец Ж.Э., Калацкая Ж.Н., Суша О.А. Влияние низкоинтенсивного электромагнитного излучения на ростовые процессы и активность протеолитических ферментов в проростках гречихи обыкновенной // Вестник Гжельского государственного университета. 2018. № 6. С. 46-53.
- Руденская Г.Н., Можина Н.В. Коллагенолитические ферменты патогенных микроорганизмов // Биомедицинская химия. 2004. № 6. С. 539-553.
- Телишевская Л.Я. Белковые гидролизаты. Получение, состав, применение. М.: Аграрная наука, 2000. С. 90-91.
- Титов Е.И., Литвинова Е.В., Кидяев С.Н. [и др.]. О микроструктуре коллагенсодержащего сырья, модифицированного щелочными протеиназами // Мясная индустрия. 2017. № 8. С. 36-38.
- Шабурова Г.В. Интенсификация производства пива путем фотостимуляции метаболизма дрожжей: дис.... канд. техн. наук. М., 1984. 183 с.
- Alipour H., Raz A., Djadid N.D. et al. Codon optimization of Col H gene encoding Clostridium histolyticum collagenase to express in Escherichia coli // PeerJPrePrints. 2014.
- Brazzelli M., Cruickshank M., Tassie E., McNamee P., Robertson C., Elders A. et al. Collagenase clostridium histolyticum for the treatment of Dupuytren's contracture: systematic review and economic evaluation // Health Technol. Assess. 2015. Vol. 19, N 90. P. 201-202.
- Certificate of Origin Policy (TSE/BSE) 01-000-014 Rev. 1 Effective Date: August 3, 2005 // Sigma-Aldrich.
- Chanalia P., Gandhi D., Attri P., Dhanda S. Extraction, purifi cation and characterization of low molecular weight Proline iminopeptidase from probiotic L. plantarum for meat tenderization // Int. J. Biol. Macromol. 2018. Vol. 109. P. 651-663.
- Daboor S.M., Budge S.M., Ghaly A.E. et al. Isolation and activation of collagenase from fish processing waste// Advances in Bioscience and Biotechnology. 2012. Vol. 3. P. 191-203.
- Eckhard U., Huesgen P.F., Brandstetter H., Overall C.M. Proteomic protease specificity profiling of clostridial collagenases reveals their intrinsic nature as dedicated degraders of collagen // J. Proteomics. 2014. Vol. 100. P. 102-114.
- Eckhard U., Schönauer E., Brandstetter H. Structural basis for activity regulation and substrate preference of clostridial collagenases G, H, and T // J. Biol. Chem. 2013. Vol. 288. P. 20 184-20194.
- EguiRojo M.A., Moncada Iribarren I., Carballido Rodriguez J., Martinez-Salamanca J.I. Experience in the use of collagenase Clostridium histolyticum in the management of Peyronie's disease: current data and future prospects // Therapeutic Advances in Urology. 2014. Vol. 6. No. 5. P. 192-197.
- Murphy A., Lalonde D.H., Eaton C. et al. Minimally invasive options in Dupuytren's contracture: aponeurotomy, enzymes, stretching, and fat grafting // Plastic and Reconstructive Surgery. 2014. Vol. 134. No. 5. P. 822-829.
- Nezafat N., Negahdaripour M., Gholami A., Younes G. Computational analysis of collagenase from different Vibrio, Clostridium and Bacillus strains to find new enzyme sources // Trends Pharm. Sci. 2015. Vol. 1, № 4. P. 213-222.
- Note for guidance on minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products (EMA/410/01 rev.3) // Official Journal of the European Union. 5 March 2011.
- Pat. US 20120237497 A1 Compositions and methods for producing clostridial collagenases / T.L. Wegman, Bo Yu. 20 September 2012.
- Pat. WO 2013177647 A1 Meio de cultura para bactérias do gênero clostridium livre de componentes de origem animal e processo para produção de sobrenadantecontendouma-oumais proteases com atividadecolagenolítica e gelatinolítica / M.C. Alegria, L.C. Fardelone, M.B.R. Delalana, J.E. Thiemann, F.S. Astolfi, R.C.D. Moreira, O. De Castro Pacheco. 5 December 2013.
- Schulze S.M., Tursi J.P. Postapproval clinical experience in the treatment of Dupuytren's contracture with collagenase clostridium histolyticum (CCH): the first 1,000 days // Hand (NY). 2014. Vol. 9. No. 4. P. 447-458.
- Souchet N., Laplante S. Recovery and characterization of a serine collagenolytic extract from snow crab (Chionoecetesopilio) byproducts // Applied Biochemistry and Biotechnology. 2011. Vol. 163. P. 765-779.
- Van Doren S.R. Matrix metalloproteinase interactions with collagen and elastin // Matrix Biology. 2015. Vol. 44-46. P. 224-231.


