Анализ свободных легких цепей иммуноглобулинов сыворотки крови у больных хроническим лимфолейкозом в процессе химиоиммунотерапии
Автор: Голенков А.К., Клинушкина Е.Ф., Катаева Е.В., Чуксина Ю.Ю., Митина Т.А., Трифонова Е.В., Захаров С.Г., Высоцкая Л.Л., Черных Ю.Б., Белоусов К.А., Савин А.О., Марьина С.А., Когарко И.Н., Когарко Б.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Современная химиоиммунотерапия (ХИТ) хронического лимфолейкоза (ХЛЛ) постоянно совершенствуется, что требует изучения дополнительных методов оценки ее эффективности. Существующий иммунофенотипический метод позволяет определять минимальную остаточную болезнь (МОБ) с точностью <0,01% опухолевых клеток, что обозначается как неизмеряемая остаточная болезнь (НМОБ). Показано, что достижение НМОБ улучшает отдаленные результаты лечения. Идея предпринятой работы заключается в том, что при достижении НМОБ часть опухолевых клеток может остаться in situ за счет их адгезивных свойств, в то время как синтез свободных легких цепей (СЛЦ) опухолевыми клетками позволяет определить их в крови
Хронический лимфолейкоз, свободные легкие цепи, иммунофенотип, химио-иммунотерапия
Короткий адрес: https://sciup.org/170175828
IDR: 170175828
Текст научной статьи Анализ свободных легких цепей иммуноглобулинов сыворотки крови у больных хроническим лимфолейкозом в процессе химиоиммунотерапии
Введение. Проблема химиоиммунотерапии (ХИТ) хронического лимфолейкоза (ХЛЛ) получила свое широкое развитие с момента опубликования работы [1], показавшей клиническое преимущество комбинации противоопухолевых препаратов флударабин, циклофосфан, ритуксимаб (FCR) в сравнении с флударабином и циклофосфаном (FС). Дальнейшее совершенствование программ лечения ХЛЛ было связано с синтезом новых противоопухолевых препаратов, действие которых было направлено на ключевые сигнальные пути, обеспечивающие функцию опухолевых клеток.
К ним относятся ингибитор брутонтирозин-киназы ибрутиниб (ибр.), ингибитор BCL-2 вене-токлакс, ингибитор PI3K – иделалисиб и новые генерации моноклональных антител к CD20. Оценивая в целом современный иммунохимиотера-певтический потенциал ХЛЛ, следует отметить его высокую противоопухолевую избирательность. В свою очередь, это требует совершенствования оценочных систем лечения, которые необходимы для сравнительного анализа эффективности новых лекарственных препаратов, а также для установления причинной связи между минимальной остаточной болезнью (МОБ) и отдаленными результатами лечения.
Это положение подтверждается опубликованными работами, показавшими что МОБ является независимым прогностическим фактором выживаемости без прогрессии (ВБП) и общей выживаемости (ОВ) [2]. Высокая воспроизводимость результатов, указывающих на связь МОБ и ОВ и ВБП, была получена при использовании иммунофено-типического анализа с повышенной разрешающей способностью [3]. При чувствительности <0,01% опухолевых клеток (неизмеряемая МОБ – НМОБ) эта закономерность сохраняется для стандарт- the method of analysis of variance.
Results. It was found that in 32 out of 50 studied patients, the FLC clone (64%) was established in the blood serum. No FLC changes were found in 18 clonal changes (18%). When studying the phenotype of the FLC clone in 32 patients, и-type was determined in 26 (81.3%), λ-type in 6 (18.7%). Conducting HIT according to FCR programs. BR, ibrutinib proportionally reduced the concentration of tumor FLC and, to a lesser extent, FLC of physiological antibody producers. In 30% of cases, upon reaching IMOB, the concentration of FLC and the и /Л ratio had a tumor character.
ных и инновационных программ лечения. Более точным местом для установления НМОБ является костный мозг, так как там реже достигается НМОБ, чем в периферической крови [4], что, по-видимому, связано с адгезивностью опухолевых лимфоцитов [5]. Этот факт подтверждает точку зрения о том, что топографическая ассиметрия распространения опухолевых лимфоцитов при ХЛЛ, обусловленная адгезивными свойствами, может создавать условия для функционирования остаточной опухоли in situ [6]. При этом опухолевые клетки не выходят в циркуляцию, что может искажать результаты НМОБ. В этой связи следует отметить, что СЛЦ не связаны с клеточной адгезией и могут быть определены в циркуляции, независимо от адгезивных свойств опухоли. Важно отметить, что продукция свободных легких цепей (СЛЦ) иммуноглобулинов сыворотки крови доказана у большинства больных ХЛЛ [7, 8]. Поэтому в группе больных СЛЦ(+) ХЛЛ методом определения СЛЦ (Free Light) можно визуализировать остаточную болезнь in situ в случаях НМОБ и более точно прогнозировать отдаленные результаты лечения.
Методы исследования. Исследовано 50 больных ХЛЛ, мужчин 31, женщин 19, в возрасте 61 год (30-76). Впервые выявленный ХЛЛ диагностирован у 20, фаза прогрессии или рецидива установлена у 23, состояние полной (ПО) или частичной (ЧО) ремиссии было у 7 больных. У 11 больных исследование СЛЦ проводили в динамике до и после проведенных только программ ИХТ FCR, BR (бен-дамустин и ритуксимаб) или в сочетании с ибру-тинибом (BR+ибрутиниб). Диагноз заболевания устанавливали в соответствии с существующими рекомендациями [9, 10]. Стадию болезни устанавливали согласно критериям Rai. Эффективность лечения оценивали по критериям международной рабочей группы по ХЛЛ (IWCLL) [11]. Иммунофе-нотипирование лимфоцитов крови проводили методом проточной цитофлуориметрии (2-лазерный проточный цитометр “Facs Calibur”, США) с использованием панели моноклональных антител “Becton Dickinson”. Определяли экспрессию CD45; CD19; CD20; CD22; CD79b; CD5; CD23; CD43; CD200; CD25; CD38, а также экспрессию легких цепей к и Л. Оценку МОБ проводили методом 4-х цветной проточной цитофлуориметрии по международному стандартизованному протоколу для мониторинга МОБ ХЛЛ и в модификации European Research Initiative in CLL (ERIC) [12].
Концентрацию СЛЦ сыворотки крови определяли на иммунохимическом анализаторе Immage
800 “Beckman Coulter”, США. В качестве реактивов использовали поликлональные антисыворотки к к и λ СЛЦ (Binding Site, Англия). Всем больным проводили стандартные клинические исследования, принятые в гематологическом стационаре. При статистической обработке результатов использовали метод дисперсионного анализа.
Результаты. Данные полученных концентраций СЛЦ анализировали вместе с клиническими данными на момент исследования СЛЦ в связи с результатами проведенной ХИТ. При анализе результатов установлено, что из 50 обследованных больных ХЛЛ СЛЦ клон был установлен у 32 (64%). (таблица 1).
Таблица 1
Подгруппы больных с ХЛЛ в зависимости от наличия клона свободных легких цепей иммуноглобулинов сыворотки крови
|
Число больных |
СЛЦ клон* |
||||
|
есть |
% |
нет |
% |
||
|
к |
λ |
||||
|
50 |
26 |
6 |
64 |
18 |
36 |
|
32 |
|||||
* к/Л отношение 0.6 (0.26-1.65)
У большинства больных (26 из 32) клон СЛЦ был фенотипа к (81.3%). Опухолевый клон, секретирующий СЛЦ λ-типа был установлен у 6 из 32 больных (18.7%). Это очень важное положение свидетельствует о том, что у большинства больных с ХЛЛ опухолевые клетки секретируют СЛЦ. Это согласуется с ранее опубликованными на-
Таблица 2
Изменение концентраций к и Л СЛЦ у 18 больных с СЛЦ (-) ХЛЛ
|
Число больных |
СЛЦ мг/л |
||
|
к |
λ |
к /Л |
|
|
9 |
↑ |
↑ |
0,30-1,59 |
|
7 |
↑ |
↓ |
|
|
2 |
↓ |
↓ |
|
|
Нормальные значения |
7,3 (3,3-19,4) |
12,7 (5,7-26,3) |
0,6 (0,26-1,65) |
Из данных таблицы 2 видно, что у 9 больных концентрации к и Л СЛЦ были повышены (поликлональный характер изменений). У 7 больных концентрация цепи к была повышена, а Л-цепи была снижена. В 2 наблюдениях концентрации к и λ СЛЦ были снижены. Причем в некоторых наблюдениях к/Л соотношения выходили за пределы нормальных значений, но они не сопровождались повышением концентрации одной из СЛЦ, а нао блюдениями [7, 8].
При анализе полученных результатов у 18 больных где не было установлено клональных изменений концентраций СЛЦ (к/Л отношение в пределах нормы – 0.30-1.59) данные имели разнонаправленный характер.
борот сопровождались избирательным снижением концентрации одной из них. По-видимому, это следует расценивать как дизрегуляцию в системе антителопродуцентов при ХЛЛ.
Следующим этапом анализа полученных результатов было изучение концентрации СЛЦ у 32 первичных и предлеченных больных ХЛЛ с клональной секрецией СЛЦ.
Таблица 3Концентрация СЛЦ у 32 первичных и предлеченных СЛЦ (+) больных ХЛЛ
|
Количество больных |
Опухолевый клон и -типа |
Опухолевый клон λ-типа |
Предлеченность |
|||||
|
32 и -26 λ -6 |
СЛЦ и |
СЛЦ λ |
и /А |
СЛЦ и |
СЛЦ λ |
и /А |
||
|
75,8 мг/л (16,7-700) |
10,1 (мг/л) (5,7-26,3) |
7,5 |
1,59 мг/л (1,12-2,58) |
12,4 мг/л (7,5-169) |
0,12 |
и 14/26 53,8% |
λ 4/6 66% |
|
|
Нормальные значения |
и 7,3 мг/л (3,3-19,4) |
А и /А 12,7 мг/л 0,6 мг/л (5,7-26,3) (0,26-1,65) |
||||||
Как следует из таблицы 3 среди 32 изученных больных СЛЦ клон фенотипа и установлен у 26, а λ-фенотипа у 6 больных. Оценивая концентрации СЛЦ у больных с фенотипом и СЛЦ-клона, следует отметить что концентрация клональной СЛЦ-и у этих больных составляла 75,8 мг/л (16,7-700), что значительно превышало нормальные значения для и-СЛЦ 7,3 мг/л (3,3-19,4). Концентрация Л СЛЦ, не вовлеченной в опухолевый процесс была несколько ниже нормы и составляла 10,1 мг/л. При этом нормальные значения составляли 12,7 мг/л (5,.7-26,3).
Ключевым признаком наличия клона опухолевых клеток, продуцирующих СЛЦ -фенотипа было и/Л отношение, которое носило клональный характер, так как в 12,5 раз превышало аналогичный показатель нормальных значений (7,5 против 0,6). Из 26 больных этой группы у 14 (53,8%) была предлеченность ХИТ, что в целом уменьша- ло интенсивность продукции СЛЦ опухолевыми клетками. У 6 больных с клональным характером изменений СЛЦ Л-фенотипа, и/Л отношение составляло 0,12 и было в 5 раз меньше нормальных значений аналогичного показателя (0.6). Концентрация опухолевой СЛЦ λ-фенотипа составляла 12,4 мг/л и практически не отличалась от средних значений нормы (12,7-МЕ) с колебаниями концентраций (от 7,5 до 169 мг/л). Предлеченность больных в этой группе составляла 66% (4 из 6). Следует отметить, что в эту группу были включены больные с клональным и/Л отношением <0,26, с повышением концентраций λ СЛЦ у 3.
В качестве подтверждения роли проводимой противоопухолевой ИХТ на продукцию СЛЦ был проведен анализ концентрации опухолевых СЛЦ-и и неопухолевых СЛЦ-Лу 11 больных с впервые выявленным ХЛЛ до проведения ИХТ.
Таблица 4
|
Число больных |
СЛЦ мг/л (Ме*) |
% получавших ХИТ |
||
|
11 |
и |
λ |
и /А |
|
|
121 (30,3-700) |
11,4 (8,38-61) |
9,04 (3,15-33,8) |
0 |
|
|
Нормальные значения |
7,3 (3,3-19,4) |
12,7 (5,7-26,3) |
0,6 (0,26-1,65) |
|
Концентрация опухолевых СЛЦ- и и неопухолевых СЛЦ-Ху 11 больных с впервые выявленным ХЛЛ
*Ме-медиана
Из таблицы 4 следует, что Ме концентрации опухолевых СЛЦ-и у 11 больных составляла 121 мг/л (30,3-700), что значительно превышало аналогичный показатель в группе больных, где 53,8% проводилась ИХТ (75,8 мг/л). Очевидно, что это различие связано с супрессивным влиянием ХИТ на опухолевые клетки, секретирующие СЛЦ-клон. Эти данные позволяют утвердительно оценивать метод free light assay в качестве дополнительного оценочного критерия эффективности противоопухолевого лечения ХЛЛ. Следует отметить, что под влиянием ИХТ, применяемой для лечения больных в нашем исследовании не произошло существенного снижения СЛЦ-λ, которая не была ассоциирована с опухолевым клоном и по существу отражала состояние нормальных антитело-продуцентов. Падение концентрации опухолевой СЛЦ-и в группе больных, получавших ИХТ про- изошло на 37,4%, а нормальной λ-цепи на 11,5%. (таблица 3; 4). Это соотношение может указывать на достаточно высокую степень избирательности противоопухолевого действия применяемых про- грамм лечения.
Более доказательно эта закономерность продемонстрирована у 15 больных СЛЦ-х ХЛЛ, получавших курсы ХИТ.
Таблица 5.
Концентрация СЛЦ у 15 больных ХЛЛ -фенотипа, получавших курсы ХИТ
|
Число больных |
СЛЦ мг/л (Ме*) |
|||
|
15 |
х |
λ |
х /Л |
% получавших ХИТ |
|
30 (16,7-290) |
9,01 (5,2-24,1) |
3,3 (1,65-23,3) |
100 |
|
|
Нормальные значения |
7,3 (3,3-19,4) |
12,7 (5,7-26,3) |
0,6 (0,26-1,65) |
|
*Ме-медиана
Как следует из таблицы 5, у этих больных Ме концентрации опухолевой СЛЦ-х составляла 30 мг/л (16,7-290). Концентрация неопухолевой λ-СЛЦ составляла 9,01 мг/л (5,2-24,1). Отношение х/Л составляло 3,3 (1,65-23,3). О высокой избирательности (FCR, BR, ибрутиниб) программ лече- ния ХЛЛ свидетельствуют (рисунок 1) достоверные снижения концентрации опухолевой СЛЦ-х (p=0,05) в зависимости от химиотерапевтической нагрузки и отсутствии достоверных изменений СЛЦ нормальных антителопродуцентов.
Свободные легкие цепи каппа
Свободные легкие цепи лямбда
80-
60-
40-
20-
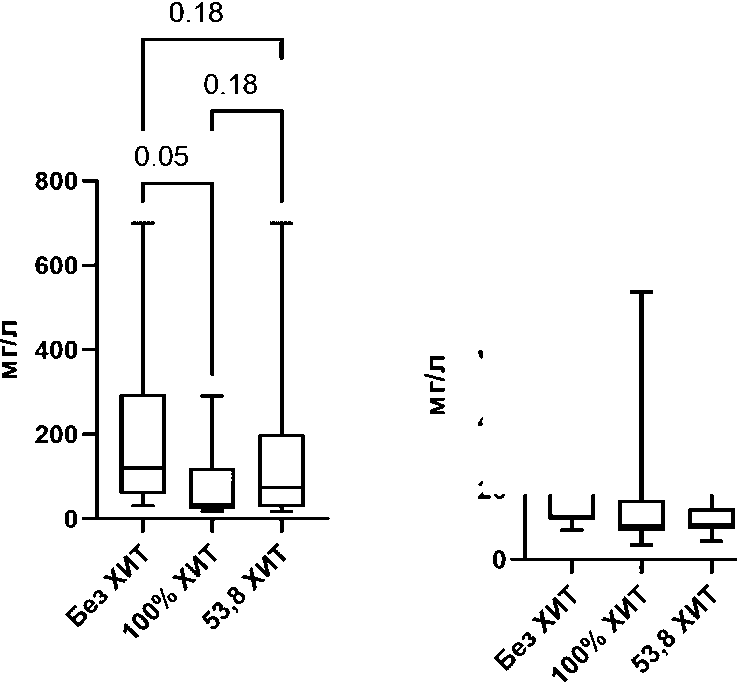
Рисунок 1 . Сравнительный анализ концентраций СЛЦу 26 больных ХЛЛ СЛЦ- х в зависимости от проводимой ИХТ
100-1
У 26 больных ХЛЛ с СЛЦ-х клоном опухолевых клеток была изучена кратность изменения концентрации СЛЦ относительно нормальных их значений.
Таблица 6
Кратность изменения концентраций СЛЦ у 26 больных с ХЛЛ СЛЦ -фенотип
|
Число больных 26 |
СЛЦ |
|
|
и |
λ |
|
|
16,5 (1,6-95,8) |
0,74 (0,40-0,96) у 18 больных 1,65 (1,1-4,8) у 8 больных |
|
Как видно из таблицы 6, в исследуемой смешанной группе больных, где у 53,8% проводили ХИТ, было превышение концентраций опухолевой СЛЦ-и в 16,5 раза. Кратности изменения концентраций неопухолевой λ-СЛЦ носили разнонаправленный характер и были снижены (0,74) у 18 и повышены (1,6) у 8 больных. Этот анализ показывает, что при повышении концентраций опухолевых СЛЦ-и одновременно происходило снижение не вовлечённой в опухолевый процесс λ-СЛЦ, что может свидетельствовать о супрессии нормальных антителопродуцентов, связанных с патологией В-лимфопролиферативного процесса или проводимой ХИТ.
Изучение концентрации СЛЦ опухолевого клона до и после ИХТ было проведено у 11 больных ХЛЛ, которых лечили по программам FCR, BR, BR+B, BR+ибрутиниб. У всех больных исходно диагностированы резистентность или прогрессия заболевания. Интервалы между исследованиями СЛЦ составляли 8 месяцев (ме) (1-10 месяцев). В этой клинической модели было обращено внимание на объективный статус, достигнутый за пери- од лечения в сравнении с данными СЛЦ-анализа. Достигнуто совпадение результатов по указанным параметрам у 10 из 11 больных. Значения СЛЦ соответствовали прогрессии, ремиссии, резистентности, стабилизации. В одном наблюдении такого совпадения не было достигнуто. При констатации полной ремиссии, подтвержденной МОБ (3,5%), концентрация опухолевой СЛЦ-и снизилась с 148 до 37,6 мг/л (норма 7,3 мг/л), и/Л отношение 4,0-4,57 (норма 0,6). Это очень важное положение свидетельствует о том, что Free Light assay обладает большей разрешительной способностью, чем иммунофенотипическое исследование и визуализирует нодальную и экстранодаль-ную остаточную опухоль.
Дальнейший анализ касался изучения концентрации СЛЦ и и/Л отношений у 12 больных ХЛЛ после завершения FCR, BR, FLUCAM, ибр. программ и поддерживающего лечения ритукси-мабом. Одновременно проводили анализы МОБ, клинического статуса и легких цепей на мембране лимфоцитов (таблица 7).
Таблица 7
Сравнительная характеристика показателей МОБ и СЛЦ у 12 больных ХЛЛ после завершения программ ИХТ и поддерживающего лечения ритуксимабом
|
N исследования |
Клиническая характеристика |
МОБ (ИФТ) %* |
СЛЦ мг/л |
ИФТ ЛФ |
|||
|
и |
λ |
и /Л** |
|||||
|
Статус |
ХТ |
||||||
|
1 |
Н.О. |
RB (4) |
2 |
13,2 |
8,76 |
1,5 |
и |
|
2 |
ПО |
FCR (6)+R |
0,02 |
22,1 |
68,1 |
0,32 |
λ |
|
3 |
ПО |
FCR (6)+R |
0,0002 |
1,12 |
7,56 |
0,15 |
и |
|
4 |
ПО |
FCR (6)+R+FLUCAM |
0,002 |
2,9 |
8,95 |
0,21 |
и |
|
5 |
ЧО |
FCR (6)+R+RB |
0,007 |
28 |
17,3 |
1,62 |
и |
|
6 |
ПО |
FCR (6)+R |
1 |
1,96 |
7,68 |
0,26 |
λ |
|
7 |
Н.О. |
BR-11 |
7,6 |
2,58 |
15,9 |
0,16 |
λ |
|
8 |
ЧО |
FCR (6)+R |
0,02 |
15,8 |
19,2 |
0,82 |
λ |
|
9 |
ЧО |
RB (7) |
0,02 |
12,6 |
7,91 |
1,59 |
м |
|
10 |
ПО |
Ибр→RC |
0,56 |
12,5 |
15,9 |
0,79 |
м |
|
11*** |
в/в IIст. |
до леч. |
н,д, |
1,59 |
33,4 |
0,04 |
λ |
|
12 |
в/в IIст. |
до леч. |
н,д, |
30,3 |
8,8 |
3,4 |
м |
*НМОБ <0.01%; ПО- полный ответ; ЧО- частичный ответ; Н.О.- нет ответа
** м/Л- норма 0.6 (0.26-1.65); ***в/в-впервые выявленный
В исследовании №1 (таблица 7) отсутствие клинического ответа сопровождалось значительным снижением МОБ (2%), но оставалась повышенной концентрация опухолевой СЛЦ-м при верхней границе нормы м/Л отношения (1,5). В этом наблюдении можно говорить о наступлении МОБ и СЛЦ-ответов при запаздывании нодальной редукции массы опухоли, или остаточной опухоли in situ после лечения.
В исследовании №2 (таблица 7) достигнутый полный клинический ответ подтверждался глубоким ИФТ ответом (МОБ – 0,02%), однако оставалась значительно повышенной концентрация опухолевой СЛЦ-Л. При этом м/Л отношение оставалось в пределах нижней границе нормальных показателей, но ниже средних значений. Однако в связи с высокой концентрацией СЛЦ-λ, что совпадает λ фенотипом опухолевых В-лимфоцитов, можно предполагать наличие минимального опухолевого клона. Это означает, что СЛЦ метод оценки остаточной болезни при СЛЦ-позитивном ХЛЛ более чувствительный, чем существующие методы. Вероятно, адгезивность опухолевых лимфоцитов удерживает их остаточное количество в депо, и они не могут быть определены в циркуляции, а СЛЦ могут свободно выходить в циркуляцию и определяться в крови.
В исследовании №3 (таблица 7) можно говорить о полном клиническом ответе, подтвержденном НМОБ (<0,01%), супрессией опухолевой СЛЦ-м и неопухолевой СЛЦ- λ после курсов FCR и поддержки ритуксимабом. При этом клональное соотношение м/Л (0,15) Л-типа при -типе опухолевых лимфоцитов связано с преимущественной супрессией опухолевых СЛЦ-м и преобладанием Л-СЛЦ нормальных антителопродуцентов. В данном наблюдении совпадение результатов.
В исследовании №4 (таблица 7) получен полный клинический ответ после FCR+R+FLUCAM, подтвержденный НМОБ с супрессией опухолевых лимфоцитов типа м до 0,002%. Соответственно, СЛЦ-м была значительно ниже нормальных значений (2,9 мг/л). Очевидно, что в этом наблюдении определяется высокая избирательность противоопухолевого действия программы лечения, содержащей моноклональные антитела против В-лимфоцитов. Следует отметить, что м/Л отношение лимфоидной опухоли -типа соответствует λ-типу. Это противоречие произошло за счет относительного уве- личения СЛЦ-λ при преимущественной супрессии опухолевой СЛЦ-м. В целом здесь можно говорить о полном совпадении клинической динамики, клеточных и гуморальных оценочных критериев.
В исследовании №5 (таблица 7) зафиксирован частичный ответ после проведенной программы лечения FCR+R+RB. Важно отметить, что это сопровождалось достижением НМОБ (0,007%). Это означает, что НМОБ не идентифицирует опухолевые клетки, которые находятся вне циркуляции. В тоже время, анализ СЛЦ показал, что концентрация опухолевой СЛЦ-м была значительно повышена, а м/Л отношение было больше нормальных средних значений и приближалась к верхней границе нормы. Полученные результаты свидетельствуют о том, что метод Free Light assay более чувствительный, чем определение НМОБ и может оценивать наличие опухолевых клеток in situ.
В исследовании №6 (таблица 7) достигнута полная ремиссия после проведения программы FCR и поддерживающего лечения ритуксимабом. Клинический результат соответствовал результату МОБ (1%). Анализ СЛЦ показал супрессию концентраций м и опухолевой Л СЛЦ, при снижении м/Л отношения ниже средних нормальных значений, но в нормальных пределах. В этом наблюдении также можно отметить совпадение клинических результатов с данными МОБ и СЛЦ.
В исследовании №7 (таблица 7) не было зафиксировано клинического ответа после проведения курсов ИХТ по программе BR. Это совпадало с результатами МОБ (7,6%). При анализе результатов исследования концентраций СЛЦ также отмечалась повышенная концентрация опухолевой СЛЦ Л, супрессия нормальных антителопродуцентов м и снижения м/Л отношения по Л типу (0,16). В этом исследовании получено подтверждение клинической оценки лечения по результатам изучения МОБ и СЛЦ.
В исследовании №8 (таблица 7) проанализированы клинические результаты после лечения по программе FCR+R. Достигнут частичный ответ, что подтверждается данными МОБ (0,02%). По экспрессии мембранных ЛЦ установлен λ-тип опухоли. Анализ концентрации СЛЦ показал верхние границы нормальных концентраций м и Л СЛЦ при нормальном м/Л отношении (0,82). В этом наблюдении клинические и лабораторные критерии (МОБ и СЛЦ) оценки лечения полностью совпали, хотя они ближе к ПО.
В исследовании №9 (таблица 7) получен частичный ответ после проведения программы BR. При этом достигнута МОБ (0,02%). Анализ концентраций СЛЦ показал увеличение -СЛЦ выше средних значений нормы и снижение Х- цепи, х/Х отношение было на верхних границах нормы. Это может свидетельствовать о существовании остаточной нодальной опухоли -типа и супрессии неопухолевых λ продуцентов. В данном наблюдении СЛЦ метод был более чувствительным, чем НМОБ.
В исследовании №10 (таблица 7) достигнут полный ответ после лечения ибрутинибом. При этом МОБ составляла 0,56%, а концентрация СЛЦ и х/Х отношения были в пределах нормальных значений. В данном наблюдении имеет место совпа- дение клинических и лабораторных результатов (МОБ, СЛЦ) в оценке эффективности проведенного противоопухолевого лечения. В исследованиях №11 и 12 (таблица 7) концентрация СЛЦ была изучена у впервые выявленных больных ХЛЛ IIст. В обоих случаях отмечены клональные изменения х/Х отношений х (3,4) и X (0,04) типов. Эти данные были подтверждены ИФТ опухолевых лимфоцитов х или Х. По результатам данного исследования следует отметить, что наряду с увеличением концентрации опухолевых СЛЦ установлено снижение СЛЦ, не вовлеченных в опухолевых процесс.
Анализ СЛЦ до и после проведения противорецидивной программы BR+ибрутиниб у 2 больных с СЛЦ-х фенотипом ХЛЛ представлен в таблица 8.
Таблица 8
Эффективность BR + ибрутиниб терапии у 2 больных с прогрессией СЛЦ- х ХЛЛ.
|
N исследования |
ИХТ |
х |
λ |
х /Х |
Интервал |
Лечение* |
Статус |
|
до |
33 мг/л |
9,51 мг/л |
3,47 |
10 мес. |
BR+ибр. |
ПО** |
|
|
1 |
после |
11,7 мг/л |
13,9 мг/л |
0,84 |
|||
|
2 |
до |
15,3 мг/л |
9,83 мг/л |
1,56 |
8 мес. |
BR+ибр. |
ПО |
|
после |
7,34 мг/л |
10,07 мг/л |
0,68 |
*BR- бендамустин, ритуксимаб, ибрутиниб; **ПО- полный ответ
Как видно из таблицы 8 через 8-10 месяцев лечения концентрация СЛЦ-х снизилась на 64,5% и немного превышала норму в одном наблюдении. В другом наблюдении снижение СЛЦ было на 52% вплоть до нормальных значений. Важно отметить, что концентрация нормальных антитело-продуцентов повысилась практически до нормы (на 31,5% и 2,4%). Это свидетельствовало о высокой избирательности BR+ибрутиниб программы, которая снимала супрессивный эффект с нормальных антителопродуцентов, осуществляемый опухолевыми клетками. При этом х/Х отношение оставалось немного повышенным (0,84) в первом и нормализовалось во 2 наблюдении. Сравнивая полученные результаты у двух больных, достигших ПО, можно сказать, что в первом наблюдении определялась остаточная опухоль in situ.
Обобщая результаты, представленные в таблице 7, можно обратить внимание на взаимосвязь между категорией клинического ответа на лечение, характеристикой МОБ (НМОБ), концентрацией СЛЦ, х/Х отношением и мембранными ЛЦ на опухолевых лимфоцитах крови. Установлено, что в трех наблюдениях при констатации полного или частичного ответов на лечение (МОБ от 0,02 до 0,007) были отчетливые признаки наличия СЛЦ опухолевого клона, клетки которого практически не определялись в циркуляции, а продуци- ровали СЛЦ in situ. По существу, речь идет о визуализации нодального пула опухоли (№2; 5 и 9).
В исследованиях №8 и 10 можно условно говорить о совпадении результатов МОБ (0,02 и 0,56%) и концентрации СЛЦ и х/Х отношения, колебания которых не выходили за пределы нормальных значений. Однако концентрации опухолевых СЛЦ превышали средние значения нормы, а их принадлежность к опухолевому клону подтверждалась идентичным изотипом СЛЦ на мембране опухолевых лимфоцитов.
В исследованиях №3, 4 и 6 концентрации СЛЦ совпадали с категорией клинического ответа и минимальными значениями циркулирующих опухолевых лимфоцитов (МОБ и НМОБ). В этих наблюдениях следует отметить цитостатическую супрессию опухолевых и неопухолевых СЛЦ. Причем в 2 случаях (№3 и 4) это привело к искажению х/Х отношения. Установлен Х-тип клональности (0—>15 и 0—>21) при х-типе мембранных СЛЦ.
В исследованиях №1 и 7 не было клинического результата после проведенных ИХТ программ, хотя опухолевые лимфоциты в циркуляции были значительно снижены и составляли от исходных значений 2 и 7,6%, соответственно. Анализ показал, что концентрации опухолевых СЛЦ и х/Х отношения свидетельствовали об опухолевом типе изменений. В этих наблюдениях можно говорить о совпадении полученных результатов. Рассматривая метод СЛЦ с позиций новых оценочных критериев эффективности ХТ при ХЛЛ, следует отметить, что в нашей исследовательской модели совпадение с клиническим статусом и МОБ (НМОБ) достигнуто в 7 из 10 наблюдений. В трех наблюдениях при НМОБ от 0,02 до 0,007 (%) от исходных значений изменения СЛЦ носили опухолевый характер, что свидетельствовало о наличии остаточной опухоли in situ. Следовательно, метод СЛЦ в оценке остаточной болезни после ИХТ ХЛЛ был на 30% чувствительнее, чем имму-нофенотипическое определение МОБ.
Выводы. Таким образом, в представленном исследовании приведены результаты анализа СЛЦ иммуноглобулинов сыворотки крови у 50 больных ХЛЛ, проведен анализ концентрации СЛЦ в зависимости от проводимой ХИТ (FCR; R; BR; ибрутиниб). При этом сравнивали показатели и и Л СЛЦ в группе без лечения с группами, где все получали лечение. Кроме этого анализа была проведена динамическая оценка концентрации СЛЦ до и после завершения курсов ИХТ в сравнении с результатами стандартной клинической оценки. Важным этапом этой работы был сравнительный анализ МОБ, включая НМОБ и концентрации опухолевой СЛЦ после проведенного противоопухолевого лечения. Следует от- метить, что проведенные исследования можно расценивать как иммунологический мониторинг (МОБ и СЛЦ) эффективности ХИТ. Одним из важных итогов работы следует считать установление частоты встречаемости СЛЦ патологии при ХЛЛ. Было установлено, что моноклональный характер изменений СЛЦ (повышение концентрации одной из СЛЦ и измененное и/Л отношение) был у 32 больных (64%) и без СЛЦ патологии был у 18 больных (36%). На наш взгляд это важное положение, позволяющее использовать СЛЦ в качестве дополнительного иммунологического мониторинга ИХТ ХЛЛ.
Конфликты интересов отсутствует
Источник финансирования
Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн: все авторы
Сбор и обработка данных: все авторы
Предоставление материалов исследования: все авторы
Анализ и интерпретация: все авторы Подготовка рукописи: все авторы Окончательное одобрение рукописи: все авторы
Список литературы Анализ свободных легких цепей иммуноглобулинов сыворотки крови у больных хроническим лимфолейкозом в процессе химиоиммунотерапии
- Hallek M., Fisher K., Fingerle–Rowson Y. et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open–label, phase 3 trial // Lancet. – 2010. – Vol. 376, N2. – P. 1164–1174.
- Betteher S., Ritgen M., Fischer K. et al. Minimal residual disease quantification is an indepentend predictor of progression free and overall survival in chronic lymphocytic Leukemia. A multivariate analysis from the randomized GCLLSG CLL 8 trial // J Clin Oncol. – 2012. – Vol. 30, N9.– P. 980–988.
- Rawstron A., Fazi C., Agathagelidis A. et al. A Commplementary role of multiparameter flow cytometry and high–throughput sequencing for minimal residual direction in chronic lymphocytic Leukemiа: an European Researoh initiative on CLL study // Leukemiа. – 2016. – Vol. 30, N4. – P. 929–936.
- Rowstron A., Cohen D., de Tute R. et al. Bone marrow is more sensitive than peripheral blood for detection of MDR in CLL and provides a more reliable prediction of ancome across different treatments // Haematologica. – 2015. – Vol. 100, (Suppl 1).–Abstract S794
- Голенков А.К., Митина Т.А., Новиков В.В., Тагиров О.Т. и др. Клиническое значение растворимых молекул адгезии (sCD50 – ICAM – 3), апоптоза (sCD95) и sHLA класса – I при лимфопролиферативных заболевания // Российский Биотерапевтический журнал. – 2002. – № 1. – С. 60-64
- Митина Т.А. Клиническое значение линейного и адгезивного фенотипов опухолевых клеток при хроническом лимфолейкозе // Дисс. канд. М. – 2003. 27 с.
- Катаева Е.В., Голенков А.К., Митина Т.А., Клинушкина Е.Ф. и др. Клинические аспекты определения свободных легких цепей иммуноглобулинов сыворотки крови у больных хроническим лимфолейкозом // Гематология и трансфузиология. – 2017. – Т. 62, № 3. – С. 153-157.
- Martin W., Abraham R., Shanafelt T., Clark R. et al. Serum free light chain – a new biomarker for patients with B-cell non-Hodgkin lymphoma and chronic lymphocytic leukemia // Translational Research. – 2007. – Vol. 149, № 4. – Р. 231-235.
- Бессмельцев С.С. Современные методы диагностики и лечения больных хроническим лимфолейкозом. // Вестник гематологии. – 2011. – №1.– С. 137-156
- Савченко В.Г. Алгоритмы диагностики и протоколы лечения заболеваний системы крови. 2018, том 2, с.323-361.
- Hallek M., Cheson B.D., Catovsky D., Calligaris-Cappio F. et al. International workshop on chronic lymphocytic leukemia. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the international workshop on chronic lympocytic leukemia updating the National Cancer Institute- working group 1996 guidelines // Blood. – 2008. – Vol. 111, № 12. – Р. 5446-56
- Rawstron A.C. International standartized approach for flow cytometrics residual disease monitoring in chronic lymphocytic leukemia // Leukemia: – 2007. – Vol. 21, № 5. – Р. 956-964.


