Биохимическое кровотечение у пациентов при открытой реконструкции брюшного отдела аорты
Автор: Гуреев Антон Дмитриевич, Труханова Инна Георгиевна, Прожога Михаил Григорьевич
Рубрика: Клиническая медицина
Статья в выпуске: 2-2 т.17, 2015 года.
Бесплатный доступ
В статье представлены результаты исследования особенностей плазменно-тромбоцитарного гемостаза у больных, которым выполнялись операции на брюшном отделе аорты. Всего в работу включено 96 пациентов. Всем им были выполнены открытые аорто-подвздошные реконструкции. У 32 больных по поводу аневризмы инфраренального отдела аорты, а у 64 больных по поводу синдрома Лериша при развившейся хронической критической ишемии конечностей. Подтверждено, что коагулопатия потребления присутствует у всех этих больных уже на дооперационном этапе. Установлено, что степень активности фибринолиза к концу оперативного вмешательства не превышает критического значения. Выработан алгоритм инфузионно-трансфузионной терапии в хирургии инфраренального отдела аорты.
Хирургия брюшного отдела аорты, коагулопатия потребления, кровотечение, свежезамороженная плазма, тромбоэластография, степень активности, фибринолиз
Короткий адрес: https://sciup.org/148102653
IDR: 148102653 | УДК: 616-089.5-032:611.819
Текст научной статьи Биохимическое кровотечение у пациентов при открытой реконструкции брюшного отдела аорты
Хронические облитерирующие атеросклеротические поражения брюшного отдела аорты и артерий нижних конечностей являются наиболее распространенным заболеванием у мужчин старшей возрастной группы. Они не уступают по частоте ИБС, составляя до 20 % в структуре всей сердечно-сосудистой патологии [1; 14]. За последнее десятилетие, несмотря на активное развитие фармакотерапии, потребность в выполнении реконструктивных оперативных вмешательств на аорто-подвздошном сегменте не снизилась [18]. Эпидемиологические исследования в разных странах показывают, что эта потребность варьирует от 35 до 90 на 100 тыс. населения в год [11].
Улучшение качества медицинской помощи этим больным, в том числе и оперативное лечение, является одной из актуальных задач сердечно-сосудистой хирургии [10].
Следует отметить, что на современном этапе развития хирургии техника выполнения самих аорто-подвздошных реконструкций хорошо отработана благодаря основополагающим трудам как отечественных, так и зарубежных ученых (А.А. Вишневский 1972; А.В. Покровский 1979; I.A. De Weese 1972; M. De Bakey 1975; H. Berkoff 1987).
У многих больных стало возможным снизить операционную травму за счет выполнения гибридных операций, либо эндопротезирования брюшного отдела аорты при аневризмах. Результаты рандомизированных исследований свидетельствуют о периоперационном преимуществе эндоваскулярных методик в отношении смертности, незначительном числе осложнений и коротком периоде восстановления. Тем не менее, у значительной части больных (до 60 %), в силу различных причин, сохраняется потребность в выполнении открытых операций [9; 10; 11]. Выживаемость в отдаленном периоде, в зависимости от выбора метода лечения, по-прежнему не отличается.
По данным последнего мета-анализа операций на брюшной аорте, летальность при плановых операциях составляет порядка 2–5 %, а при экстренных – до 47 % (A. Hallin, 2001).
Высокий процент летальности при сосудистых реконструкциях на брюшной аорте, в том числе, обусловлен послеоперационными осложнениями, частота развития которых достигает 30% по данным ряда авторов [11; 13]. В их структуре ведущая роль принадлежит расстройствам системы кровообращения – до 45–62 % [11; 13; 17]. На втором месте находятся бронхолегочные компликации, по данным литературы они встречаются в 10–15% случаев [1].
Как к интра-, так и к послеоперационным осложнениям относится кровотечение, которое во время этих вмешательств остается значимым фактором риска и существенно усугубляет расстройства сердечно-сосудистой системы. Так, по объемам кровопотери, реконструкция аорто-подвздошной зоны может оказаться сопоставима с массивными травмами как мирного, так и боевого времени [18; 19].
Успехи современной сосудистой хирургии возможны только в условиях одновременного прогресса анестезиологии и реаниматологии – ни в одной из других дисциплин благоприятный исход у пациентов высокого риска так не зависит от адекватности анестезии, инфузионно-трансфузионного пособия и надлежащего послеоперационного ведения.
Проблема осложнена тем, что кроме возможного интраоперационного хирургического кровотечения у этих больных присутствует выраженная исходная коагулопатия потребления, как следствие длительно существующего атеросклероза и его осложнений [3]. Крайним выражением коагулопатии является синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) [15; 19]. Сегодня доказано, что нарушения гемостаза развиваются у 25–35 % больных при аорто-подвздошных реконструкциях и являются частой причиной летальных исходов. Частота неблагоприятных результатов, связанных с кровопотерей, по данным ряда авторов составляет от 2 до 20% [6; 10; 20].
Таким образом, разработка вопросов профилактики интра-/послеоперационной кровопотери нехирургического типа – биохимическое кровотечение, при сосудистых реконструкциях аорто-подвздошного сегмента у пациентов с длительно существующим мультифокальным атеросклеротическим процессом, является актуальной проблемой междисциплинарного комплексиро-вания, в свете современных стратегий лабораторной диагностики («point of care test») и индивидуализированной, цель-ориентированной терапии периоперационных осложнений [2; 3; 4; 5; 7; 8; 12; 16; 21; 22].
Цель исследования: уменьшить интраоперационную кровопотерю нехирургического характера у пациентов, оперированных на брюшном отделе аорты, путем определения степени активации системы фибринолиза и оптимизации компонентного состава инфузионно -трансфузионной терапии на основании интерпретации результатов тромбоэластографии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнялось проспективно с 2009 по 2012 гг. Критерии включения больных были следующие:
-
• больные с атеросклерозом, которым выполнялись открытые реконструкции аорто-подвздошного сегмента в виде бифуркационного аорто-бедренного шунтирования (БАБШ) и бифуркационного аорто-бедренного протезирования (БАБП);
-
• отсутствие сахарного диабета;
-
• отсутствие во время операции технических проблем, которые сопровождались одномомент-
- ной кровопотерей в объеме 300 мл и более.
Среди пациентов, которым была выполнена хирургическая коррекция аорто-подвздошного сегмента, были сформированы две группы больных. Эти группы были сопоставимы между собой по полу, возрасту, основному диагнозу, сопутствующей патологии, виду операции и анестезиологического пособия. Основная группа (no) состояла из 48 человек (мужчин 45, женщин 3), средний возраст 63,9 ± 7,5 лет (минимальный 48 лет, максимальный 78 лет). Группа контроля (nk) была представлена 48 пациентами (мужчин 41, женщин 7), средний возраст 61,7 ± 6,9 лет (минимальный 50 лет, максимальный 76 лет). Основным диагнозом были – облитерирующий атеросклероз артерий нижних конечностей III – IV ст. по классификации Lerish-Fontein 64 человека (67%) и аневризма инфраренального отдела аорты 32 человека (33%). Сопутствующая ишемическая болезнь сердца (ИБС) была выявлена у 92 больных (96%). Все больные были курильщиками со стажем курения более 15 лет. Характер и объем выполненных операций представлен в табл. 1.
Хирургический доступ – внебрюшинный ретроперитонеальный (по Робу) 72 человека (75%) и срединный лапаратомный 24 человека (25%). Анестезиологическое пособие у всех больных было идентичным – пролонгированная эпидуральная анестезия на уровне Th 6–7 (катетеризация перидурального пространства на + 3,0 см краниально) с внутривенной седацией и спонтанным дыханием увлажненной кислородно-воздушной смесью.
Инфузионно-трансфузионная терапия (ИТТ) в группах была представлена коллоидно-кристаллоидными препаратами в соотношении 1:2,5. Средний объем коллоидов (гидроксиэтил крахмалы – ГЭК 130/0,4) составил 1,25 ± 0,28 литра, кристаллоидов (физиологически сбалансированные растворы электролитов) 2,86 ± 0,26 литра соответственно. В основной группе отличие заключалось в дополнительном компоненте ИТТ – уже на этапе доступа к брюшному отделу аорты больному вводили одногруппную СЗП в объеме 650 ± 35 мл. Гепаринизация применялась в обеих группах и составляла 5000 ЕД нефракцио-нированного гепарина (B.Braun, Германия) перед пережатием аорты.
Всем больным, вошедшим в исследование, был выполнен анализ ТЭГ (TEG®5000, 4-я компьютерная версия, Hemoscope, США). Для этого брали образцы периферической венозной крови из локтевой вены без шприца в силиконизиро-ванные центрифужные пробирки с 3,8% раствором цитрата натрия в соотношении 9:1 (пробирка тип Vacutainer 4,5 мл, реагент цитрат натрия 0,129 М 3,8%, Becton Dickinson International, США), которые в течение 5 минут помещали в специальные чашечки объемом 0,36 мл без специальных
Таблица 1. Вид оперативного вмешательства
Статистический анализ данных включал методы описательной статистики-среднее (μ) и стандартное отклонение ( σ ). Проверка данных на соответствие нормальному закону распределения проводилась с помощью критериев Колмогорова – Смирнова, Лиллиефорса. Тогда, когда распределение соответствовало нормальному, для оценки достоверности различий использовался t-тест (критерий Стьюдента) для двух независимых выборок (двух наборов данных). Различия между выборками считались достоверными при P < 0,001. Обработка данных проводилась с использованием пакета статистических программ Statistica 6.0 (StatSoft Inc., США), Microsoft Office Excel 2003 (Microsoft Corp., США).
РЕЗУЛЬТАТЫ
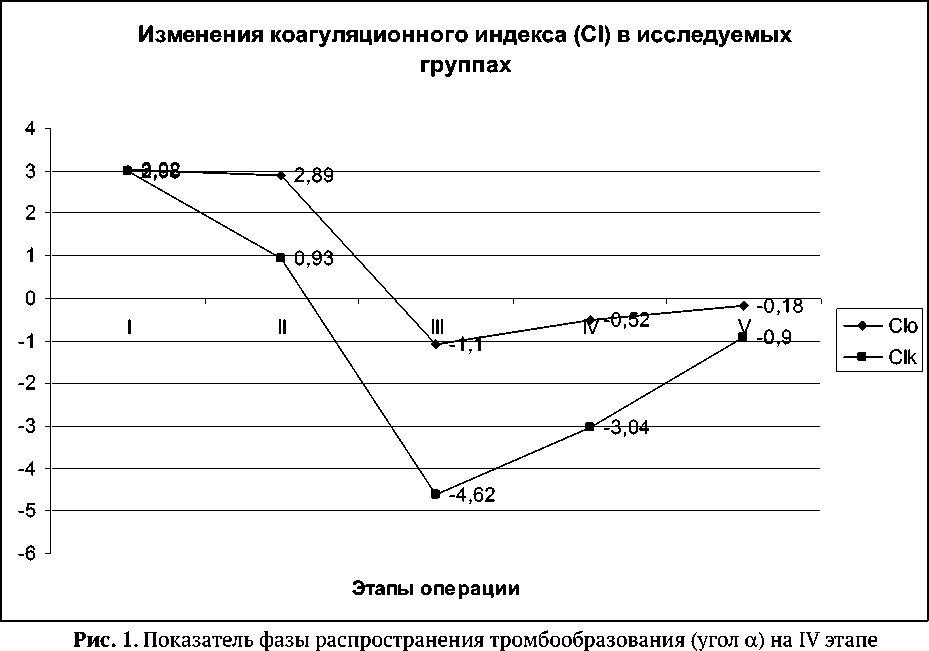
Результаты выявленных нами показателей ТЭГ (CI, r, угол α , LY30) в группах сравнения на этапах оперативного лечения (I - до операции , II - доступ к аорте , III - проксимальный анастомоз , IV - окончание операции , V - через 12 часов ), а также объем интраоперационной кровопотери приведены в таблицах 2 – 6 и на рис. 1.
Оказалось, что значение коагуляционного индекса (CI) до операции в обеих группах находилось в области гиперкоагуляции CIo = 3,02 ± 0,22 и CIk = 2,98 ± 0,22 и не имело статистически значимых различий P = 0,313 (таблица 2). С момента начала оперативного вмешательства и сопутствующей инфузионно-трансфузионной терапии в основной группе наблюдалась тенденция к сохранению повышенного коагуляционного потенциала CIo = 2,89 ± 0,25, в то время как в контрольной группе коагуляционный индекс смещался в сторону гипокоагуляции CIk = 0,93 ± 0,23 (P<0,001).
На момент начала действия гепарина и наложения зажима на аорту (этап III, рис. 1) у больных контрольной группы происходило статистически значимое смещение коагуляционного индекса в сторону гипокоагуляции СIk = -4,62 ± 0,23 (P<0,001). К моменту окончания реконструкции в обеих группах сохранялась гипокоагуляционная тенденция: CIo = -0,52 ± 0,27 и CIk = -3,04 ± 0,22 (P<0,001). Она же прослеживалась спустя 12 часов после операции, но по-прежнему была наиболее выражена в группе больных, не получавших СЗП на II этапе: CIk = -0,90 ± 0,22 в сравнении с CIo = -0,18 ± 0,25 (P<0,001).
Показатель инициации тромбообразования (r) на этапах операции претерпевал схожие изменения. Так, на этапе III (табл. 3) в группе контроля он в 1,2 раза превышал значение ro (P<0,001).
Показатель фазы распространения тромбооб-разования (угол α ) на IV этапе (табл. 4) у группы контроля оказался в 1,3 раза меньше α o (P<0,001).
Сравнительный анализ групп показал, что кровопотеря у пациентов основной группы к концу оперативного вмешательства была в 2,3 раза меньше (P<0,001), чем в группе контроля (табл. 5). Ни в одной из групп показатель активности фибринолиза (LY30) к концу оперативного вмешательства (этап IV) не превышал критического значения 8%, хотя была выявлена достоверная разница у больных разных групп (табл. 6).
ОБСУЖДЕНИЕ И ВЫВОДЫ
Наше исследование показало, что на III и IV этапах реконструкции аорто - подвздошного сегмента значения коагуляционного индекса и показателя фазы распространения тромбооб-разования, по данным ТЭГ, в группе контроля находятся в зоне гипокоагуляции. По мнению Johansson P.I. и соавт. (2010) [22], это следует трактовать как необходимость назначения СЗП из расчета 20 мл/кг или минимум 10 мл/кг, с целью коррекции системы гемостаза, и посред-
Таблица 2 . Изменения коагуляционного индекса (CI) в исследуемых группах
|
Вид операции |
Группа контроля (n k ), человек |
Основная группа (n o ), человек |
|
БАБШ |
27 |
25 |
|
БАБП |
21 |
23 |
|
ИТОГО |
48 |
48 |
Таблица 3. Изменения показателя инициации тромбообразования (r) в исследуемых группах
|
Этапы |
Группы сравнения |
t- статистика |
t критическое двухстороннее |
р |
|
|
II контрольная (r k ) |
I основная (r o ) |
||||
|
I (до операции) |
6,84 ± 0,21 |
6,85 ± 0,28 |
0,42 |
3,41 |
0,67 |
|
II (доступ к аорте) |
7,03 ± 0,26 |
5,96 ± 0,31 |
17,90 |
1,99 |
<0,001 |
|
III (проксимальный анастамоз) |
15,82 ± 0,30 |
12,92 ± 0,34 |
43,22 |
1,99 |
<0,001 |
|
IV (окончание операции) |
13,96 ± 0,23 |
11,01 ± 0,24 |
60,84 |
1,99 |
<0,001 |
|
V (через 12 часов) |
8,37 ± 0,32 |
7,04 ± 0,18 |
24,21 |
1,99 |
<0,001 |
ством этого предупреждение возможности массивного кровотечения вследствие выраженной, нарастающей гипокоагуляции. Трансфузия СЗП в объеме не менее 650 ± 35 мл, в течение II этапа операции в основной группе позволила уменьшить общую кровопотерю к концу операции в 2,3 раза (P<0,001). Для предупреждения развития кровотечения «нехирургического» характера при открытой реконструкции аорто-подвздошного сегмента необходимо проводить динамическую интегральную оценку системы гемостаза и своевременно корректировать наступающие в ней сдвиги. Результаты нашего исследования согласуются с научными разработками в данной области. В частности, J.P. Gertler et all. (1996) [17] показали, что при инфраренальном наложении зажима на аорту уменьшается активность факторов свертывания и увеличивается фибринолитическая активность крови. При этом, S. Von Sommogy et all. (1991) [21] объясняют выявленную активацию фибринолиза умеренной гиперкоагуляцией, обусловленной кровопотерей за время операции, и, как следствие, снижением пула естественных антикоагулянтов (AT III). Наши данные свиде-
Таблица 4. Изменения фазы распространения тромбообразования (угол α ) в исследуемых группах
|
Этапы |
Группы сравнения |
t- статистика |
t критическое двухстороннее |
Р |
|
|
II контрольная (a k ) |
I основная (a o ) |
||||
|
IV (окончание операции) |
47,13 ± 0,34 |
59,52 ± 0,55 |
133,82 |
1,99 |
<0,001 |
Таблица 5. Объем кровопотери в исследуемых группах
|
Группы сравнения |
t- статистика |
t критическое двухстороннее |
р |
|
|
II контрольная |
I основная |
|||
|
763,8 ± 33,2 |
332,5 ± 67,2 |
-39,88 |
1,99 |
<0,001 |
Таблица 6. Изменения активности фибринолиза (LY30) в исследуемых группах
Список литературы Биохимическое кровотечение у пациентов при открытой реконструкции брюшного отдела аорты
- Бокерия Л.А., Ступаков И.Н. Сердечно-сосудистые заболевания в Российской Федерации на рубеже веков: смертность, распространенность, факторы риска/Л.А. Бокерия, И.Н. Ступаков//Бюллетень НЦССХ им. А.Н. Бакулева РАМН «Сердечно-сосудистые заболевания». 2007. Т. 8. № 5. С. 5-11.
- Дементьева И.И., Чарная М.А., Морозов Ю.А., Гладышева В.Г. Тромбоэластография в кардиохирургии/И.И. Дементьева, М.А. Чарная, Ю.А. Морозов, В.Г. Гладышева. М., 2007. 20 с.
- Дементьева И.И., Чарная М.А., Морозов Ю.А. Система гемостаза при операциях на сердце и магистральных сосудах/И.И. Дементьева, М.А. Чарная, Ю.А. Морозов. М.: «ГЭОТАР-Медиа», 2009. 432 с.
- Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза/В.В. Долгов, П.В. Свирин. М.: «Триада», 2005. 227 с.
- Любошевский П.А., Овечкин А.М., Забусов А.В. Роль эпидуральной анестезии в ограничении периоперационных нарушений гемостаза при абдоминальных операциях/П.А. Любошевский, А.М Овечкин, А.В. Забусов//Новости хирургии. 2011. Т. 19. №5. С. 106-111.
- Мозговой П.В. Тромбогеморрагические осложнения после реконструктивных операций на брюшном отделе аорты и магистральных артериях нижних конечностей (профилактика, диагностика, лечение): дис. …д-ра мед. наук: 14.00.27/Мозговой Павел Вячеславович. Волгоград, 2004. 369 с.
- Момот А.П. Патология гемостаза принципы и алгоритмы клинико-лабораторной диагностики/А. П. Момот. СПб., 2006. 209 с.
- Морозов Ю.А., Чарная М.А., Гладышева В.Г., Белов Ю.В. Изменение некоторых показателей системы гемостаза при операциях на аорте/Ю.А. Морозов, М.А. Чарная В.Г. Гладышева, Ю.В. Белов//Ангиология и сосудистая хирургия. 2006. № 2. С. 101-104.
- Национальные рекомендации по ведению пациентов с аневризмами брюшной аорты/А.В. Покровский. М.: 2013. 74 с.
- Покровский А.В. Клиническая ангиология/А.В. Покровский. М.: «Медицина», 2004. 808 с.
- Спиридонов А.А., Бокерия Л.А., Аракелян В.С.//Грудная и сердечно-сосудистая хирургия. 2003. №5. С. 34-40.
- Шадрин Р.В., Матанцева Е.Ф., Величко Д.С. Сравнительная характеристика функциональных методов диагностики состояния системы гемостаза/Р.В. Шадрин, Е.Ф. Матанцева, Д.С. Величко//Вестник интенсивной терапии. Материалы X Юбилейной Всероссийской научно -методической конференции с международным участием «Стандарты и индивидуальные подходы в анестезиологии и реаниматологии». 2013. С. 59
- Chansah J.N., Murphy J.T. Complications of the major aortic and lower extremity vascular surgery/J.N. Chansah, J.T. Murphy//Seminars in Cardiothoracic and Vascular Anesthesia. 2004. Vol. 8, 4. Р. 335-361.
- Deborah J., Donelly C. Epidemiology and risk factor management of peripheral arterial disease/J. Deborah, C. Donelly//J. Vasc & Endovasc. Sur. 2006. P. 1-13.
- DeLoughery T.G. Hemostasis and Thrombosis 2nd Edition/T.G. DeLoughery. Landes Bioscience, 2004. 218 p.
- Hartert H. Blutgerinnungsstudien mit der thrombelastographie, einem neuen untersuchungsverfahren/H. Hartert//Klin. Wochenschr. 1948. Vol. 26. P. 577-583.
- Gertler J.P., Cambria R.P., Brewater D.C. et all. Coagulation changes during thoracoabdominal aneurism repair/J.P. Gertler, R.P. Cambria, D.C. Brewater et all.//J. Vasc. Surg. 1996. Vol. 24 (6). P. 936-943.
- Karthikesalingam A., Hinchliffe R.J., Holt P.J., Boyle J.R., Loftus I.M., Thompson M.M. Endovascular aneurysm repair with preservation of the internal iliac artery using the iliac branch graft device/A. Karthikesalingam, R.J. Hinchliffe, P.J. Holt, J.R. Boyle, I.M. Loftus, M.M. Thompson//Eur. J. Vasc. Endovasc. Surg. 2009.
- Kitchens C.S., Alving B.M., Kessler C.M. Consultative Hemostasis and Thrombosis/C.S. Kitchens, B.M. Alving, C.M. Kessler. W.B. SAUNDERS COMPANY, 2004. 599 р.
- Swallow R.A., Agarwal R.A., Dawkins K.D., Curzen N.P. Thromboelastography: potential bedside tool to assess the assess of antiplatelet therapy?/R.A. Swallow, R.A. Agarwal, K.D. Dawkins, N.P. Curzen//Platelets. 2006. Vol. 17: 6. Р. 385-392.
- Von Sommogy S., Fraunhofer S., Wahba A. et all. Coagulation in aortofemoral bifurcation bypass grafting/S. Von Sommogy, S. Fraunhofer, A. Wahba et all//Eur. J. Vasc. Surg. 1991. Vol. 5(3). P. 247-253.
- Johansson P.I., Ostrowski S.R., Secher N.H. Management of major blood loss: an update/P.I. Johansson, S.R. Ostrowski, N.H. Secher//Acta Anaesthesiol. Scand. 2010. Vol. 54. P. 1039-1049.


