Бластная плазмоцитоидная дендритно-клеточная неоплазия - диагностика и результаты первого и второго этапа лечения(клиническое наблюдение)
Автор: Черноусов И.М., Клеина И.В., Новосельцева Л.Г., Филиппович Т.В., Смирнов Р.Н., Алексеев С.А., Троян В.Н., Рукавицын О.А.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Клиническое наблюдение
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Бластная плазмоцитоидная дендритно-клеточная неоплазия - редкое заболевание, исходящее из плазмоцитоидных дендритных клеток. Приведены данные, характеризующие процесс диагностики и лечения пациента, наблюдаемого с установленным диагнозом с февраля 2022 года. На первом этапе лечение оказалось успешным. В дальнейшем у пациента развилась нейролейкемия, курсы противоопухолевой химиотерапии были неэффективны. Проводилась лучевая терапия на весь объем головного мозга. Сделан акцент на необходимости накопления информации о редкой гематологической патологии. Это должно привести к формированию стандартных подходов к терапии редкого заболевания.
Бластная плазмоцитоидная дендритно-клеточная неоплазия, диагностика, лечение, нейролейкемия
Короткий адрес: https://sciup.org/170198329
IDR: 170198329
Текст научной статьи Бластная плазмоцитоидная дендритно-клеточная неоплазия - диагностика и результаты первого и второго этапа лечения(клиническое наблюдение)
Бластная плазмоцитоидная дендритно-клеточная неоплазия (БПДКН) – редкая гематологическая злокачественная опухоль. Она может характеризоваться поражениями кожи и агрессивным клиническим течением, с быстрым поражением костного мозга и лимфатических узлов. Пациентов с БПДКН принято разделять на группы с кожными поражениями и без них, однако клиническое значение такого разделения не вполне ясно: данных о том, что лечение разнится и прогноз неодинаков, пока нет [1]. Обычно БПДКН характеризуется плохим прогнозом и низкими показателями выживаемости. Опухоль исходит из плазмоцитоидных дендритных клеток; детальный патогенез ее неясен. Опухолевые клетки характеризуются аберрантной экспрессией CD4, CD56, альфа-цепи рецептора интерлейкина 3 (CD123), антигенов дендритных клеток крови 2 (BCDA2/ CD303) и 4 (BCDA4), а также транскрипционного фактора (TCF4) [2]. В зависимости от типа экспрессии делаются попытки разделить пациентов с БПДКН на подгруппы (с экспрессией CD123, CD303 и т.д.), но целесообразность этого разделения неочевидна [3]. Лечение БПДКН не разработано, но обычно основано на препаратах, применяемых для терапии лейкозов и лимфом [4]. Рецидивы заболевания и резистентность к проводимому лечению встречаются часто. Трансплантация аллогенных гемопоэтических стволовых клеток может быть выполнена в полной ремиссии заболевания [5].
Цитогенетические исследования выявляют разнообразные и множественные хромосомные аберрации, нередко в составе комплексного кариотипа; возможно развитие нескольких клонов, либо клонов с субклонами. Ввиду редкости заболевания клиническое и прогностическое значение цитогенетических находок неопределенно [6,7].
Клиническое наблюдение. Пациент Г., мужчина 66 лет без выраженной коморбидности. Анамнез заболевания: считает себя больным с января 2022 г., когда впервые отметил появление одышки, общей слабости, периодических носовых кровотечений. 26.01.22 обратился к терапевту по месту жительства, назначена противовирусная терапия. С 04.02.22 отметил увеличение шейных лимфатических узлов, к терапии добавлены антибактериальные препараты. По данным компьютерной томографии органов грудной клетки (КТ ОГК) данных за поражение легочной ткани не выявлено. Госпитализирован в стационар для обследования. Выполнена стернальная пункция. Диагностирован острый лейкоз (мие-лограмма от 16.02.22: бластные клетки – 95%). Для дальнейшего обследования и лечения переведен в гематологический стационар.
При поступлении жалобы на общую слабость, учащенное сердцебиение, головокружение, одышку в покое и при незначительной физической нагрузке, повышение температуры тела до субфебрильных цифр, периодические носовые кровотечения, увеличение периферических лимфоузлов. Гемограмма 18.02.22: лейкоциты – 192,48х109/л, гемоглобин – 6,9 г/дл, тромбоциты – 38х109/л, бластные клетки – 91 %. Миелограмма 18.02.22: костный мозг гиперклеточный. Бластные клетки составляют 93,2 % (рис.1 а) и б)).
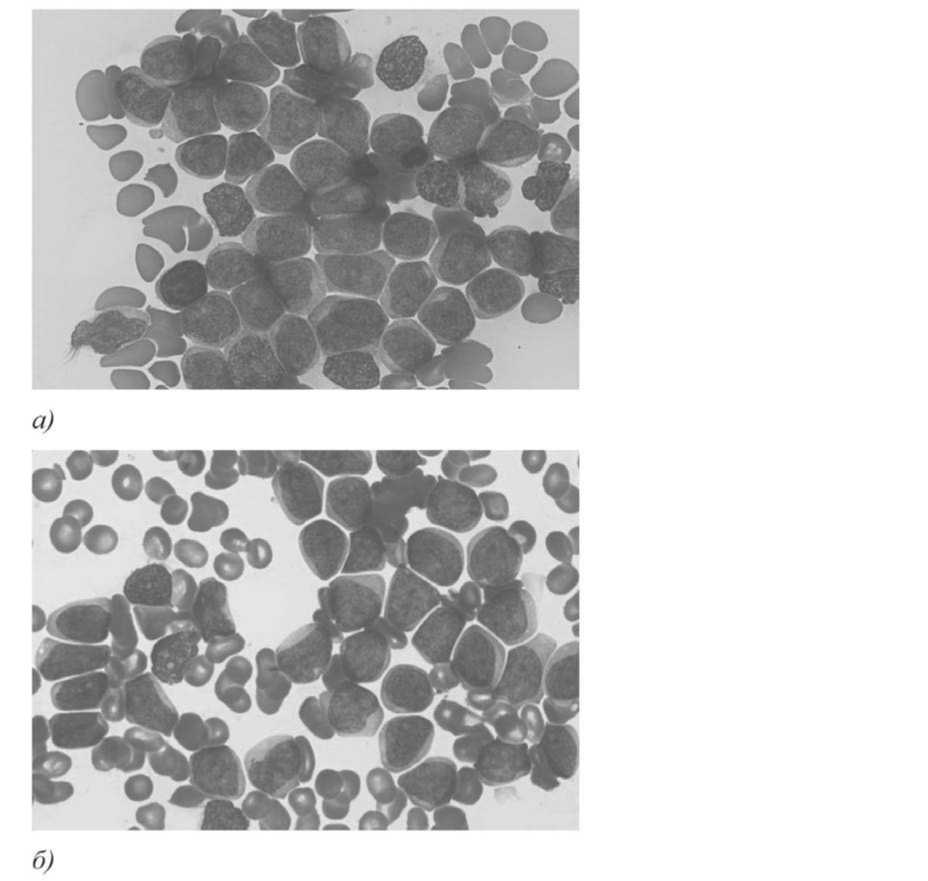
Рис .1. Препарат костного мозга : метаплазия бластными клетками
Они представлены мономорфно клетками небольшого размера с умеренным ядерно-цитоплаз-матическим соотношением, ядра округлые, видны 1-2 нуклеолы, цитоплазма умеренно базофильная, не содержит включений. Цитохимические реакции на пероксидазу, липиды и неспецифическую эстеразу отрицательные, гликоген в части клеток в слабодиффузной и диффузно-гранулярной формах. Иммунофенотип: бластные клетки CD45low экспрессируют антигены CD123, CD56, CD7, CD33, CD117low; экспрессия cyCD3 слабее, чем на лимфоцитах CD45++, что не позволяет диагностировать Т-ОЛЛ. Полученные данные более соответствуют бластной плазмоцитоидной дендритно-клеточ- ной опухоли. Цитогенетическое исследование клеток костного мозга от 18.02.22 г: кариотип – 45,ХY, add(1)(p36), del(3)(p25), der(8), der(9), del(12)(p13), add(12)(p11) или t(3;12)(p25;p11), -13, der(17) (рис. 2).
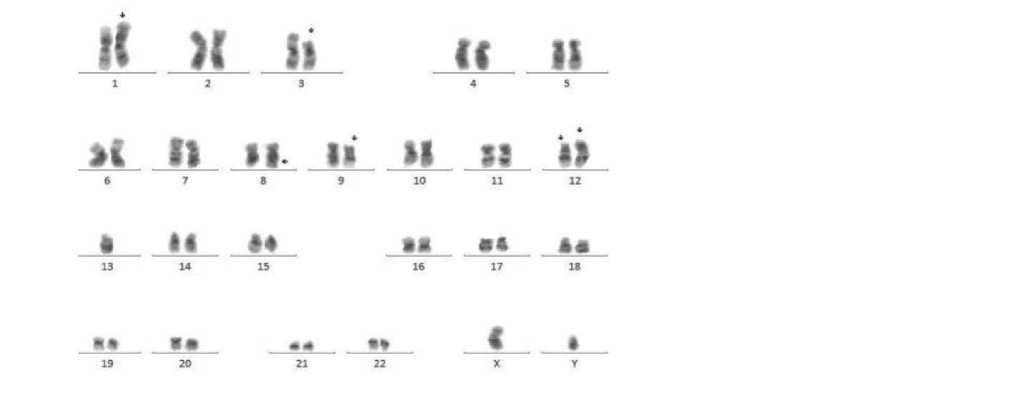
Рис .2. Результат стандартного цитогенетического исследования : Кариотип : 45, Х Y, add(1) (p36), del(3)(p25), der(8), der(9), del(12)(p13), add(12)(p11) or t(3;12)(p25;p11), -13, der(17)
В результате проведенных исследований (методом стандартного цитогенетического исследования и FISH) выявлены клон и субклон. Клон с деле-цией локуса гена ETV6/12р13 и делецией региона 13q14; субклон с комплексными изменениями кариотипа: дериватами хромосом 1, 8, 9, 12, 17, деле-цией короткого плеча хромосомы 3, биаллельной делецией локуса гена ETV6/12р13, делецией локуса гена ABL/9q34; моносомией по хромосоме 13.
Заключение: опухоль из бластных плазмоци-тоидно-дендритных клеток. С 18.02.22 начата 1-я фаза индукции по программе «ОЛЛ-2009» (преднизолон 60 мг/сутки внутрь 1-19 дни, даунорубицин 60 мг в/в в 8-й день, винкристин 2,0 мг в/в в 8-й день) на фоне аллопуринола, стандартной инфузионной, антиэметической и гемозаместительной терапии. На 10-й день курса выполнена контрольная стернальная пункция, в миелограмме от 28.02.22 бластные клетки – 11,8 %. Терапию перенес без осложнений. Проводилась антибактериальная (це-фепим), противогрибковая (флуконазол), гемостатическая (этамзилат, транексам), заместительная гемотрансфузионная (19 л.д. тромбоконцентрата, 10 доз эритроцитной массы). Лечение продолжено. В рамках протокола «ОЛЛ-2009» (I фаза индукции) выполнены введения химиопрепаратов (винкри-стин 2,0 мг в/в струйно 15-й и 21-й дни, даунору-бицин 90 мг в/в капельно 15-й и 21-й дни) на фоне аллопуринола, стандартной инфузионной, антиэ-метической и гемозаместительной (5 доз СЗП, 1 л.д. тромбоконцентрата) терапии. Пациент в удовлетворительном состоянии выписан на амбулаторное долечивание под наблюдение гематолога по месту жительства до следующего введения химиопрепаратов. Через 2 месяца от начала лечения констати- рована полная ремиссия заболевания.
В дальнейшем лечение по протоколу было продолжено. В рамках протокола «ОЛЛ-2009» (индукция II) выполнены введения химиопрепаратов (ци-клофосфан 1800 мг в/в струйно 43-й день, цитозар 100 мг в/в капельно 45-48-й дни, аспарагиназа 10 тыс Ед в/в капельно 50-й и 57-й дни, меркаптопурин 50 мг внутрь 43-57-й дни) на фоне аллопуринола, стандартной инфузионной, антиэметической и гемозаместительной (2 дозы СЗП) терапии. В рамках протокола «ОЛЛ-2009» с 10.05.22 по 17.05.22 (индукция II) выполнены введения химиопрепаратов (цитозар 100 мг в/в капельно 59-62-й дни, аспарагиназа 10 тыс. Ед в/в капельно 64-й день, меркаптопурин 50 мг внутрь 59-65-й дни) на фоне аллопуринола, стандартной инфузионной терапии. Пациент в удовлетворительном состоянии был выписан на амбулаторное долечивание под наблюдение гематолога по месту жительства до следующего введения химиопрепаратов.
При поступлении в мае 2022 г. жалобы на головокружение, головные боли, неустойчивость при ходьбе. В миелограмме 26.05.2022: костномозговой пунктат скудной клеточности, полиморфный, бластов 1,2 %. Сохраняется костномозговая ремиссия. FISH-исследование на суспензии клеток спинномозговой жидкости 27.05.2022: в 94 % ядер отсутствует один сигнал от локуса гена ETV6(12p13), делеция короткого плеча хромосомы 12. FISH-исследование на суспензии клеток костного мозга 30.05.2022: транслокация t(12;21)(р13;q11), деле-ция короткого плеча хромосомы 12 не выявлены. Цитохимическое исследование костного мозга 31.05.2022: сидеробласты ниже нормы, кольцевидные сидеробласты не обнаружены. Положительные реакции на миелопероксидазу и гликоген в клетках эритроидного ряда указывают на цитохимические признаки дисэритропоэза. При контрольной люмбальной пункции выявлены признаки нейролейкемии. Выполнено 9 люмбальных пункций с целью санации ликвора с положительной динамикой (1-ая пункция 26.05.22: цитоз 11200 кл/3мкл, бластных клеток 100%, лейкоциты – 70-80 в поле зрения (п/зр; 9-я пункция 23.06.22: цитоз 17/3 кл/3мкл, бластных клеток – 1 клетка, лейкоциты – единичные, лимфоциты – 12 клеток, макрофаги – 2 клетки, моноциты – 1 клетка, нейтрофилы – 1). С 08.06.22 по 21.06.22 проведена консолидация I в рамках протокола «ОЛЛ-2009» (дексаметазон 12 мг 1 р/сут. в/в капельно 14 дней, винкристин 2 мг 1 раз/сут. в/в струйно в 1-й день, 14-й день, доксорубицин 50 мг в/в капельно 1 раз/сут. в 1-й и 14-й дни). Пациент в удовлетворительном состоянии был выписан на амбулаторное долечивание под наблюдение гематолога по месту жительства до следующего введения химиопрепаратов.
При поступлении в июле 2022 г. жалобы на общую слабость, головные боли при перемене положения тела. В миелограмме 08.07.2022: костномозговой пунктат скудной клеточности, полиморфный, бластов – 1,6 %. FISH-исследование на суспензии клеток костного мозга 08.07.2022: в 4 % ядер выявлена делеция короткого плеча хромосомы 12. При контрольной люмбальной пункции констатирован нейролейкоз, ликвор санирован. Выполнено 5 люмбальных пункций с целью санации ликвора с положительной динамикой (1-ая пункция 08.07.22 г.: цитоз 42/3, бластных клеток 17%, лейкоциты – 1-1-2 в п/зр., белок-2,35 г/л; 5-я пункция 20.07.22: цитоз 6/3 клеток, бластных клеток – отр., лейкоциты – единич., лимфоциты – 4 кл., макрофаги – 1кл., нейтрофилы – 1 кл.). Проведена консолидация II в рамках протокола «ОЛЛ-2009» без осложнений. Состояние больного улучшилось.
Госпитализация в августе 2022 г. При поступлении жалобы на общую слабость, головные боли при перемене положения тела. Выполнена люмбальная пункция с интратекальным введение препаратов, ликвор в норме (бесцветный, цитоз 8/3, нейтрофилы – 6, лимфоциты – 2). В миелограмме 08.08.2022: костномозговой пунктат гипоклеточный, полиморфный, бластов – 1,0 %. FISH-исследование на суспензии клеток костного мозга 08.08.2022г.: де-леция короткого плеча хромосомы 12 не выявлена. В рамках протокола «ОЛЛ-2009» (консолидация III) введены: циклофосфан 1400 мг, цитозар 150 мг в/в капельно 1-4-й дни, принимал 6-меркаптопурин. В удовлетворительном состоянии выписан на перерыв в химиотерапии под наблюдение гематолога по месту жительства. При поступлении в сентябре 2022 г. жалобы на общую слабость, головные боли при перемене положения тела. Ликвор от 05.09.22: бесцветный, цитоз 2816/3, бластные клетки 100
%, ликвор от 14.09.22 г.: бесцветный, прозрачный, цитоз-5/3, бластные клетки – 60 %. Пациенту выполнены 5 люмбальных пункций с интратекаль-ным введением препаратов без эффекта. В связи с чем после завершения консолидации III в рамках протокола «ОЛЛ-2009» было показано проведение дистанционной лучевой терапии на весь объем головного мозга (СОД 25 Гр). Лучевая терапия выполнена в полном объеме. С заместительной целью перелито: тромбоконцентрата 5 л.д., эритроцитной массы 1 доза.
При поступлении в октябре 2022 г. жалобы на общую слабость, головные боли. В миелограм-ме 18.10.2022: костномозговой пунктат нормоклеточный, полиморфный, бластов 3,6 %. FISH-исследование на суспензии клеток костного мозга 18.10.2022: в 1,2 % ядер выявлена делеция короткого плеча хромосомы 12. Пациенту выполнено 4 люмбальных пункции с интратекальным введением препаратов (ликвор от 19.10.22: бесцветный, ци-тоз 18/3, бластные клетки 80 %, ликвор от 31.10.22 г.: бесцветный, прозрачный, цитоз 1/3, нейтрофилы – 1 клетка). Нейролейкоз сохранялся. В рамках протокола «ОЛЛ-2009» (консолидация V) введены цитозар 4 г в/в кап 25.10.22, аспарагиназа 10 тыс Ед в/в капельно 27.10.22, дексаметазон 40 мг в/в кап 25.10-27.10.2022. В удовлетворительном состоянии выписан на перерыв в химиотерапии под наблюдение гематолога по месту жительства.
На основании имеющихся данных сформулирован диагноз: Основное заболевание: Бластная плазмоцитоидная дендритно-клеточная неоплазия от 02.2022. Гиперлейкоцитоз. Индукционная терапия: «ОЛЛ-2009». Ремиссия от 05.04.22. Изолированный внекостномозговой (ЦНС) рецидив I (май 2022 г.). Санация ликвора (07.22 г.). Изолированный внекостномозговой (ЦНС) рецидив II (сентябрь 2022 г.). Дистанционная лучевая терапия на весь объем головного мозга (СОД=25 Гр). Осложнения основного заболевания: Постцитостатическая панцитопения. Анемия 2 ст. Тромбоцитопения 3 ст. Сопутствующие заболевания: ИБС. Диффузный кардиосклероз. Желудочковая экстрасистолия. Гипертоническая болезнь 2 стадии (медикаментозная нормотензия, риск ССО 4). ХСН I ст. ФК – 2 (NYHA).
Заключение
В качестве резюме можно констатировать, что мы наблюдаем пациента с редким заболеванием, имеющим клинико-гематологическую картину, идентичную острой лейкемии. Обусловлен и выбор программы лечения, применяющейся при остром лимфобластном лейкозе. Можно констатировать успех первого этапа лечения, быстрое достижение полной клинико-гематологической ремиссии. Однако, она была короткой. Возник рецидив заболевания в виде нейролейкемии, которая затем рецидивировала повторно. Неэффективность кур- сов противоопухолевой химиотерапии привела к проведению дистанционной лучевой терапии на весь объем головного мозга. Проводится дальнейшее лечение пациента. Накопление информации об этой редкой нозологической форме может привести к формированию стандартных терапевтических подходов и к улучшению результатов лечения пациентов.
Список литературы Бластная плазмоцитоидная дендритно-клеточная неоплазия - диагностика и результаты первого и второго этапа лечения(клиническое наблюдение)
- Suzuki Y., Kato S., Kohno K. et al. Clinicopathological analysis of 46 cases with CD4 + and/or CD56 + immature haematolymphoid malignancy: reappraisal of blastic plasmacytoid dendritic cell and related neoplasms // Histopathology. - 2017. - Vol. 71, No. 6. - Р. 972-984.
- Riaz W., Zhang L., Horna P. et al. Blastic plasmacytoid dendritic cell neo-plasm: update on molecular biology, diagnosis, and therapy // Cancer Control. - 2014. - Vol. 21, No. 4. - P. 279-289.
- Rauh M.J., Rahman F., Good D. et al. Blastic plasmacytoid J dendritic cell neo-plasm with leukemic presentation, lacking cutaneous involvement: case series and literature review // Leuk Res. - 2012. - Vol. 36, No.1. - P. 81-86.
- Cheng W., Yu T., Tang A.-P. et al. Blastic Plasmacytoid Dendritic Cell Neoplasm: Progress in Cell Origin, Molecular Biology, Diagnostic Criteria and Therapeutic Approaches // Curr Med Sci. - 2021. - Vol. 41, No. 3. - P. 405-419.
- Kharfan-Dabaja M.A., Lazarus H.M., Nishihori T. et al. Diagnostic and therapeutic advances in blastic plasmacytoid dendritic cell neoplasm: a focus on hematopoietic cell transplantation // Biol Blood Marrow Transplant. - 2013. - Vol. 19, No. 7. - P. 1006-1012.
- Kopeczi J., Benedek E., Kakucs E.et al. Blastic plazmacytoid dendritic cell neoplasia - a rare type of acute leukemia// Revista Romana de Medicina de Laborator. - 2014. - Vol. 22, No.1. - P. 69-77.
- Валиев Т.Т., Серегин Г.З., Серебрякова И.Н. и др. Опухоль из бластных плазмоцитоидных дендритических клеток // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2019. - Т. 18, № 4. - С.79-89.


