Физиологические особенности роста и развития поросят разных генотипов по генам FUT1 и MUC4
Автор: Закирова А.В., Ткачев А.В., Нотина Е.А., Быкова И.А., Ткачева О.Л.
Рубрика: Зоотехния
Статья в выпуске: 4 т.264, 2025 года.
Бесплатный доступ
ДНК-технологии дают возможность реализовать принципиально новые подходы в селекции животных. Прежде всего это генетическая идентификация конкретных особей с последующим генетико-популяционным анализом, обеспечивающим получение количественных характеристик генофондов исследуемых популяций. Целью исследования было установить физиологические особенности роста и развития поросят разных генотипов по генам FUT1 и MUC4 при добавлении витаминной подкормки. Исследования выполняли с 2023 по 2024 гг. В работе использовали 88 поросят крупной белой породы в период от рождения до отъёма. Животные были разделены на 6 групп. Поросята в каждой группе взвешивались в первый день жизни, на 3 сутки, и затем через каждые 3 суток до возраста 21 день. Наибольшая живая масса была у поросят с генотипом АА/GG (FUT1/MUС4), потом следовали особи с генотипом АG/GС (FUT1/MUС4) кроме третьей группы, и наименьшая живая масса была у поросят с генотипом GG/СС (FUT1/ MUС4). В третьей группе животных максимальная живая масса была более 5860 г у генотипа АА/GG (FUT1/MUС4), что на 352,1 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 676,6 г больше (р<0,001) генотипа АG/GС (FUT1/MUС4). В четвертой группе поросят максимальная живая масса была более 5710 г у генотипа АА/GG (FUT1/MUС4), что на 681,53 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 153 г больше генотипа АG/GС (FUT1/MUС4). Таким образом, полученные результаты указывают на то, что генотипирование поросят по генам FUT1 и MUС4 может быть использовано не только для определения устойчивости к кишечным инфекциям, но и для прогнозирования физиологических особенностей роста и развития на ранних стадиях онтогенеза.
Полиморфизм генов, кормление, подсосный период, FUT1, MUC4
Короткий адрес: https://sciup.org/142246750
IDR: 142246750 | УДК: 619:636.4.033:575.22 | DOI: 10.31588/2413_4201_1883_4_264_90
Текст научной статьи Физиологические особенности роста и развития поросят разных генотипов по генам FUT1 и MUC4
Исследование животных по генам количественных признаков (Quantitative Trait Loci) дает возможность предсказывать хозяйственную ценность животного на уровне ДНК в раннем возрасте и даже еще до его рождения. В связи с этим крайне интересно изучить особенности роста и развития поросят при выпаивании только молозивом от родных свиноматок; выпаивании молозивом и молоком родной свиноматки в течение 21 дня на фоне внутримышечных инъекций (в срединную треть шеи) витаминного раствора «Элеовит»; и при вскармливании поросят мачехой. Высокая конечная живая масса поросят не всегда сопровождается высокой интенсивностью роста, что и может зависеть не только от генотипа, но и от технологических условий выращивания, что и требует дополнительного изучения [3, 4].
Изучение поголовья поросят по хозяйственно-полезным признакам всегда будет актуальным и важным для практического свиноводства, так как позволяет лучше понять механизмы взаимоотношений генотип-среда и предложить новые технологические подходы в выращивании животных [5, 6].
Изучение особенностей генотипа поросят по гену альфа-(1,2)-фукозилтрансферазы-1 (FUT1) может иметь значение не только для установления устойчивости к болезням [7], но и возможно связано с интенсивностью роста и развития в подсосный период.
Доказанная связь аллелей поросят по гену FUT1 с устойчивостью к колибактериозу позволила разработать различные методики экс-пресс-диагностики прогнозирования устойчивости поросят к инфекции. Практическое применение новых методик экспресс-диагностики может помочь вовремя элиминировать из стада животных склонных к болезням, а значит эти особи могут обладать меньшей энергией роста и развития, что и требует дополнительного изучения [8].
Энтеротоксические E. coli , образующие фимбрии F4 (K88) чаще всего являются теми бактериями, которые вызывают диарею и смерть новорожденных и отлученных поросят. Е. coli с адгезивным антигеном F4 вызывают в 71% случаев диарею новорожденных поросят. Известны три антигенных варианта фимбрий F4-F4ab, F4ac и F4ad. Согласно данным анализа сцепления генов F4ab/F4ac было выявлено полное соответствие их гаплотипов гаплотипа сиалогликопротеина муцина 4 (MUC4) [9, 10].
Научно доказано, что ген муцина 4 расположен в 13-й хромосоме в 41-м регионе. И некоторые авторы предположили, что единичные мутации гена муцина 4 в позиции 1849 п.н. могут быть связаны с хозяйственнополезными признаками у поросят [11].
Цель исследований - установить физиологические особенности роста и развития поросят разных генотипов по генам FUT1 и MUC4 при добавлении витаминной подкормки.
Условия, материалы и методы. Исследования выполняли с 2023 по 2024 годы в Московской области на свиноферме ООО «Чароен Покпанд Фудс» Луховицкого района и в КФХ деревни Кулаково городского округа Чехов. В работе использовали 88 поросят крупной белой породы в период от рождения до отъёма. Животные были сгруппированы в 6 групп: 1 группа – 16 голов, 2 группа – 19 голов, 3 группа – 19 голов, 4 группа – 12 голов, 5 группа – 12 голов, 6 группа – 14 голов. Поросята в каждой группе взвешивались в первый день жизни, на 3 сутки, и затем через каждые 3 суток до возраста 21 день. В первой и во второй группах поросят выпаивали только молозивом от родных свиноматок. В третьей и четвертой группах поросята выпаивались молозивом и молоком родной свиноматки в течение 21 дня на фоне внутримышечных инъекций (в срединную треть шеи) витаминного раствора «Элеовит» в объёме 0,5 мл один раз каждые семь день. В пятой и шестой группах поросята были переведены к мачехе на 3 день её лактации.
В возрасте 21 дня от каждого поросенка была взяты пробы крови и щетины для генотипирования по генам FUT1 и MUС4. После генотипирования проводился анализ особенностей роста и развития поросят в разрезе исследуемых генов в каждой группе отдельно.
Кровь для исследования отбирали из ушной вены, используя одноразовые системы для взятия крови, одноразовой иглой в объеме 2-3 мл в стерильную пробирку с антикоагулянтом (6% раствор ЭДТА в соотношении 1:19 или 4% раствор цитрата натрия в соотношении 1:9). Закрытую пробирку с кровью несколько раз встряхивали для равномерного смешивания с антикоагулянтом. На пробирки наносили соответствующие записи для дальнейшей идентификации образцов. Пробирки транспортировали в тот же день в термоконтейнерах при температуре 5±3°С в лабораторию ООО НИЦ «Черкизово». В лаборатории содержимое пробирок высушивали на стерильной марлевой ткани в течение 1 суток в поле ламинарного потока воздуха. Высушенные образцы переносили в стерильные пакеты типа "Ziplock". На пакеты наносили соответствующие записи для дальнейшей идентификации образцов.
Щетину отбирали из холки животных с помощью пинцета в стерильные пакеты типа "Zip-lock". На пакеты наносили соответствующие записи для дальнейшей идентификации образцов. Полученные образцы к моменту проведении исследований хранили в холодильнике при температуре 5±3°С. Транспортировку осуществляли в термоконтейнерах при температуре 5±3°С.
Для выделения ДНК из биопроб с помощью ионообменной смолы Chelex-100 [CAS: 68954-42-7 Chelex-100] готовят 5% рабочий раствор этого реагента. В мерной колбе объемом 100 мл вносят 5 г Chelex-100 и добавляют дистиллированной воды до объема 100 мл. В одноразовые полипропиленовые пробирки Eppendorf объемом 1,5 мл вносят 1000 мкл стерильной дистиллированной воды. К пробиркам добавляют пробы, объемом не более 200 мкл. Смесь инкубируют 15 минут при температуре 18-25°С. Пробирки центрифугируют 1 минуту на скорости 8 тысяч об/минуту. После отделения осадка осторожно удаляют надосадочную жидкость, оставляя около 20 мкл жидкости над осадком. Центрифугирование образца проводят несколько раз до полного обесцвечивания осадка. К пробиркам добавляют 180 мкл 5% стерильного водного раствора Chelex-100 и инкубируют в течение 30 минут при 56°С на термостате. Затем содержимое пробирки перемешивают и центрифугируют 1 минуту на скорости 8 тыс. об/ минуту. Для амплификации используют 5 мкл надосадочной жидкости, содержащей ДНК. Раствора выделенной ДНК достаточно для проведения 20-100 амплификаций. Хранить образцы при минус 20°С в течение 6 месяцев. После каждого размораживания образцы встряхивают и центрифугируют 5 минут на скорости 6 тысяч об/минуту (Минакова Н. Геномные технологии для животноводства / Н. Минакова // Наука и инновации. 2021. № 8 (222). С. 4-8).
Последовательность праймеров: FUT1 — F: 5/-
CCAACGCCTCCGATTCCTGT-3/,
FUT1 — R: 5/-
GTGCATGGCAGGCTGGATGA-3/.
MUC4 — F: 5/-
GTGCCTTGGGTGAGAGGTTA-3/,
MUC4 — R: 5/-
CACTCTGCCGTTCTCTTTCC-3/.
Математико-статистические расчеты результатов физиологических показателей роста и развития поросят осуществляли по критерию Стьюдента в SPSS for Windows (IBM, USA).
Результаты и обсуждение. Изучение физиологических особенностей роста и развития поросят удобнее всего охарактеризовать изучением динамики живой массы в процессе выращивания. Поэтому в первую очередь мы провели анализ динамики живой массы поросят только в разрезе групп без учета их генотипа по генам FUT1 и MUС4. Полученные результаты представлены на рисунке.
Анализ данных рисунка мы начнем с оценки интенсивности роста поросят в группах. За 21 день выращивания наиболее интенсивно росли поросята второй группы, так как их живая масса увеличилась в 4,52 раза. Затем следовала шестая группа поросят, масса которых с рождения до 21 суток увеличилась в 4,4 раза. В четвертой группе масса поросят увеличилась в 4,27 раз к завершению В третьей группе поросят их живая масса уве-периода наблюдения с момента рождения. личилась в 3,98 раза.
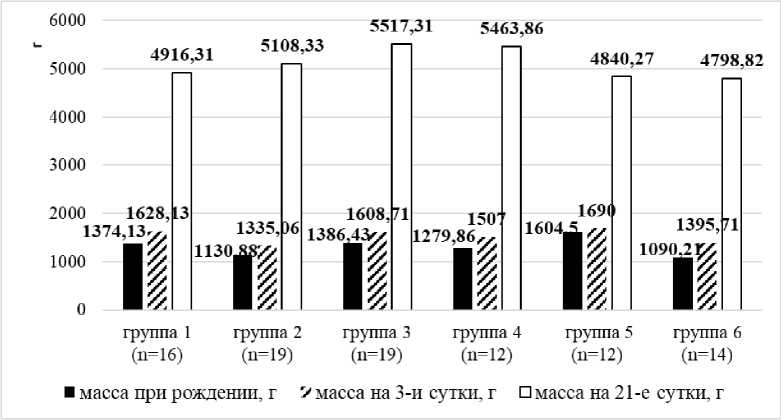
Рисунок - Динамика живой массы поросят без учета особенностей их генотипа
Средняя живая масса поросят первой группы увеличилась в 3,58 раза. Наименьшая интенсивность роста наблюдалась нами в пятой группе животных, так как их живая масса увеличилась за 21 день только в 3,02 раза. Получается, что максимальная интенсивность роста поросят в группах животных не сопровождалась максимальной живой массой в группах на момент завершения эксперимента.
Максимальная живая масса поросят на 21 сутки выращивания наблюдалась нами в третьей группе, которая занимала лишь 4 место по интенсивности роста, и составила 5517 г, что на 53,45 г больше поросят четвертой группы (3 место по интенсивности роста).
Третья группа поросят превосходила живую массу второй группы на 409 г, у которой была наилучшая интенсивности роста. Максимальная живая масса поросят третьей группы была больше шестой группы (у которой была 2-я интенсивность роста) животных на 718,5 г (р<0,05). Поросята первой и пятой групп также уступали (р<0,05) животным третьей группы по показателю максимальной живой массы на 601 и 677 г соответственно.
На следующем этапе нашего исследования изучались физиологические особенности изменений в живой массе поросят в зависимости от генотипа по генам FUT1 и MUС4 (табл.).
Таблица - Физиологические особенности живой массы поросят разных генотипов по генам FUT1 и MUС4
|
Показатель |
Группа |
|||||
|
1 |
2 |
|||||
|
Генотип по FUT1 |
GG |
AA |
AG |
GG |
AA |
AG |
|
Генотип по MUC4 |
CC |
GG |
GC |
CC |
GG |
GC |
|
Живая масса при рождении, г |
1404,38 ±52,54 |
1297,6 ±53,68 |
1421,0 ±5,7 |
1059,5 ±19,5*** |
1228,8 ±37,7 |
1081,75 ±37,9*** |
|
Живая масса на 3 сутки, г |
1608,0 ±59,9 |
1546,4 ±69,03 |
1818,0 ±46,61 |
1559,0 ±31,0 |
1299,2 ±85,3* |
1316,9 ±48,02*** |
|
Живая масса на 9 сутки, г |
2245,25 ±119,9 |
2364,2 ±126,59 |
2332,7 ±106,73 |
2749,0 ±322,0** |
2617,2 ±87,1* |
2782,5 ±81,9** |
|
Живая масса на 21 сутки, г |
4724,25 ±44,92 |
5196,2 ±59,68 |
4962,0 ±17,62 |
4918,5 ±24,5* |
5293,8 ±51,1 |
5039,9 ±32,39 |
|
Показатель |
Группа |
|||||
|
3 |
4 |
|||||
|
Генотип по FUT1 |
GG |
AA |
AG |
GG |
AA |
AG |
|
Генотип по MUC4 |
CC |
GG |
GC |
CC |
GG |
GC |
|
Живая масса при рождении, г |
1306,0 ±63,49 |
1522,25 ±103,4 |
1311,5 ±70,4 |
1306,5 ±36,06 |
1254,8 ±38,89** |
1298,0 ±29,3 |
|
Живая масса на 3 сутки, г |
1593,2 ±74,22 |
1626,0 ±94,35 |
1575,3 ±104,32 |
1525,67 ±76,11 |
1534,0 ±77,05 |
1539,5 ±127,41 |
|
Живая масса на 9 сутки, г |
2850,2 ±135,7 |
2821,5 ±61,9 |
2812,75 ±105,44 |
2756,17 ±66,45 |
2811,2 ±137,99 |
2795,0 ±200,74 |
|
Живая масса на 21 сутки, г |
5508,2 ±32,34 |
5860,3 ±55,6 |
5185,7 ±83,37 |
5034,67 ±98,15*** |
5716,2 ±111,3 |
5563,2 ±125,18** |
Продолжение Таблицы
|
Показатель |
Группа |
|||||
|
5 |
6 |
|||||
|
Генотип по FUT1 |
GG |
AA |
AG |
GG |
AA |
AG |
|
Генотип по MUC4 |
CC |
GG |
GC |
CC |
GG |
GC |
|
Живая масса при рождении, г |
1645,0 ±175,0 |
1575,33 ±48,67 |
1698,17 ±107,66 |
1043,5 ±144,5*** |
1012,67 ±9,39*** |
1132,0 ±45,68*** |
|
Живая масса на 3 сутки, г |
1683,5 ±79,5 |
1699,67 ±54,91 |
1708,33 ±134,31 |
1491,5 ±18,5* |
1375,0 ±56,71* |
1342,83 ±63,42* |
|
Живая масса на 9 сутки, г |
2381,5 ±97,5 |
2497,6 ±205,96 |
2304,5 ±83,61 |
2317,0 ±120,0 |
2180,0 ±73,7* |
2242,33 ±24,03 |
|
Живая масса на 21 сутки, г |
4488,5 ±12,5 |
5131,0 ±126,51 |
4812,17 ±21,12 |
4642,5 ±48,5* |
4934,33 ±14,68 |
4783,17 ±25,02 |
Примечание: * -р<0,05, ** -р<0,01, *** -р<0,001, 2-я группа в сравнении с 1-й, 4-я группа в сравнении с 3-й, 6-я группа в сравнении с 5-й группой.
Анализ данных таблицы позволяет заключить, что даже при одинаковом генотипе по генам FUT1 и MUС4 живая масса поросят имела достоверные различия как при рождении, так и в процессе выращивания.
Таким образом, полученные данные прямо указывают на факт того, что условия кормления поросят до отъёма существенно сказывались на интенсивности роста особей с одинаковыми аллелями по генам FUT1 и MUC4.
После проведения анализа физиологических особенностей динамики изменения живой массы поросят в зависимости от аллелей по генам FUT1 и MUС4 выяснилось, что наибольшая живая масса была у поросят с генотипом АА/GG (FUT1/MUС4). Второе место занимали особи поросят с генотипом АG/ GС (FUT1/MUС4) кроме третьей группы. Наименьшую живую массу в нашем исследовании мы установили у поросят с генотипом GG/СС (FUT1/MUС4). В третьей группе животных, которой добавляли инъекции препарата «Элеовит», максимальная живая масса была более 5860 г у генотипа АА/GG (FUT1/ MUС4), что на 352,1 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 676,6 г больше (р<0,001) генотипа АG/GС (FUT1/ MUС4). В четвертой группе поросят, которой добавляли инъекции препарата «Элеовит», максимальная живая масса была более 5710 г у генотипа АА/GG (FUT1/MUС4), что на 681,53 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 153 г больше генотипа АG/ GС (FUT1/MUС4). В пятой и шестой группе поросят, которых на третий день перевели к мачехе, максимальная живая масса на 21 сутки выращивания была 5131 и 4934 г соответственно у генотипов АА/GG (FUT1/MUC4).
Таким образом, нами показаны функциональные особенности влияния условий кормления поросят крупной белой породы разных генотипов по генам FUT1 и MUС4 как на конечную живую массу, так и на интенсивность роста животных в подсосный период. Более высокая интенсивность роста и развития может наблюдаться у групп поросят с меньшей живой массой на момент отъема и с меньшей живой массой на момент рождения.
Выводы. Установлены физиологические особенности интенсивности роста и развития поросят разных генотипов по генам FUT1 и MUС4. После проведения анализа физиологических особенностей динамики изменения живой массы поросят в зависимости от аллелей по генам FUT1 и MUС4 выяснилось, что наибольшая живая масса была у поросят с генотипом АА/GG (FUT1/MUС4), потом следовали особи с генотипом АG/GС (FUT1/MUС4) кроме третьей группы, и наименьшая живая масса была у поросят с генотипом GG/СС (FUT1/MUC4).
Таким образом, полученные результаты указывают на то, что генотипирование поросят по генам FUT1 и MUС4 может быть использовано не только для определения устойчивости к кишечным инфекциям, но и для прогнозирования физиологических особенностей роста и развития на ранних стадиях онтогенеза.


