Гистоструктура внутренних органов белых крыс при отравлении глифосатом на фоне лечения антитоксическими средствами
Автор: Галяутдинова Г.Г., Мишина Н.Н., Губеева Е.Г., Маланьев А.В., Выштакалюк А.Б.
Рубрика: Ветеринария
Статья в выпуске: 2 т.262, 2025 года.
Бесплатный доступ
Глифосат (N-(фосфонометил)-глицин) – системный гербицид сплошного действия для обработки вегетирующих растений. В России используются 40 тыс. тонн гербицидов на основе глифосата и обрабатываются 19 млн. га посевных площадей. Гербицид подавляет синтез ароматических аминокислот в результате ингибирования фермента – 5-энолопирувил-шикимат-3 -фосфатсинтетазы. Однако, помимо солей глифосата, коммерческие составы глифосата содержат добавки (известные как адъюванты), такие как поверхностно-активные вещества, которые различаются по природе и концентрации. Поверхностно-активные вещества, такие как полиэтоксилированный талловый амин (РОЕА), добавляются в глифосат для смачивания листьев и проникновения в кутикулу растений. Поверхностно-активные вещества в составе глифосата могут повышать относительную острую токсичность. Зарубежные исследователи доказали, что глифосат оказывает токсическое воздействие на печень и почки, вызывает окислительный стресс, снижает содержание витамина D в организме, что в конечном итоге приводит к фиброзному замещению и отмиранию тканей, нарушению функций клеточных мембран и к ишемии. Целью исследований стала оценка воздействия гербицида глифосата в дозе 5 ПДК на внутренние органы белых крыс на фоне лечения антитоксическими средствами. Результаты анализа показали, что отравление белых крыс глифосатом из группы гербицидов на уровне 5 ПДК оказывало значительное влияние на их внутренние органы. У опытных животных нарушалась гемоциркуляция, гемореология. Проявлялись некробиотические изменения, местами с признаками воспалительной клеточной реакции, межуточными отеками и десквамацией эпителия канальцев. Исходя из полученных данных, можно сделать вывод, что из изученных антитоксических средств при отравлении данным пестицидом наиболее положительный эффект на состояние внутренних органов оказал ксимедон-С, менее результативным был экспериментальный образец на основе тетраазатрициклосоединения (ТА) и практически не проявил лечебного действия – сульфид натрия.
Белые крысы, глифосат, гистоструктура внутренних органов, лечение, антитоксические средства
Короткий адрес: https://sciup.org/142246118
IDR: 142246118 | УДК: 619:615.9:615.3:636.932 | DOI: 10.31588/2413_4201_1883_2_262_6
Текст научной статьи Гистоструктура внутренних органов белых крыс при отравлении глифосатом на фоне лечения антитоксическими средствами
Широкое использование гербицидов на основе глифосата несет серьезную угрозу для здоровья людей и животных. Так, наличие в корме даже предельно допустимой концентрации глифосата оказывает негативное действие на физиологическое состояние и продуктивность сельскохозяйственных животных. На сегодняшний день назрела необходимость привлечения внимания к проблеме присутствия глифосатсодержащих препаратов в кормах и минимизации их негативного воздействия на здоровье и продуктивность сельскохозяйственных животных путем применения антитоксических средств [6, 7, 8]. Поэтому особое значение приобретает разработка и изучение эффективности новых средств, обладающих патогенетическим и симптоматическим действием, способствующих нейтрализации ядов и выведении их из организма [9, 10].
Целью исследований стала оценка воздействия гербицида глифосата в дозе 5 ПДК на внутренние органы белых крыс на фоне лечения антитоксическими средствами.
Условия, материалы и методы. Исследования проводили в условиях вивария лаборатории фармакологии лекарственных средств ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности». Научный городок-2, г. Казань, Республика Татарстан. Гербицид – Аристократ, ВР (д.в. глифосата кислоты в виде изопропиламинной соли 480 г/л) добавляли в основной рацион путем последовательного перемешивания с расчетом 15 мг/кг корма (по действующему веществу), что равнялось 5 ПДК. На фоне действия гербицида использовали следующие антитоксические средства:
конъюгат Ксимедона с L-аскорбиновой кислотой (КС); натрия сульфид (НС); ТА (экспериментальный образец на основе тетраазатрициклосоединения).
Опыты проводили на 30 белых крысах обоего пола весом от 200 г до 220 г. Изучение антитоксического действия средств при отравлении крыс глифосатом проводили на 5 группах крыс по 6 особей в каждой. Первая группа – биологический контроль (БК); вторая – токсический контроль (ГЛ); третья (ГЛ+КС) – глифосат с кормом и ксимедон с L-аскорбиновой кислотой в виде 0,05 % раствора с водой; четвертая (ГЛ+ТА) – наряду с гербицидом, с питьевой водой вводили 0,05 % водный раствор экспериментального образца на основе тетраазатрициклосоединения; пятая с глифосатом (ГЛ+НС) получала с кормом натрия сульфид в дозе 10 мг/кг. Продолжительность эксперимента составила 30 дней.
Для выполнения гистологического исследования извлекали кусочки внутренних органов размером 1×1 см, толщиной не более 5-7 мм, которые фиксировали в растворе формалина с массовой долей формальдегида 10%, объем жидкости в десять раз превышал объем фиксируемых образцов. После фиксации проводили обезвоживание объектов и затем заливали их в парафин. Гистосрезы делали на санном микротоме. Окрашивание препаратов осуществляли с помощью гематоксилина Эрлиха и эозина водного. Микрофотосъемку проводили на микроскопе Leica DM 1000 с цифровой камерой Leica DFC 320 (Германия).
Результаты и обсуждение. Патологоанатомические изменения при гистологическом исследовании внутренних органов белых крыс биологического контроля не выявлены (рис. 1).
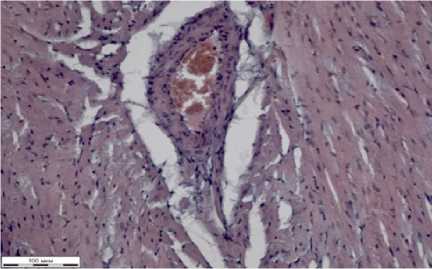
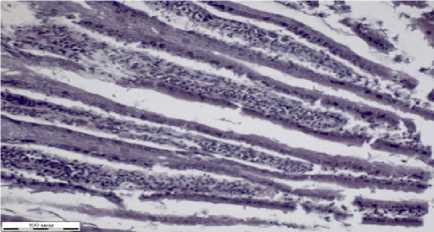
В срезах волокна миокарда ориентированы преимущественно продольно (рис. 1а). Артерии заполнены эритромассами. Структура сосудов определяется четко. В срезах кардиомиоциты разделены тонкими прослойками волокон рыхлой соединительной ткани.
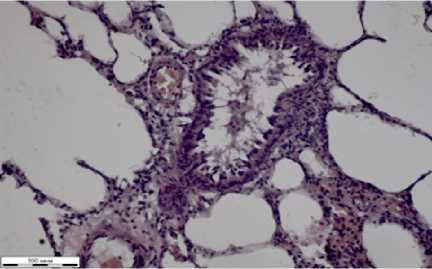
Сосуды в срезах легких неравномерно кровенаполнены (рис. 1б). Они содержат гомогенные эозинофильные массы, эритроциты. Бронхи представлены чаще всего поперечными срезами. Их просветы имели фестончатую форму. В некоторых из них видны эозинофильные массы. Изнутри стенки бронхов покрыты однослойным многорядным цилиндрическим мерцательным эпителием. В собственном слое иногда можно наблюдать продольно направленные эластические волокна. Мышечные волокна располагаются в толще стенок бронхов и имеют четкую структуру. Во всех срезах артериолы имеют свободные просветы, некоторые из них были шире остальных.
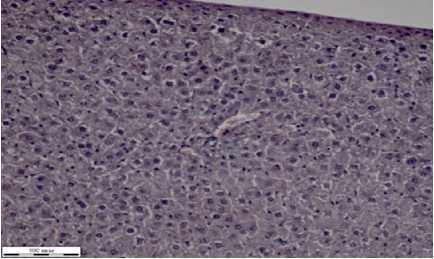
В препаратах печени снаружи определяется капсула, состоящая из волокон плотной соединительной ткани (рис. 1в). Просветы сосудов располагаются преимущественно поперечно и неравномерно заполнены эритромассами, гомогенными эозинофильными массами. Деление на дольки как таковое не определялось, можно наблюдать местами тонкие волокна рыхлой соединительной ткани, более всего заметные в области триад. Тут же просматривается желчный проток, артерия с утолщенной и вена с тонкой стенкой. Центролобулярная вена, содержащая эритромассы, находится в центральной части каждой дольки. Гепатоциты заполнены зернистой цитоплазмой.
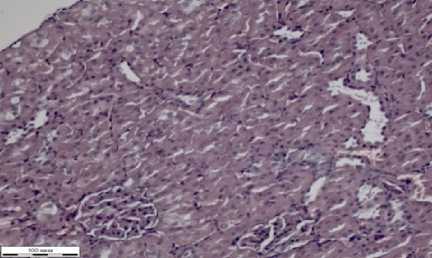
В срезах почки снаружи определяется соединительнотканная капсула (рис. 1г). В коре почек располагаются почечные тельца, которые имеют почти круглую форму. Каждое почечное тельце состоит из капилляров, покрытых мезотелием. Между капсулой и самим клубочком имеется свободное пространство. Проксимальные канальцы располагаются в корковой, их выстилает кубический эпителий, окрашенный эозинофильно. Дистальные канальцы покрыты изнутри более светлым эпителием в сравнении с проксимальными канальцами. Поперечные срезы собирательных трубочек шире, чем просветы канальцев.
В срезах селезенки снаружи определяется тонкая плотная соединительнотканная капсула (рис. 1д). Паренхима состоит из красной и белой пульпы. В красной пульпе видны были скопления эритроцитов. В белой пульпе около сосудов находятся лимфатические клетки, местами с образованием фолликулоподобных структур.
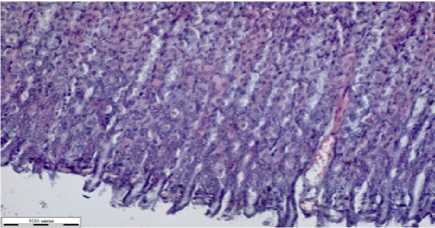
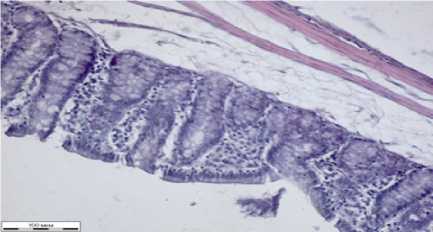
Сосуды тонкого кишечника малокровные, просветы неравномерно заполнены гомогенными эозинофильными и эритромассами (рис. 1ж). Слизистая представлена высокими заостренными ворсинами, покрытыми однослойным каемчатым эпителием. В слизистой встречаются малочисленные бокаловидные клетки со светлым секретом. В собственной пластинке слизистой тонкого кишечника имеются крипты трубчатой формы. Подслизистый слой образован рыхлыми волокнами соединительной ткани. Мышечная стенка тонкого кишечника состоит из внутреннего циркулярного и наружного продольного слоев.
Стенка толстого кишечника состоит из слизистой, подслизистой, мышечной и серозной оболочек (рисунок 1з).
Пространства между криптами заполнены рыхлой волокнистой соединительной тканью.
а
б
в
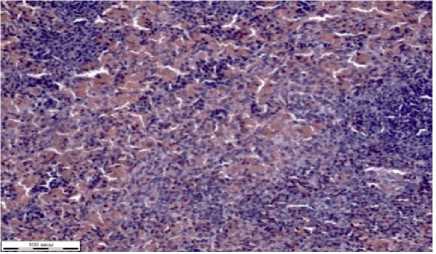
г
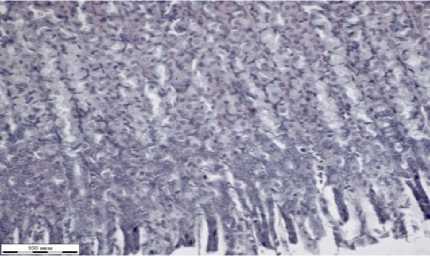
д
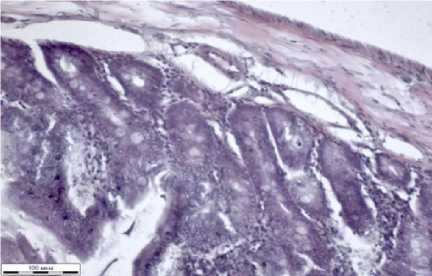
ж
ж – стенка тонкого кишечника; з – стенка толстого кишечника
е
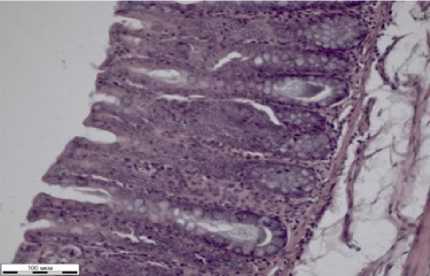
з
Слизистая выстлана однослойным цилиндрическим каемчатым эпителием, в отличие от тонкого кишечника здесь определяется большое количество бокаловидных клеток.
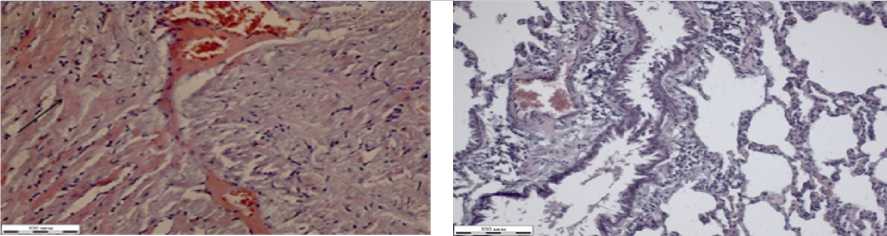
Результаты гистологических исследований внутренних органов белых крыс в группе токсического контроля при отравлении глифосатом в дозе 5 ПДК представлены на рисунке 2. Волокна миокарда в срезах ориентированы преимущественно продольно (рис. 2а).
а
в
б
д
г
ж
е
з
Артерии заполнены гомогенными эозинофильными эритромассами. Стенки артерий утолщены, структура чуть смазана. Вены имеют неравномерно расширенные просветы, некоторые неправильной формы. Стенки вен тонкие. Кардиомиоциты тонкие, расположены на некоторых участках хаотично с переплетением волокон (на рисунке 2а указаны стрелкой черного цвета). Местами кардиомиоциты разделены тонкими прослойками рыхлой соединительной ткани. Видны межуточные скопления гомогенных эозинофильных масс.
Легкие неравномерно кровенаполнены
(рис. 2б). В просветах сосудов расположены эритроциты, гомогенные эозинофильные массы. Стенки артериальных сосудов имеют нечеткую структуру. Вены неравномерно расширены, стенки их тонкие. Бронхи неправильной геометрической формы, покрытые внутри однослойным многорядным цилиндрическим мерцательным эпителием, которые местами десквамированы. Просветы артериол расширены, некоторые сливаются по две-три.
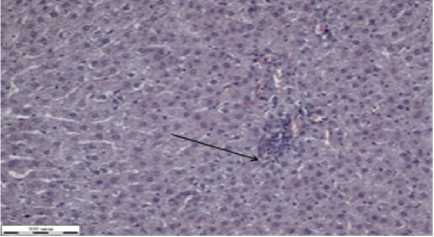
Печень снаружи покрыта соединительнотканной капсулой (рис. 2в). В срезах печени кровенаполнение неравномерное. Между дольками местами определяются прослойки нежной соединительной ткани. В печеночных триадах просматриваются поперечные срезы артерии с утолщенной и веной с тонкой стенкой. Также же видны скопления микрофагов (на рисунке 2в указаны стрелкой черного цвета). В центре долек расположены центролобулярные вены, в просветах определяются эритромассы, кровенаполнение снижено. Цитоплазма гепатоцитов зернистая с единичными мелками круглыми пустотами. Ядра клеток базофильные, с четкой структурой. В части гепатоцитов ядра не видны, структура нечеткая. Синусоиды расширены. Определяются микрофаги.
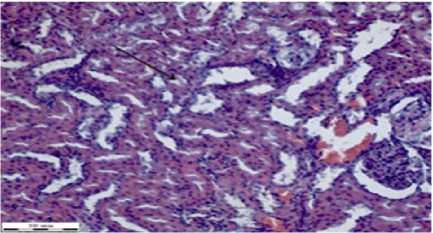
В срезах почек определяется соединительнотканная капсула (рис. 2г). Клубочки почек в корковом слое имеют круглую форму. Капилляры клубочков, покрытые мезотелием, заполнены неравномерно эритроцитами. Полости капсул клубочков свободные. Внутри проксимальные канальцы покрыты кубическим эпителием эозинофильной окраски. У дистальных канальцев более светлый эпителий. Просветы собирательных трубочек шире, чем у канальцев. Они состоят из цилиндрического эпителия, расположенного на базальной мембране. В ¼ части канальцев, если ориентироваться по полям зрения, наблюдается десквамация эпителия до базального слоя клеток, слущенные пласты видны в просветах канальцев (на рисунке 2г указаны стрелкой черного цвета).
В срезах селезенки снаружи определяется тонкая плотная соединительнотканная капсула (рис. 2д). В красной пульпе расположены немногочисленные эритроциты. В белой пульпе лимфатические клетки в виде небольших скоплений около сосудов, местами с формированием редких крупных фолликулоподобных структур с маргинальным слоем без реактивного центра.
Кровенаполнение тонкого кишечника сниженное, ворсины слизистой покрыты однослойным каемчатым эпителием, состоящие из рыхлой волокнистой ткани собственной пластинки и отдельных гладкомышечных клеток. В срезах слизистая представлена с нечеткой структурой, бокаловидные клетки редкие и мелкие, крипты трубчатой формы. Подслизистая состоит из рыхлой волокнистой соединительной ткани со скоплениями эозинофильных масс. Мышечная оболочка тонкой кишки представлена двумя слоями: внутренним циркулярным и наружным продольным.
Стенка толстого кишечника состоит из слизистой, подслизистой, мышечной и серозной оболочек с отсутствием ворсинок. Слизистая имеет крипты, промежутки которых заполнены волокнистой соединительной тканью. Слизистую оболочку выстилает однослойный цилиндрический каемчатый эпителий с большим количеством бокаловидных клеток.
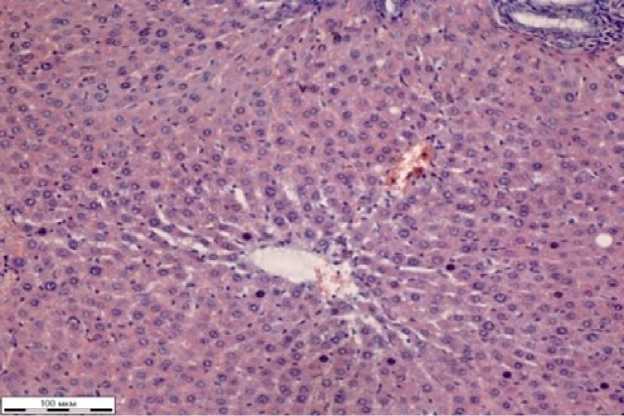
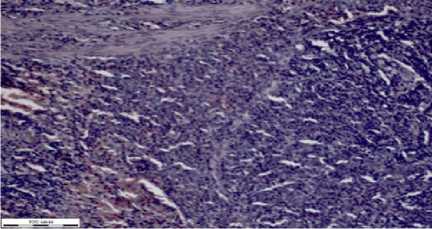
Рисунок 3 – Фрагмент ткани печени крыс при отравлении глифосатом и лечением КС (окраска гематоксилином Эрлиха, эозином 0,4% водным, увеличение Х310)
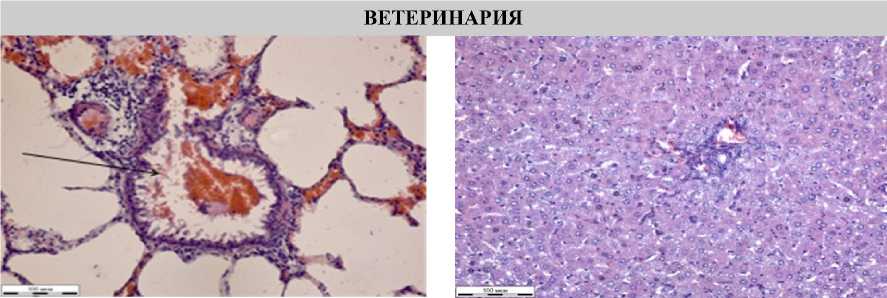
ВЕТЕРИНАРИЯ
Рисунок 4 – Фрагменты тканей легких и печени крыс при отравлении глифосатом и лечением ТА (окраска гематоксилином Эрлиха, эозином 0,4 % водным, увеличение Х310):
а – легкие; б – печень
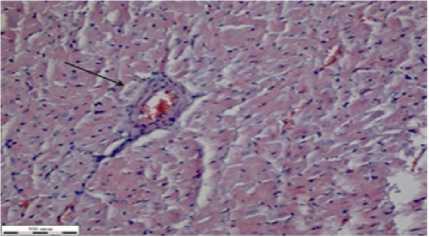
При действии глифосата и лечении НС во внутренних органах крыс было отмечено набухание стенок артерий (на рисунке 5а указано стрелкой черного цвета), истончение вен.
а
б
в
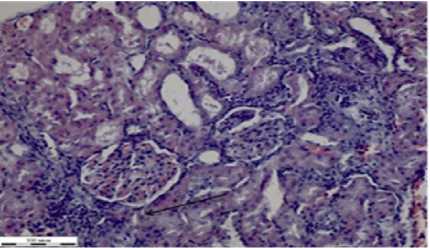
г
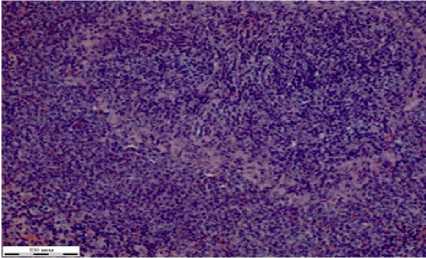
д
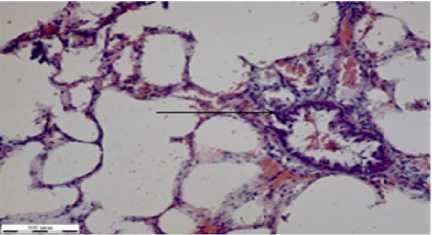
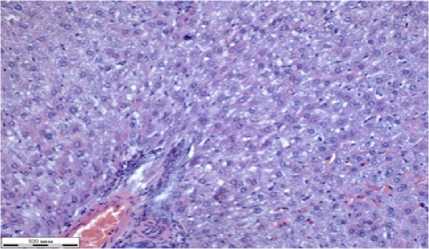
Рисунок 5 – Фрагменты тканей органов крыс группы при отравлении глифосатом и лечением НС (окраска гематоксилином Эрлиха, эозином 0,4 % водным, увеличение Х310): а – сердце; б – легкие; в – печень; г – почка; д – селезенка; е – стенка толстого кишечника
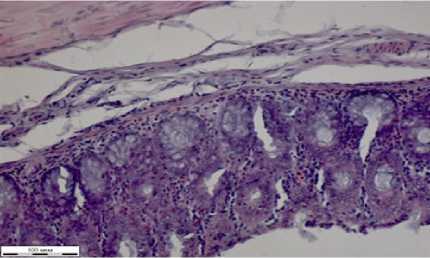
е
Таким образом, антитоксические средства (ксимедон-С, ТА, натрия сульфид) используемые при отравлении белых крыс глифосатом на уровне 5 ПДК в разной степени приводили к отмене токсического влияния на внутренние органы опытных животных. Токсическое действие на сердце, почки, желудок, кишечник и селезенку значительно снижался при использовании ксимедона-С и препарата под шифром ТА. Сульфид натрия же не проявлял антитоксическое действие на внутренние органы опытных животных при отравлении глифосатом.
Выводы. Проведенные исследования показали, что отравление белых крыс глифосатом из группы гербицидов на уровне 5 ПДК оказывало значительное влияние на их внутренние органы. У опытных животных нарушалась гемоциркуляция, гемореология. Проявлялись некробиотические изменения, местами с признаками воспалительной клеточной реакции, межуточными отеками и десквамацией эпителия канальцев. Исходя из полученных данных, можно сделать вывод, что из изученных антитоксических средств при отравлении данным пестицидом наиболее положительный эффект на состояние внутренних органов оказал ксимедон-С, менее результативным был экспериментальный образец на основе тетраазатрициклосоединения (ТА) и практически не проявил лечебного действия - сульфид натрия.


