Иммуноферментная тест-система для межоперационного контроля специфичности рекомбинантного капсидного белка цирковируса свиней 2-го типа
Автор: Кузнецова Ю.А., Ахунова А.Р., Галеева А.Г., Хаертынов К.С., Ефимова М.А.
Рубрика: Ветеринария
Статья в выпуске: 4 т.264, 2025 года.
Бесплатный доступ
Цирковирусные инфекции свиней (ЦВИС), вызываемые преимущественно цирковирусом свиней 2-го типа (ЦВС-2), представляют собой одну из наиболее значимых проблем в мировом свиноводстве. Ключевым инструментом контроля и профилактики ЦВИС является вакцинация. Рекомбинантные аналоги капсидного белка (rCap) цирковируса свиней 2-го типа (ЦВС-2) являются ключевыми компонентами современных диагностических тест-систем и субъединичных вакцин. Стабильность его антигенной активности – критический параметр, определяющий эффективность и воспроизводимость функционального продукта. Целью настоящего исследования явилась разработка и апробация иммуноферментной тест-системы для межоперационного контроля специфической активности белка rCap. Для получения рекомбинантных аналогов капсидного белка ЦВС-2 использовали ранее сконструированные рекомбинантный штаммпродуцент E. coli BL21(DE3)pLysS-ORF2 (для прокариотического аналога) и стабильно экспрессирующую клеточную линию яичников китайского хомячка CHO-K1/PCV-ORF2 (для эукариотического аналога), очистку белков проводили по ранее разработанным протоколам. Для сенсибилизации твердой фазы (полистироловых планшетов) использовали хроматографически очищенный IgG, выделенный из пула сывороток серопозитивных к ЦВС-2 свиней; специфический пероксидазный конъюгат получали перйодатным методом. В результате исследований получен стабильный пероксидазный конъюгат с плотностью мечения 1,5:1. Разработанная тест-система позволила провести полуколичественный анализ рекомбинантного сырья, демонстрируя хорошую воспроизводимость (коэффициент вариации < 7%). Установлено, что тест-система является универсальной и позволяет оценивать активность вариантов rCap, полученных как в прокариотических, так и в эукариотических системах экспрессии, корректно распознавая их антигенные детерминанты. Таким образом, внедрение метода полуколичественного ИФА в производственный цикл позволит стандартизировать процесс межоперационного контроля качества биомассы, полученной при помощи технологий рекомбинантных ДНК, и гарантировать стабильные антигенные характеристики вакцинных и диагностических препаратов.
Цирковирус свиней 2-го типа, капсидный белок, технологии рекомбинантных ДНК, гетерологичная экспрессия, иммуноферментный анализ, межоперационный контроль качества сырья
Короткий адрес: https://sciup.org/142246744
IDR: 142246744 | УДК: 636.3:619:578:577.2 | DOI: 10.31588/2413_4201_1883_4_264_50
Текст научной статьи Иммуноферментная тест-система для межоперационного контроля специфичности рекомбинантного капсидного белка цирковируса свиней 2-го типа
В этих условиях вакцинация является ключевым инструментом контроля и профилактики ЦВС-2. Наряду с традиционными инактивированными вакцинами все большее значение приобретает разработка современных генно-инженерных вакцин. Такие препараты, основой которых являются рекомбинантные аналоги мажорного капсидного белка ЦВС-2 (Cap), кодируемого геном ORF-2 и содержащего основные протективные эпитопы, обладают рядом преимуществ: высокой степенью очистки, безопасностью (отсутствием риска реверсии вирулентности), стабильностью и возможностью крупномасштабного стандартизированного производства [6, 7, 8].
Производство рекомбинантных вакцин является многостадийным технологическим процессом, требующим строгого контроля сырья на каждом этапе. Одним из важнейших аспектов считается подтверждение специфичности рекомбинантного антигена – это является гарантией того, что в ходе культивирования штамма-продуцента либо стабильно экспрессирующей клеточной линии был получен целевой белок, сохранивший свою антигенную структуру [9, 10]. Особенно актуальной эта задача становится при использовании различных систем экспрессии для разных целей
(диагностических и профилактических), таких как прокариотических (E. coli) или основанных на применении перевиваемых линий клеток млекопитающих. Белки, полученные путем биосинтеза в разных системах экспрессии, могут отличаться посттрансляционными модификациями и конформацией, что потенциально влияет на их антигенные и иммуногенные свойства [11]. Следовательно, необходим универсальный метод межоперационного контроля, способный подтвердить наличие и специфичность рекомбинантного капсидного белка ЦВС-2.
Для решения этой задачи наиболее подходящим инструментом является иммуно-ферментный анализ (ИФА) в «сэндвич»-формате [12]. В отличие от таких методов, как электрофорез в полиакриламидном геле и вестерн-блоттинг, которые в первую очередь оценивают молекулярную массу белка и его реактивность к антителам в денатурирующих условиях, антигенный ИФА позволяет оценить нативную или близкую к нативной конформацию антигена. «Сэндвич»-ИФА, использующий два типа специфических антител (первичные – связывающие и вторичные – детектирующие), обеспечивает высокие чувствительность и специфичность реакции [13]. Этот метод позволяет не только подтвердить наличие рекомбинантного антигена, но и количественно оценить его концентрацию в неочищенных культуральных жидкостях и первичных клеточных лизатах, промежуточных фракциях и конечном продукте. Высокая производительность, возможность автоматизации и относительно низкая стоимость делают ИФА оптимальным выбором для рутинного межоперационного контроля в условиях промышленного производства вакцин.
Целью настоящей работы явилась разработка и валидация иммуноферментной тест-системы для межоперационного контроля специфичности рекомбинантного капсидного белка (rCap) ЦВС-2.
Условия, материалы и методы. Исследования проводились в лаборатории вирусных антропозоонозов ФГБНУ «ФЦТРБ-ВНИВИ» в период с августа по октябрь 2025 г.
Продуценты и референтные образцы антигенов .
В работе использовались:
-
– Штамм E. coli – продуцент rCap BL21 (DE3)pLysS-ORF2 (ФГБНУ «ФЦТРБ-ВНИВИ»);
-
– Стабильно экспрессирующая клеточная линия яичников китайского хомячка - CHO-K1/PCV-ORF2 (ФГБНУ «ФЦТРБ-ВНИВИ»);
-
- Нативный антиген ЦВС-2 (штамм «PCV2 -SHBC», ФКП «Щелковский биокомбинат» с исходной концентрацией 2 мг/мл [14];
-
– Рекомбинантный аналог Cap прокариотического происхождения (ФГБНУ «ФЦТРБ-ВНИВИ» с исходной концентрацией 6 мг/мл [15];
-
– Рекомбинантный аналог Cap,
полученный путем биосинтеза в клеточной линии CHO-K1 (ФГБНУ «ФЦТРБ-ВНИВИ») с исходной концентрацией 4 мг/мл.
Получение специфического пероксидазного конъюгата . Выделение специфических иммуноглобулинов из пула сывороток свиней, иммунных к ЦВС-2, производили методом трехкратного переосаждения насыщенным раствором сульфата аммония (НСА) с последующей хроматографической очисткой на ДЭАЭ-целлюлозе.
Постановка ИФА . Протокол постановки непрямого варианта ИФА был оптимизирован методом шахматного титрования сенсибилизирующего иммуноглобулина, антигена и специфического пероксидазного конъюгата. 96-луночные полистироловые планшеты средней сорбции (ВНИИ «Медполимер», Россия) сенсибилизировали двукратными разведениями иммуноглобулина (от 10 до 0,05 мкг/мл) на 0,05 М карбонатно-бикарбонатном буфере (рН 9,6) в объеме 100 мкл/лунку и инкубировали 18 ч при 4°С. Промывку осуществляли трехкратно после каждого этапа ИФА фосфатносолевым буфером с добавлением 0,05% Tween-20 (ФСБ-Т). Нативные и рекомбинантные референс-антигены вносили в концентрациях от 1 до 0,001 мг/мл на ФСБ-Т и инкубировали 1 ч при 37°С. Специфический пероксидазный конъюгат, предварительно полученный перйодатным методом по Nakane [16], вносили в концентрациях от 5 до 0,01 мкг/мл и инкубировали аналогично. После финальной промывки добавляли по 100 мкл/лунку субстратного раствора тетраметилбензидина (ТМБ, «BD Biosciences», США), реакцию останавливали через 15 мин внесением 100 мкл 2 М H 2 SO 4 . Оптическую плотность (ОП) измеряли на спектрофотометре «Model 680» («Bio-Rad», США) при длине волны 450 нм. Ключевым критерием оценки сохранности специфической антигенной активности рекомбинантных аналогов белка Cap считали коэффициент специфического связывания (S/N, signal-to-noise), который рассчитывался для каждой концентрации специфических компонентов как отношение ОП ср в лунках с положительными контрольными антигенами к ОП ср в лунках с отрицательными контрольными антигенами.
Статистический анализ . Эксперименты проводились в трипликатах, данные представлены в виде среднего значения и стандартного отклонения (M±SD). Статистическую обработку результатов проводили с использованием программного обеспечения «GraphPad Prism 9.0» («GraphPad Software», США). Для построения кривых титрования использовали нелинейную регрессию. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение. Для создания стандартизированной ИФА-тест-системы, предназначенной для межоперационного контроля специфичности rCap, требовались получение и характеристика ключевых компонентов для анализа.
В качестве основного реагента для сенсибилизации твердой фазы был использован иммуноглобулин класса G (IgG), выделенный из пула сывороток позитивных к ЦВС-2
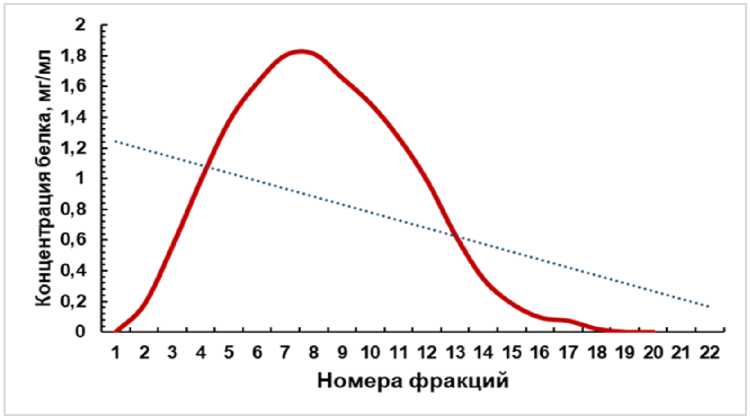
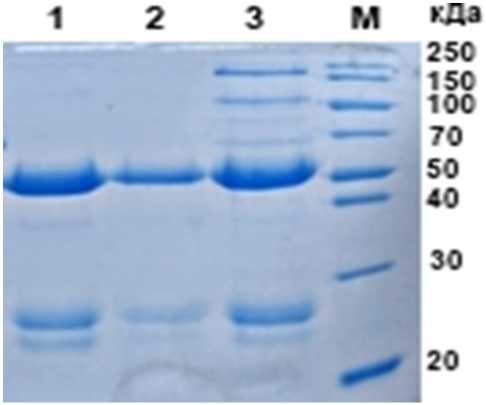
свиней. Контроль чистоты препарата, подвергнутого ионо-обменной хроматографии на ДЭАЭ-целлюлозе, осуществляли при нативного электрофореза помощи (рис. 1).
а)
б)
Рисунок 1 - Результаты хроматографической очистки анти-ЦВС иммуноглобулинов: а - гистограмма элюции IgG, б - нативная электрофореграмма очищенных IgG, где 1-3 - фракции IgG, М - маркер молекулярных масс «PageRuler» («Thermo Scientific», США)
Из электрофореграммы (рис. 1б) визуализируются две основные полипептидные фракции, соответствующие тяжелой (H-цепь, 50 кДа) и легкой (L-цепь, 25 кДа) цепям IgG, при этом выраженность минорных полос незначительна, что свидетельствует о высокой степени очистки препарата и его пригодности для дальнейшего использования в ИФА.
Далее для детекции комплекса «антиген-антитело» был получен конъюгат анти-ЦВС иммуноглобулина с пероксидазой хрена (ПХ). Конъюгация была проведена перйодатным методом, обеспечивающим ковалентное связывание через альдегидные группы, образующие при окислении углеводных компонентов молекулы ПХ. Ключевой характеристикой, определяющей чувствительность и специфичность конъюгата, является плотность мечения – молярное соотношение молекул ПХ к молекулам IgG, вычисляемое по максимумам поглощения гема пероксидазы (403 нм) и ароматических аминокислот белка (280 нм). Проведенные расчеты показали, что для полученного конъюгата плотность мечения составила 1,5:1. Такое значение способно обеспечить достаточную ферментативную активность для надежной детекции сигнала, но при этом минимизирует риск стерических погрешностей и неспецифического связывания. Конъюгат был стабилизирован добавлением 1% БСА.
На основе кривых титрования, полученных для исходной партии анти-ЦВС иммуноглобулина, была определена его оптимальная рабочая концентрация (ОРК). За ОРК принимали наименьшие концентрации специфического иммуноглобулина и пероксидазного конъюгата, которые обеспечивали: а) соотношение ОПср(К+) в диапазоне 1,1-1,4, что соответствует линейному участку детекции спектрофотометра; б) максимально возможное значение коэффициента S/N, но не менее 6,5. В данном эксперименте ОРК иммуноглобулина составила 4,5 мкг/мл, ОРК пероксидазного конъюгата - 8 мкг/мл: при этих концентрациях значение S/N составляло в среднем (10,2±0,8) ед.
Для межоперационного контроля рекомбинантных антигенов каждая новая партия rCap тестировалась с помощью разработанного ИФА параллельно с референс-образцами. Партия считалась соответствующей требованиям специфической антигенной активностью, если при ее тестировании с ОРК специфического иммуноглобулина выполнялись следующие условия:
-
1. Значение ОП ср образца находилось в пределах ± 20% от значения ОП ср (К+), полученного для референс-антигенов в том же эксперименте.
-
2. Значение коэффициента S/N было не ниже 85% от значения S/N референсантигенов, т.е. не ниже 8,6 ед. (для данной партии конъюгата).
Этот подход позволил стандартизировать оценку функциональной активности антигена, нивелируя межпланшетную и межоператорскую вариабельность, и гарантировать стабильность диагностических характеристик тест-системы при использовании различных серий рекомбинантных белков.
Ключевой задачей при производстве вакцин и диагностикумов с использованием технологий рекомбинантных ДНК является обеспечение стабильности и функциональной активности антигена на всех этапах - от индукции экспрессии до очистки конечного продукта. Рекомбинантный капсидный белок ЦВС-2 может быть получен в нескольких системах, каждая из которых имеет свои особенности, влияющие на фолдинг, посттрансляционные модификации и, как следствие, антигенную активность и иммуногенность белка. Исходя из этого, необходимо учитывать следующее:
-
а) Прокариотический синтез (в E. coli ) позволяет получить большое количество белка, но это часто приводит к образованию нерастворимых агрегатов (телец включения). Процесс рефолдинга (восстановления нативной структуры) является критическим этапом и напрямую определяет долю функционально активного белка в конечном препарате. Некорректно свернутые молекулы, присутствуя в образце, могут не распознаваться специфическими антителами.
-
б) Эукариотический синтез (в клетках млекопитающих) обеспечивает нативный фолдинг и гликозилирование белка, что приближает его структуру к оригинальной. Однако культуральная среда и продукты лизиса клеток могут содержать компоненты, интерферирующие в анализе и снижающие стабильность антигена при хранении.
Для унификации контроля качества было необходимо установить зависимость между концентрацией рекомбинантного белка и его функциональной активностью, выраженной посредством коэффициента S/N. Для апробации данного критерия был проведен анализ различных образцов рекомбинантного сырья: исходных клеточных лизатов, промежуточных продуктов очистки, очищенных продуктов. Все образцы перед анализом были нормализованы по общей концентрации белка до 1 мг/мл. Результаты ИФА представлены в таблице.
Таблица - Оценка специфической антигенной активности продуктов рекомбинантного синтеза капсидного белка ЦВС-2
|
№ п/п |
Вид технологического сырья |
Значение S/N |
Соответствие критерию (S/N > 8,6 для данной партии конъюгата) |
|
1 |
Нативный цельновирионный антиген ЦВС-2 |
10,3 ± 0,7 |
соответствует |
|
2 |
Референс-антиген rCap прокариотического происхождения |
11,2 ± 0,8 |
соответствует |
|
3 |
Референс-антиген rCap эукариотического происхождения |
15,2 ± 1,1 |
соответствует |
|
4 |
Лизат клеток штамма-продуцента E. coli BL21(DE3)/pLysS-pET-28a(+)-ORF2 |
9,7 ± 0,4 |
соответствует |
|
5 |
Бесклеточный экстракт штамма-продуцента E. coli BL21(DE3)/ pLysS-pET-28a(+)-ORF2 |
3,1 ± 0,2 |
не соответствует |
|
6 |
Солюбилизированные тельца включения, содержащие агрегированный rCap |
9,1 ± 0,7 |
соответствует |
|
7 |
rCap прокариотического происхождения после рефолдинга и финишной очистки |
10,9 ± 0,9 |
соответствует |
|
8 |
Лизат клеток экспрессирующей линии CHO-K1/ORF2 |
9,5 ± 1,1 |
соответствует |
|
9 |
Бесклеточный экстракт экспрессирующей линии CHO-K1/ORF2 |
8,9 ± 0,4 |
соответствует |
|
10 |
rCap эукариотического происхождения после финишной очистки |
17,7 ± 2,1 |
соответствует |
Представленные данные демонстрируют, что партии сырья, прошедшие полный цикл очистки (позиции 7 и 10) демонстрируют высокие коэффициенты S/N, сопоставимые с референс-образцами или превосходящие их. В то же время прокариотический препарат, не подвергавшийся процедуре рефолдинга (6), и эукариотический препарат до очистки от балластных компонентов (9), демонстрировали в среднем более низкие значения S/N, несмотря на то, что общая концентрация белка была стандартизирована. Это наглядно демонстрирует преимущество разработанного метода для выявления именно функционально активного антигена. Примечательно, что варианты капсидного белка, синтезированного в эукариотической системе экспрессии (3, 10), отличались наибольшим коэффициентом S/N, что может свидетельствовать о более подходящей для серологических реакций конформации иммуногенных эпитопов.
Выводы. В рамках настоящего исследования была проведена апробация непрямой ИФА-тест-системы для полуколичественной оценки специфической антигенной активности рекомбинантного капсидного белка (rCap) ЦВС-2. Данная методика является важным инструментом для стандартизации и контроля качества биомассы, полученной при помощи технологий рекомбинантного синтеза, где стабильность функциональных свойств антигенов от партии к партии имеет критическое значение.
Ключевым результатом работы стало создание набора реагентов, в том числе рекомбинантных референс-антигенов, высокоочи-щенного IgG к ЦВС-2 и специфического пероксидазного конъюгата с плотностью мечения 1,5:1, что обеспечило высокую чувствительность и специфичность анализа. Метод продемонстрировал хорошую воспроизводимость (коэффициент вариации составил < 7%), что позволит применять его в целях рутинного межоперационного контроля. Преимуществом разработанного подхода является его универсальность: метод основан на оценке способности антигена связываться с поликлональными антителами, что позволяет эффективно детектировать и оценивать активность rCap независимо от системы его экспрессии. Метод является эффективным как в отношении белка, полученного в прокариотической системе экспрессии, так и в отношении его гликозилированных вариантов, полученных в клетках млекопитающих.
Таким образом, внедрение данного метода в производственный процесс, в том числе при использовании разных платформ синтеза антигенов либо при переходе с одной технологии на другую, позволит повысить качество конечного продукта и обеспечить их стабильность.


