Искусственный интеллект в ультразвуковой диагностике новообразований молочных желез: возможности и ограничения (литературный обзор)
Автор: Марущак Е.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 3 т.25, 2025 года.
Бесплатный доступ
Ультразвуковое исследование является широкодоступным и часто используемым методом визуализации молочной железы. Уже в настоящее время достижения в области разработки программного обеспечения искусственного интеллекта (ИИ) помогают врачам ультразвуковой диагностики интерпретировать поражения молочных желез. В этой статье представлен обзор литературных данных о возможностях, сложностях, ограничениях и перспективах использования ИИ в ультразвуковой диагностике молочных желез. В ней обсуждаются также юридические и технические сложности, оказывающие влияние на использование ИИ в клинической практике. Кроме того, в статье подчеркивается потенциальное значение ИИ в ультразвуковой диагностике молочных желез как системы поддержки принятия решения при диагностическом скрининге, особенно молодыми специалистами.
Ультразвуковая диагностика, молочная железа, искусственный интеллект, ИИ, морфологическая верификация, BI-RADS
Короткий адрес: https://sciup.org/149149282
IDR: 149149282 | DOI: 10.24412/1999-7264-2025-3-69-82
Текст научной статьи Искусственный интеллект в ультразвуковой диагностике новообразований молочных желез: возможности и ограничения (литературный обзор)
В 2024 году международное агентство по исследованию рака (МАИР, IACR) опубликовало новые неутешительные данные по проблеме рака молочной железы (РМЖ). Было исследовано текущее (по состоянию на 2022 г.) и будущее (прогнозируемый 2050 г.) глобальное бремя женского рака груди в целом и по возрастным группам в 185 странах, а также 10-летние тенденции заболеваемости и смертности. Согласно полученным результатам, в 2022 году в мире было зафиксировано 2300000 новых случаев рака молочной железы среди женщин и 670000 смертей от него. В половине обследованных стран годовые показатели увеличились на 1–5%. Ожидается, что к 2050 году количество новых случаев и смертей вырастет на 38% и 68% соответственно. РМЖ остается наиболее часто диагностируемым типом злокачественных новообразований и самой распространенной причиной смерти от рака среди женщин [1]. Распространенность рака молочной железы (РМЖ) в России в 2023 году составила 541,7 на 100000 населения [2].
В последнее время наблюдается рост числа доброкачественных дисплазий молочной железы (ДДМЖ), что делает эту патологию самой распространенной среди женщин. Точная статистика по ДДМЖ отсутствует, но, по оценкам некоторых исследователей, она встречается у половины и более женщин. Чаще всего ДДМЖ диагностируется у женщин в возрасте от 40 до 44 лет, достигая частоты 200–400 случаев на 100 000 женщин в год [3,4]. Dyrstad с соавт. (2015) провёл метаанализ литературных данных и пришёл к выводу, что некоторые формы ДДМЖ, особенно пролиферативные варианты, связаны с повышенным риском развития рака молочной железы (РМЖ) в будущем [5].
Среди методов инструментальной диагностики заболеваний молочной железы (МЖ) ультразвуковое исследование (УЗИ) является одним из основных из-за его высокой информативности и неинвазивности, а также широкой доступности для населения. Согласно национальным клиническим рекомендациям мультипараметрическое УЗИ является методом выбора в дифференциальной диагностике между диффузными и очаговыми изменениями паренхимы МЖ, кистозными и солидными образованиями. УЗИ МЖ рекомендуется проводить пациенткам до 40 лет с развитой железистой тканью, а также беременным и кормящим женщинам. У женщин старше 40 лет УЗИ также выполняется при неясных результатах маммографии, наличии эндопротезов, травм и воспалительных процессов. Современное УЗИ МЖ включает в себя не только стандартную серо-шкальную визуализацию в В-режиме с применением цветокодированных методик, но и мультипараметрическую диагностику, когда используются дополнительные режимы: эластография, контрастное усиление, допплерометрия в импульсном режиме [3,6,7]. Эволюция радиологических методов обследования (в том числе УЗИ) пациенток с заболеваниями МЖ на современном этапе развития идет по пути активного внедрения и совершенствования технологий искусственного интеллекта (ИИ) [8,9].
Изложение основного материала
В настоящее время не существует универсального и общепринятого определения ИИ. Это связано с тем, что понятие ИИ постоянно развивается, что делает его терминологически сложным для точного определения [10]. В Национальной стратегии развития ИИ до 2030 г., утвержденной Указом Президента Российской Федерации, ИИ трактуется как «совокупность технологических решений, способных имитировать когнитивные функции человека и достигать результатов, как минимум сопоставимых с человеческим интеллектом, что также включает в себя способность к самообучению и поиску решений без заранее заданных алгоритмов». В документе также указано, что к таким технологическим решениям относятся инфраструктура информационно-коммуникационных технологий, программное обеспечение (в том числе с использованием методов машинного обучения), процессы и услуги по обработке данных и поиску решений [11].
Применение ИИ в маммологии, с одной стороны, может повысить точность диагностики и эффективность лечения РМЖ, но при этом возможны диагностические ошибки, за которые несут ответственность медицинские организации, производители программного обеспечения и медицинский персонал. В Российской Федерации (РФ) существуют регламентирующие использование ИИ в клинической практике документы, однако для полноценного внедрения данной технологии в алгоритмы скрининга необходимо усовершенствование нормативно-правовой базы. Одной из основных проблем остается отсутствие четко сформулированных норм и стандартов, регулирующих ответственность за ошибки ИИ. Например, ответственность за неправильную верификацию новообразования может нести медицинское учреждение, однако недостаточно учитывается ответственность производителей программного обеспечения [12].
ИИ, являясь продуктом программного обеспечения, включает поддомены машинного обучения (МО) и глубокого обучения (ГО). Принцип формирования алгоритмов МО и ГО схематично представлен на рисунке 1. Алгоритмы МО используют параметры на основе заранее введенных экспертных знаний и ограничены своей зависимостью от функций, определенных экспертами, и, соответственно, не могут адаптироваться к незаданным изменениям в различных методах визуализации. В медицинской сфере распространены следующие алгоритмы МО: методы опорных векторов, байесовские классификаторы и др. Алгоритмы ГО, напротив, не требуют заранее определенных функций и областей интересов, поскольку способны автоматически анализировать информацию и обучаться на основе необработанных данных. Наиболее частой архитектурой ГО является так называемая сверточная нейронная сеть, суть которой состоит в многослойной обработке изображений с фрагментацией и последующем умножении отдельных фрагментов изображения с использованием матриц математическим методом, который называется «свертка» [13-16].
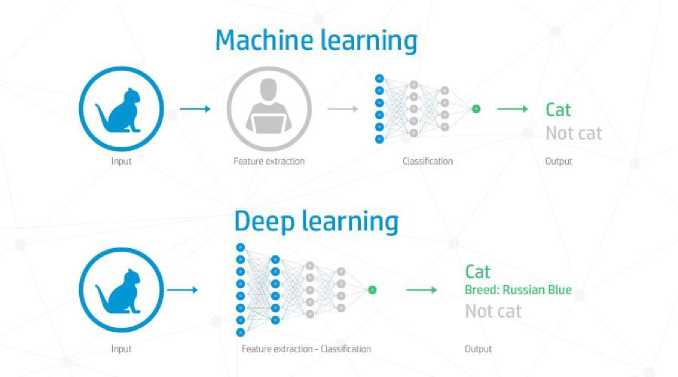
Рис. 1. Схематичное изображение машинного обучения и глубокого обучения.
Ссылка на источник:
Fig. 1. Schematic representation of machine learning and deep learning. Link to the source:
Уже не вызывает сомнений тот факт, что ИИ повышает эффективность диагностики новообразований МЖ, сокращая разрыв в производительности между менее и более опытными врачами, что снижает количество ненужных повторных обследований и биопсий, оптимизируя использование медицинских ресурсов и повышая общую эффективность диагностики [17-20]. Программы ИИ в УЗД, подобно действиям врача, используются для идентификации и сегментации областей интереса, извлечения признаков и классификации доброкачественных и злокачественных поражений при ультразвуковой визуализации МЖ. Каждая из этих задач, с одной стороны, подлежит усовершенствованию путем применения алгоритмов ГО, а с другой стороны, имеет сложности и ограничения, такие как плохое качество изображений, разница в оборудовании, наличие артефактов, проблемы с цифровым архивированием, большие различия в количестве и модальности набора данных, используемых в ГО [21-23]. По уровню реализации и практического применения в УЗД ИИ можно условно поделить на программное обеспечение (ПО) ИИ УЗ-сканеров и (как правило) вендор-нейтральные внешние платформы (которые в свою очередь делятся на приложения для смартфонов и классические компьютерные программы). По реализуемым задачам в ультразвуковой диагностике МЖ в литературе в настоящее время представлены следующие разработки ПО ИИ: автоматическая сегментация зоны интереса, стратификация новообразования, прогнозирование молекулярных подтипов и ответа на лечение РМЖ.
Для интерпретации новообразований МЖ их сначала следует сегментировать от фона. В настоящее время ручная сегментация в алгоритмах ИИ УЗ-сканеров в основном выполняется врачами ультразвуковой диагностики, и этот процесс по-прежнему зависит не только от опыта работы, но и требует времени и усилий. Кроме того, эхограммы часто имеют низкую контрастность, размытые границы и большое количество теней и артефактов. Все это создает предпосылки для развития ИИ в части идентификации и сегментации по пути совершенствования автоматического метода. Процесс сегментации изображений новообразований МЖ в основном включает обнаружение области интереса, содержащей поражение и очерчивание его контуров, и его автоматизация значительно сэкономит время врачей ультразвуковой диагностик, а также обеспечит качественную основу для дальнейшей работы алгоритмов ИИ уже по части анализа выявленной патологии [22,24,25]. Наиболее уязвимыми в данной области работы ИИ являются качество и полнота выполняемого сканирования в режиме реального времени, то есть соблюдение методологии УЗИ, что также имеет зависимость от человеческого фактора.
По сравнению с ГО, применяемым для распознавания изображений КТ и МРТ, УЗИ является операторо-зависимым, и распознавание ИИ ультразвуковых изображений страдает от субъективной составляющей в работе УЗИ-специалистов, что отчасти приводит к тому, что развитие технологий ИИ в УЗИ отстает от КТ и МРТ. Чтобы преодолеть описанные выше проблемы, исследователи и разработчики ИИ совершенствуют методы автоматической сегментации ультразвуковых изображений МЖ с использованием технологий глубокой состязательной нейронной сети, а также алгоритмы извлечения признаков и прогноза степени злокачественности [7].
Распространенной диагностической проблемой является правильная стратификация образований МЖ, поскольку от этого зависит выбор хирургической тактики. Для стратификации новообразований в ПО ИИ также используются системы автоматизации. Следует отметить, что ИИ EP-cканеров для классификации новообразований МЖ, как правило, использует дихотомически укрупненные группировки категорий: BI-RADS II-III и BI-RADS IV-VI, что обусловлено целесообразностью в выборе дальнейшей тактики, разделяя множество новообразований на условно доброкачественные и потенциально злокачественные. Однако разбивка на категории стратифицируемых образований по BI-RADS может зависеть от производителя.
Многоцентровой ретроспективный обзор одного из коммерчески доступных внешних приложений Koios (DS) (Koios Medical Inc.) для поддержки принятия решений при УЗИ МЖ на основе ИИ показал, что точность диагностики врачей в части чувствительности и специфичности значительно возросла при использовании системы ИИ, при этом площадь под кривой (AUC) увеличилась с 0,83 без поддержки принятия решений до 0,87 с поддержкой принятия решений. Система ИИ классифицировала новообразования МЖ в четыре категории: доброкачественные, вероятно доброкачественные, подозрительные и вероятно злокачественные. Врачи дважды рассматривали эти случаи, один раз только с УЗИ, другой — с УЗИ и учетом данных ИИ. Интересно, что это же исследование показало, что использование поддержки принятия решений на основе ИИ может снизить индивидуальную субъективную составляющую среди врачей, предоставляя возможность стандартизировать заключение. В 13,6% случаев, когда использовалось только УЗИ, врачи выставляли более высокие категории риска, в то время как при использовании ИИ это произошло в 10,8% случаев [29,30]. Использование ПО ИИ снизило изменчивость мнения врача-диагноста как в отношении единолично выполненных динамических исследований, так и между разными специалистами, а также улучшило правильную оценку сонографических поражений МЖ большинством врачей. Но когда было проанализировано влияние ПО ИИ на чувствительность и специфичность каждого врача, было выявлено, что улучшение этих показателей зависело от специализации и опыта доктора. К такому выводу пришли и Chabi с соавт. (2012), которые оценивали точность ИИ в УЗИ молочной железы в соответствии с опытом врача. Авторы обнаружили улучшение чувствительности для молодых рентгенологов, но снижение специфичности для опытных рентгенологов. Это означает, что хотя ИИ может улучшить диагностику злокачественных новообразований при использовании молодыми специалистами, он может не превзойти или не повысить точность опытных врачей-диагностов [30,31].
Одной из первых коммерчески доступных систем ИИ для оценки ультразвуковых изображений новообразований МЖ на основе технологии ГО стала программа S-Detect ультразвукового сканера Samsung RS-85 (Южная Корея). В данной системе используется модель сверточной нейронной сети, которая была обучена на основе различных признаков унифицированной ультразвуковой оценки узловых образований МЖ по шкале BI-RADS. Это позволяет проводить автоматическую стратификацию новообразований на основе известных ультразвуковых признаков: эхогенности, границ, пространственной ориентации, формы. Исследования показали, что использование системы CAD (англ. CAD-computer aided diagnostic) на основе глубокой сверточной нейросети, реализованной в УЗ-сканере Samsung RS80A (S-Detect) для анализа ультразвуковых признаков образований МЖ может значительно улучшить диагностическую эффективность врачей с разным опытом. Так, использование CAD S-Detect позволило увеличить с 76,6% до 80,3% без изменения чувствительности (91,7%) у опытных врачей и увеличить как чувствительность, так и специфичность у молодых врачей с 75% до 83,3% и с 71,8% до 77,1% соответственно [30,32]. Опыт применения данной технологии продемонстрировал результаты в виде 91,2% согласованности данных ИИ и оценки радиологом-маммологом при интерпретации характера образований в МЖ [33]. Схожие данные по оценке эффективности стратификации новообразований МЖ ПО ИИ S-Detect были получены и автором настоящей статьи [25]. Di Segni с соавт. (2018) [34] также оценили диагностическую эффективность системы ИИ S-Detect при оценке очаговых образований в МЖ. S-Detect показал чувствительность более 90% и специфичность 70,8%, при этом согласованность была от умеренной до хорошей. Схожие данные об эффективности ИИ в стратификации новообразований МЖ представлены и в литературном обзоре Wu с соавт. (2019) [35]. O'Connell с соавт. (2022), проведя исследования 299 новообразований МЖ с помощью данного ПО ИИ, также подтвердил его высокую диагностическую ценность: по полученным результатам чувствительность, специфичность и точность диагностики доброкачественности и злокачественности программой ИИ превысили 0,8, что согласуется с данными самых высокоэффективных рентгенологов и соответствует недавним исследованиям [36].
Примеры заключений, сформированных ПО ИИ S-Detect ультразвукового сканера Samsung RS-85 представлены на рисунке 2 (данные получены непосредственно автором). Отчет, формируемый программой S-Detect, также содержит иную полезную информацию: глубину расположения новообразования, его продольный и поперечный размеры, площадь. Данная информация особенно актуальна перед планированием выполнения забора материала для морфологической верификации опухоли или ее удаления (например, путем вакуумной аспирационной биопсии). Для еще более точной стратификации учитываемые ультразвуковые характеристики могут быть дополнены врачом УЗД [25].
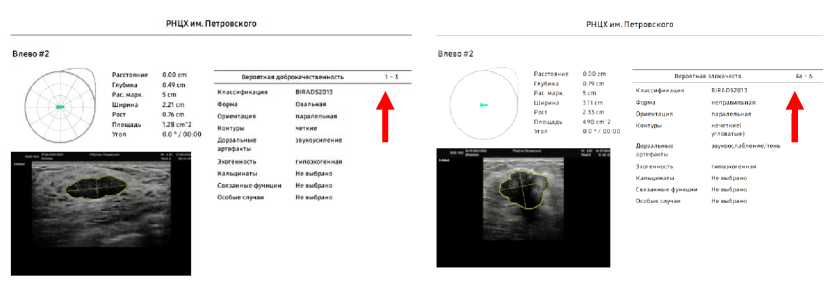
а
б
Рис.2. Примеры стратификации новообразований S-Detect Samsung RS-85 (подробные объяснения в тексте): (а) доброкачественное новообразование, (б) злокачественное новообразование. Контур, длина и ширина, выделенные желтым цветом, представляют собой периметр и размеры анализируемого новообразования. Стрелки – стратификация новообразования ИИ по BI-RADS
Fig.2. Examples of neoplasm stratification of S-Detect Samsung RS-85 (detailed explanations in the text): (a) benign neoplasm, (b) malignant neoplasm. Contour, length and width, highlighted in yellow – the perimeter and dimensions of the analyzed neoplasm. Arrows – stratification of the AI neoplasm by BI-RADS.
В настоящее время одно из направлений эволюции ИИ в УЗД МЖ направлено в сторону дальнейшего совершенствования алгоритмов анализа данных радиомики с целью извлечения информации для прогноза иных факторов, помимо стратификации. В нескольких исследованиях изучалось прогнозирование молекулярных подтипов рака МЖ на основе систем искусственного интеллекта для УЗИ МЖ. Так, в метаанализе Fu с соавт. (2024) представлены данные о многообещающей точности прогнозирования системами ИИ состояния ключевых молекулярных биомаркеров РМЖ по данным радиомики на основе УЗИ с чувствительностью и специфичностью 0,76 и 0,78 для прогнозирования HER2, 0,80 и 0,76 для биомаркеров Ki67 [30,37]. Одним из перспективных направлений развития ИИ является анализ и прогнозирование проводимого лечения на основе данных визуализации [22].
Создается все больше внешних платформ (в том числе отечественных) в виде программ и приложений, способных обрабатывать архивированные цифровые изображения, полученные на УЗ-сканерах разных производителей [38]. Mori с соавт. (2024) представили приложение для смартфона на базе ИИ с функцией захвата и анализа изображений с экранов медицинских диагностических систем. Установленная на компьютер программа ИИ показала 100% чувствительность и 75% специфичность для злокачественных новообразований и потребовала 0,2 сек. на получение отклика по прогнозу от ИИ-сервера. Прогнозирование с использованием смартфона потребовало 2 сек. на получение прогноза и показало 100% чувствительность и 97,5% специфичность для злокачественных новообразований [23] .
Не теряет актуальности и интеграция иных параметров новообразований в анализ ИИ, таких как оценка васкуляризации (в том числе микрокровоток), эластических свойств, что в настоящее время практически не представлено в реализованных рабочих алгоритмах [6,20,30]. В поисках потенциальных неинвазивных предоперационных методов прогнозирования молекулярных подтипов опухолей молочной железы Zhou с соавт. (2021) разработали модель ИИ на базе сверточной нейронной сети на основе данных УЗИ, обученную на серошкальных изображениях В-режима вместе с данными цветового допплеровского картирования и эластографии сдвиговой волны. Производительность данного ПО ИИ (среднее значение площади под кривой (AUC), 0,89–0,96) превзошла производительность других моделей, которые были основаны только на данных серошкального В-режима (среднее значение AUC, 0,73–0,75) при прогнозировании молекулярных подтипов рака молочной железы. Авторы сообщили, что модель даже оказалась лучше, чем предоперационная трепан-биопсия (AUC,
0,89–0,99 против 0,67–0,82; P < 0,05). Авторы предполагают, что способность ИИ оценивать все новообразования с помощью ПО ИИ при УЗИ, в отличие от частичной выборки с помощью трепан-биопсии, может оказаться преимуществом и является областью будущих исследований [39].
Следующим направлением развития ИИ в ультразвуковой диагностике МЖ является разработка алгоритмов прогнозирования ответа на неадъювантную терапию, поскольку полный ответ на нее связан с общей выживаемостью и является наиболее часто используемой конечной точкой, однако для подтверждения этого в настоящее время требуется хирургическое вмешательство. В настоящее время наиболее точным методом визуализации для оценки ответа на химиотерапию является МРТ, но возможность предсказывать его до операции с использованием менее дорогостоящего и более доступного метода, такого как УЗИ, имеет огромный клинический потенциал и экономические выгоды. Разработки по направлению изучения глубокой радиомики обучения для ультразвуковых изображений у пациентов, проходящих неадъювантную химиотерапию, ведутся Jiang с соавт. (2021) [40]. Первые результаты созданной ими предоперационной модели прогнозирования, основанной на ультразвуковых изображениях до и после терапии, показали площадь под кривой AUC 0,94 (95% ДИ, 0,91–0,77), что превзошло показатели опытных врачей-диагностов. В исследовании Gu с соавт. (2022) [41] модель ИИ на основе глубокого обучения радиомики успешно идентифицировала 90% пациентов (19 из 21), не ответивших на лечение, перенаправив их по другой стратегии, от которой они могли бы получить больше пользы.
Хотя за последнее десятилетие ИИ демонстрирует большие успехи в медицинской сфере, он все еще находится на стадии развития «слабого» ИИ и далек от полной интеграции в работу врача, не говоря о полной замене человека. Это обусловлено множеством ограничивающих совершенствование ИИ факторов, таких как отсутствие крупномасштабных общедоступных наборов данных, зависимость от сегментации и интерпретации данных радиомики, высокие требования к качеству изображений, региональные различия, а также проблемы переобучения и бинарной классификации. Самым существенным ограничением совершенствования ИИ в медицинской визуализации является потребность в значительных объемах высококачественных обучающих данных, представленных цифровыми изображениями, а также различия между данными изображений, используемыми для обучения алгоритма, которые специфичны для оператора, получающего изображения УЗИ, поставщика или учреждения, и для реальной клинической практики [30]. Кроме того, ИИ в основном нацелен на решение одной задачи и не может решать несколько задач одновременно, что является значимой проблемой, с которой сталкивается ГО на этапе разработки алгоритмов [22].
Fruchtman Brot c соавт. (2024) отмечает, что растущее использование ИИ в радиологии вызвало обеспокоенность в странах с высоким уровнем дохода: ИИ может потенциально заменить врачей-диагностов. Однако в странах с низким и средним уровнем дохода, где высококвалифицированного персонала мало, ИИ имеет огромный потенциал для устранения пробелов в кадровых ресурсах и может улучшить результаты диагностики РМЖ [30]. Так, недавнее перспективное многоцентровое исследование, проведенное в Мексике Berg с соавт. (2023) [42], продемонстрировало, что ПО ИИ, при УЗИ молочной железы, полученным с помощью недорогого портативного оборудования и минимально обученными операторами, не являющимися врачами, может точно классифицировать и сортировать новообразования МЖ в условиях низких ресурсов. Результаты доброкачественного, вероятно доброкачественного, подозрительного и злокачественного были получены с помощью внешнего ПО ИИ Koios (Koios Medical). Были проанализированы 758 новообразований у 300 женщин, и ПО ИИ правильно идентифицировало рак у 48 из 49 женщин (98%) с помощью обработки изображений, полученных с портативного УЗ-сканера (при этом алгоритмы ИИ Koios не обучались на изображениях с используемого устройства).
Проблемы и ограничения в области программного обеспечения с искусственным интеллектом
Одним из существенных ограничений использования встроенных ИИ-алгоритмов ультразвуковых сканеров, таких как S-Detect, является отсутствие возможности точной стратификации новообразований по отдельным категориям BI-RADS. Вместо присвоения конкретной диагностической категории (BI-RADS II, III, IVa, IVb и т.д.), алгоритм оперирует только укрупненными диапазонами: I–III как условно доброкачественные и IV–VI как условно злокачественные. Такое упрощение, вероятно, реализовано разработчиком с целью повышения надежности модели в условиях клинической неопределенности, а также минимизации потенциальных юридических рисков. Тем не менее подобный подход существенно ограничивает как тактическую, так и прогностическую значимость автоматической оценки.
Клиническая классификация BI-RADS изначально задумывалась как инструмент стратификации риска, напрямую влияющий на выбор диагностической и лечебной тактики. Например, подкатегории BI-RADS IV (IVa, IVb, IVc) различаются по уровню предполагаемой злокачественности и, соответственно, требуют разного подхода: от динамического наблюдения до немедленного хирургического вмешательства. Искусственное объединение этих подкатегорий в один диапазон делает невозможным проведение дифференцированной тактики, что может приводить к избыточному числу инвазивных вмешательств либо, напротив, к отсрочке необходимой диагностики у пациенток с высоко подозрительными образованиями. С исследовательской точки зрения, подобная бинаризация снижает точность анализа, ограничивает возможности ROC-анализа по отдельным порогам и делает невозможной калибровку моделей с учетом диагностической неопределенности промежуточных категорий. Также отсутствие точной категоризации BI-RADS в текущей реализации ИИ-модуля не только снижает клиническую ценность инструмента, но и ограничивает его применение в рамках персонализированного подхода, что требует учета при планировании как рутинного использования, так и научных исследований в данной области.
Алгоритм ПО ИИ обучен на проприетарных выборках производителя, следовательно, его диагностические метрики могут резко отличаться при переносе на аппараты других фирм либо на устаревшие модели того же производителя. В настоящий момент отсутствуют независимые данные о повторной калибровке сети под иные А-/В-фильтры, характер шумов и частотный диапазон линейных датчиков других платформ.
На данный момент большинство доступных ПО ИИ анализируют только серошкальные статические кадры, и любые изменения акустических пресетов (динамический диапазон, компрессия, частота зондирования) создают сдвиг распределения входных данных (data-shift), приводя к росту ложноположительных ответов. Информация, получаемая из дополнительных УЗ-режимов (таких, как эластография, ЦДК и микроваскуляризация) недоступна к анализу, что снижает чувствительность к биомеханическим и гемодинамическим маркёрам опухоли и обусловливает склонность к гипердиагностике сложных кист и пост-операционных рубцов.
Важным ограничением является отсутствие адаптивной сегментации и обучения в реальном времени. Модель не переобучается «на лету» под конкретный акустический путь, усиление, глубину или положение пациента, что усиливает оператор -зависимость, особенно при исследовании крупных или многокамерных образований, частично выходящих за пределы окна сканирования.
Алгоритмическая непрозрачность - «эффект черного ящика» и ограниченные средства аудита - еще одно препятствие на пути активного внедрения ПО ИИ в рутинную практику. Производитель не раскрывает архитектуру сети, набор признаков и систему пиритизации признаков BI-RADS.
Существенными могут быть и ряд технических ограничений: так изменение чувствительности пьезоэлементов, деградация кабеля или изменение калибровки TGC-кривой может способствовать тому, что распределение интенсивностей отдельных областей могут перестать соответствовать обучающей выборке, что в свою очередь приведет к росту ложноотрицательных и ложно-положительных заключений. С другой стороны, встроенных процедур автоматической перекалибровки алгоритм не имеет.
В России ИИ-модуль сертифицирован как часть медизделия класса IIa, и при ошибке диагностики юридическая ответственность распределена между лечащим врачом и производителем, но де-факто алгоритм недоступен для клинического «fine-tuning», что может являться значимым фактором сдерживания внедрения в широкий скрининг.
В настоящее время большинство алгоритмов ИИ находятся на этапе «узкоспециализированного помощника», чья эффективность доказана только при воспроизведении условий съемки, соотвтетствующих условиях обучения модели, а любое отклонение – смена оборудования, режимов визуализации, индивидуальных особенностей пациентов может существенно ограничивать обобщаемость результатов и требует многоцентровых исследований с последующей перекалибровкой, встроенных механизмов непрерывного обучения.
Исторически самыми большими проблемами совершенствования ИИ были доступность достаточных вычислительных мощностей и наборов данных для создания и обучения приложений ИИ. Сегодня некоторые из самых значительных проблем — это проверка производительности ИИ на различных наборах данных и группах пациентов, а также преодоление барьеров внедрения. В будущем основными проблемами, вероятно, станут более четкое определение ролей, которые ИИ должен играть в отношении пациента, а затем эффективная передача данных лечащему врачу. Также значимыми барьерами развития и внедрения ИИ являются отсутствие общепризнанных стандартов алгоритмов МО, гетерогенность качества анализируемых изображений, отсутствие достаточного количества рандомизированных клинических исследований. При этом ценность и возможности ИИ в УЗД новообразований МЖ уже сейчас очевидны, и по мере решения этих проблем в будущем может быть реализован весь потенциал ИИ [7,43].
Дальнейшее совершенствование ИИ в УЗД лежит в сфере автоматизации выполнения самого исследования и усовершенствования алгоритмов, имитирующих клиническое мышление, а также добавления новых подлежащих анализу параметров, таких как данные дуплексного сканирования, эластометрии и эластографии, контраст-усиленного УЗИ. Так, использование данных эластометрии в анализе параметров новообразования ИИ программой ИИ увеличило чувствительность метода до 88,6% и специфичность до 97,1%. Потенциальными векторами развития технологий ИИ являются дифференцировка молекулярно-биологических признаков опухолей, оценка гетерогенности опухоли, оценка проводимого лечения [7].
Заключение
Данные проведенного анализа литературы свидетельствуют о том, что на современном этапе развития информационных технологий ИИ не показывает существенных преимуществ в стратификации новообразований МЖ перед врачом УЗД с большим стажем работы и не способен заменить собой доминирующую роль доктора, а учитывая несовершенное правовое регулирование, в настоящее время может использоваться только в качестве системы поддержки принятия решения в определенных диагностических ситуациях. Вместе с тем, постоянный рост объема и совершенствование качества цифровых данных, а также активные разработки продуктов в сфере информационных технологий, делают ИИ одним из перспективных направлений развития УЗД. Быстрые темпы совершенствования ПО ИИ разработчиками наблюдаются не только в направлении улучшения сегментации и стратификации новообразований МЖ, но и расширения функционала в части анализа и прогноза проводимого лечения. Использование возможностей ИИ в дальнейшем позволит существенно снизить нагрузку на врачей-специалистов, взяв на себя ряд рутинных функций как первичного скрининга, так и различных этапов терапии.
Понимая сложности и отсутствие прозрачности в построении алгоритмов ИИ, врачи ультразвуковой диагностики должны учитывать существующие на сегодня технические ограничения и разумно использовать его возможности.
Вклад автора. Автор подтверждает единоличную ответственность за следующее: концепцию и дизайн исследования, сбор данных, анализ и интерпретацию результатов, подготовку рукописи.
Источники финансирования. Работа выполнена по инициативе автора без привлечения финансирования.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


