Исследование белков национального мягкого сыра электрофоретическим методом
Автор: Алимарданова М.К., Кулажанов Т.К., Жексенбай Н., Скалка В., Плоцкова М.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Техника и технологии
Статья в выпуске: 4 (105), 2014 года.
Бесплатный доступ
В статье рассмотрены результаты исследования белков электрофоретическим методом ПААГ. Образцы национального мягкого сыра из смеси коровьего и козьего молока были исследованы на полиакриламидном геле шестикратной повторности, с содержанием 10%, 12,5%, 15%, 17% и 20% полиакриламидного геля. Установлен наиболее подходящий полиакриламидный гель для лучшего разделения белков национального мягкого сыра, с помощью которого можно определить - из какого молока сделан сыр или другие молочные продукты.
Электрофоретический метод, национальный мягкий сыр, козье молоко
Короткий адрес: https://sciup.org/140204756
IDR: 140204756 | УДК: 637.3.07
Текст научной статьи Исследование белков национального мягкого сыра электрофоретическим методом
Электрофорез в полиакриламидном геле с использованием додецилсульфата натрия (ДДС-Na, C] 2 H 25 OS0 3 Na) позволяет фракционировать белки в зависимости от значений только одного параметра — их молекулярной массы. Для этого белки в исходном растворе препарата обрабатывают не менее чем трехкратным избытком ДДС-Na. За счет гидрофобных взаимодействий детергент примерно одинаково связывается с подавляющим большинством белков в соотношении 1,4 мг ДДС-Na на 1 мг белка [2]. Одновременно с обработкой ДДС-Na необходимо обеспечить полную денатурацию белка и разрыв всех S—S-связей. С этой целью белковый препарат обрабатывают высокой концентрацией β-меркаптоэтанола при повышенной температуре [3].
Пробоподготовка включает экстракцию и солюбилизацию белкового образца, который свободен от примесей и имеет общую концентрацию белка, пригодного для электрофореза. Качество подготовки проб может сильно повлиять на качество данных результата. Солюбилизация белка - процесс, разрушающий взаимодействия в агрегации белков, такие как: дисульфидные связи, водородные связи, ван-дер-Ваальса, ионные и гидрофобные связи [4].
Для однозначного определения молекулярной массы белка по скорости его миграции при электрофорезе бывает целесообразно распрямить полипептидную цепочку белка и придать ей жесткость. Именно такой прием используется при электрофорезе белков, обработанных додецилсульфатом натрия. Для этого белки в исходном растворе препарата обрабатывают не менее чем трехкратным избытком ДДС-Na. За счет гидрофобных взаимодействий детергент примерно одинаково связывается с подавляющим большинством белков в соотношении 1,4 мг ДДС-Na на 1 мг белка [2].
Основные фракции молочного белка приведены в таблице 1.
Таблица 1 - Основные фракции белков молока [6, 7, 8, 9]
|
Белки |
Изоэлектрическая точка |
Молекулярная масса |
|
α-Казейн |
4.1 |
23,000 |
|
κ-Казейн |
4.1 |
19,000 |
|
β-Казейн |
4.5 |
24,000 |
|
γ-Казейн |
5.8-6.0 |
- |
|
α-Лакталбумин |
5.1 |
14,437 |
|
β-Лактоглобулин |
5.3 |
18,000 |
|
Лактоферрин |
- |
87,000 |
Объекты и методы исследования
Объектами исследования служили 3 вида сыра из смеси козьего и коровьего молока и 3 контрольных вида сыра, все с разным временем созревания:
S 1 – Сыр из смеси козьего и коровьего молока (21 сутки созревания),
S 2 – Сыр из смеси козьего и коровьего молока (14 суток созревания),
S 3 – Сыр из смеси козьего и коровьего молока (7 суток созревания),
S 4 – Сыр из коровьего молока – контроль (21 сутки созревания),
S 5 – Сыр из коровьего молока – контроль (14 суток созревания),
S 6 – Сыр из коровьего молока – контроль (7 суток созревания).
В 20 мг каждого образца добавили 200 µл ДДС-Na (10%), 100 µл ЕДТА (0,5 Н), натрия гидрооксида (0,85 Н), 700 µл дистиллированной воды и встряхивали в течение 1 часа при 70 0С. Затем центрифугировали при 4 0С со скоростью 14000 об/мин в течение 14 минут, после удалили супернатант. Для осаждения белка добавили 300 µл осаждающего раствора (трихлоруксусная кислота 50 г., дитиотреитол 200 мг., ацетон 50 мл.) и центрифугировали со скоростью 14000 об/мин в течение 14 минут при 7 0С. Промыли фильтрат 2 раза, 1 мл промывочным раствором (дитиотреитол 200 мг, ацетон 100 мл) и центрифугировали на обороте 14000 в течение 14 минут при 7 0С, постоянно выливая промывочный раствор. Окрашивание и приготовление геля проводили по протоколу Laemmli [10]. Электрофоретический анализ в присутствии 0,1% ДДС проводили в 10%, 12,5%, 15%, 17% и 20% полиакриламидном геле в шестикратной повторности. Использовались 2 маркера разных производителей:
-
- Thermo scientific (MTS) с белками молекулярной массой 200, 150, 120, 100, 85, 70, 60, 50, 40, 30, 25, 20, 15, 10 кДа.
-
- Bio-Rad (MBR) с белками молекулярной массой 250, 150, 100, 75, 50, 37, 25, 20, 15, 10, 5, 2 кДа.
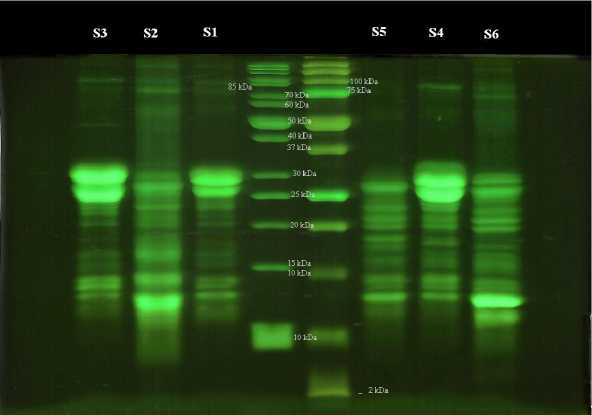
Photoshop CS (AdobeSystems) использовали для регулировки яркости, настройки контрастности изображений геля (рис.1). TotalLab 100 был использован для анализа цифрового изображения 12,5% полиакриламидного геля.
Казеины
β – Лактоглобулин
α-Лакталбумин
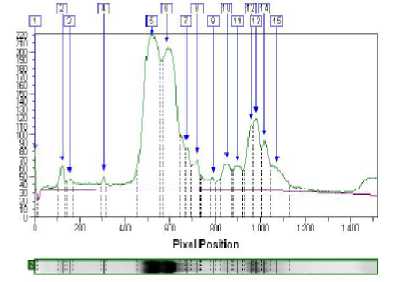
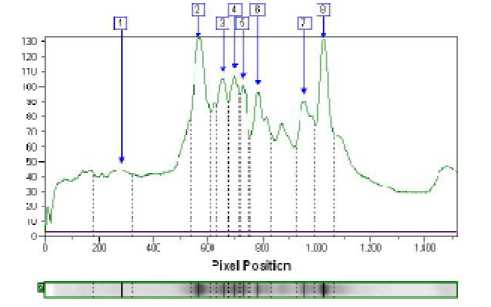
Рисунок 2 - Анализ электрофореграммы сыров из коровьего молока с созреванием 7 суток
Рисунок 1 - Цифровое изображение окрашенного геля (12,5%) с нанесенными образцами белка и маркеры МTS и MBR.
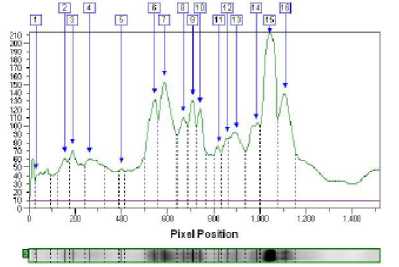
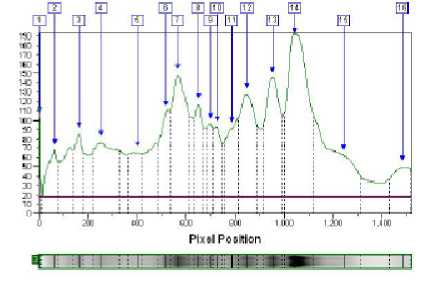
Рисунок 3 - Анализ электрофореграммы сыров из смеси козьего и коровьего молока и контроль из коровьего молока контроль с созреванием 14 суток
смеси козьего и коровьего молока и контроль из
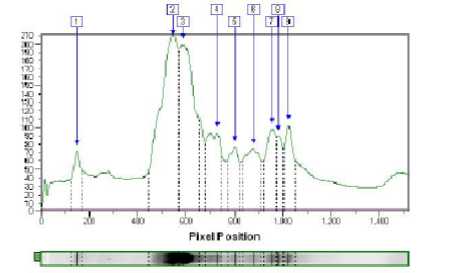
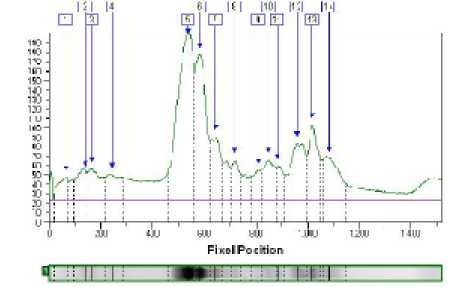
Рисунок 4 - Анализ электрофореграммы сыров из коровьего молока контроль с созреванием 21 суток
смеси козьего и коровьего молока и контроль из
Результаты и их обсуждение
Белки были определены согласно их молекулярной массе в сравнении с маркером. Обработка результата с помощью программного обеспечения Totallab Quant дает возможность определить точное положение белка на геле относительно маркеров. Анализ электрофореграммы сыров на 7 сутке созревания (рис. 2) показывает наибольшее количество основных фракций казеина в них (зона белков с молекулярным весом 22 – 24 кДа) и незначительное количество сывороточных белков (белки с молекулярным весом 18 – 14,5 кДа). Электрофореграммы сыров (анализируемый и контроль) на 14 и 21 сутке созревания (рис. 3 и 4) также не отличались. Количество искомых фракций казеина зависит от интенсивности окраски соответствующей полоски на геле и выражается в оптической плотности. С помощью образцов с известной концентрацией фракций белка можно составить градуировочную кривую и определить фракцию белка в сырах количественно.
Выводы
-
1. Наилучшее разделение фракции белков национального мягкого сыра было на 12,5% полиакриламидном геле.
-
2. При созревании в течении 21 суток при температуре 4 0С, в национальных мягких сырах, изготовленных из коровьего и его смеси с козьим молоком, значительного изменения в составе фракции белка не происходит.
Список литературы Исследование белков национального мягкого сыра электрофоретическим методом
- Hui-Chung W., Chien-Chang Y., Wen-Huei Ts., Han-Min Ch. A red line not to cross: Evaluating the limitation and properness of gel image tuning procedures//Analytical Biochemistry. -2010, January. -Vol. 396, issue 1. -PP. 42-50.
- Rabilloud Т. Solubilization of proteins for electrophoretic analyses//Electrophoresis. -1996. -Vol. 17. -PP. 813-829.
- Reynolds А., Tanford С. Binding of Dodecyl Sulfate to Proteins at High Binding Ratios. Possible Implications for the State of Proteins in Biological Membranes//Proceedings of the National Academy of Sciences.-1993. -Vol. 66, № 3. -PP. 1002-1003.
- Остерман Л. А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование (практическое пособие). М.: Наука, 1981. -288 с.
- Sodini I., Morin P., Olabi A., Jiménez-Flores R. Compositional and Functional Properties of Buttermilk: A Comparison Between Sweet, Sour, and Whey Buttermilk//Journal of Dairy Science. -Vol. 89, issue 2. -2006, February. -PP. 525-536.
- Boros V. Influence of the lactation period on variations in the levels of certain components of bulked goat’s milk//International dairy federation bulletin. -1986. -№ 202. -PP. 81-100.
- Nguyen H.A., Skelte G., Anema, P.H., Fanny G., Wong M. Effect of adding low levels of β-mercaptoethanol on the disulphide bonds of κ-casein and β-lactoglobulin solutions//International Dairy Journal. -2012, September. -Vol. 26, issue 1. -PP. 78-82.
- Assenat L. “Le lait de brebis. Composition et properties” in “Laits et Produits Laitiers. Vache. Brebis. Chevre. ” I. Ed. F.M. Luquet. Technique et Documen-tation -Lavosier APRIA. Paris. 1985. -PP. 46-53.
- Mens P. Le. “Proprietes physic-chimiquesnutritionnelles et chimiques” In Laitset Produits Laitiers. Vache. Brebis. Chevre. I. Ed. F.M. Luquet. Apria. Paris. 1985. -PP. 25-31.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4//Nature-1970. -Vol. 227. -PP. 680 -685.


