Исследование синтеза фосфорорганических соединений в присутствии катализатора
Автор: Зайнуллина А.Ш., Бугубаева Г.О., Канетова А.Н.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Естественные науки
Статья в выпуске: 3 (116), 2017 года.
Бесплатный доступ
В статье рассмотрены новые каталитические реакции окислительного алкоксилирования гипофосфита натрия в присутствии хлорида железа (III). Изучены кинетические закономер-ности реакции окисления гипофосфита натрия кислородом в спиртовых растворах Fe(III). Найдено, что при 60-80°С гипофосфит окисляется до диалкилфосфита (RO)2HPO, ди- и триалкилфосфатов (RO)2(OH)PO, (RO)3PO. Методом редокс потенциометрии газожидкостной хроматографии установлено, что фосфорные эфиры формируются в результате реакции окисления гипофосфита комплексами Fe(III). Полученные данные важны для малоизученной области органической химии гипофосфита и могут быть полезными при разработке экологи-ческий безопасных методов получения ценных эфиров фосфора, применяемых в качестве приса-док к маслам, биологически активных препаратов для медицины и сельского хозяйства.
Фосфорорганические соединения, синтез, гипофосфит, методы, катализатор
Короткий адрес: https://sciup.org/140225520
IDR: 140225520 | УДК: 661.639.2
Текст научной статьи Исследование синтеза фосфорорганических соединений в присутствии катализатора
В настоящее время одним из актуальных вопросов, стоящих перед учеными, является вопрос о рациональном использовании минеральных и энергетических ресурсов. Разработка ресурсосберегающих химических процессов и технологий является наиболее важным стратегическим направлением развития науки и техники в 21 веке. В этой связи поиск технологий, позволяющих повышать эффективность и безопасность функционирования производств является на современном этапе задачей важной и актуальной. Для успешного и устойчивого развития промышленной химии и нефтегазовой отрасли необходимо направлять значительные усилия на поиск новых, экологически ориентированных процессов. Эти требования относятся и к химии фосфорорганических соединений (ФОС), ведущее место в которой занимают эфиры фосфористой, фосфорной и тиофосфорной кислот, применяемые в качестве экстрагентов редкоземельных и трансурановых элементов, флотореагентов, эмульгаторов, материалов для микроэлектроники, присадок к маслам, стабилизаторов полимеров, компонентов антипиреновых композиций, полупродуктов синтеза пестицидов, биологически активных препаратов для медицины и сельского хозяйства.
Казахстан обладает большими запасами фосфорных руд, используемых в качестве сырья для производства фосфора, минеральных удобрений и фосфорорганических соединений (ФОС).
Гипофосфит натрия является относи -тельно безвредным, дешевым и доступным сырьем. Разработанные каталитические реакции могут служить основой создания экологически безопасной технологии синтеза ценных эфиров фосфора[1-4].
Традиционные технологии ФОС основаны на использовании хлоридов и оксихлори -дов фосфора, которые получают хлорированием белого фосфора. Последующие реакции замещения атомов хлора на различные функциональные группы сопровождаются выделением токсичных, трудноутилизируемых хлорсодержащих отходов [1]. Многостадийный технологический процесс сопровождается выделением большого количества хлороводорода, вызывающего серьезные экологические проблемы и дополнительные расходы на его нейтрализацию (рис. 1).
Повышенные экологические и экономические требования к этим процессам, а также возрастающая потребность в фосфорорганических производных, стимулируют поиски альтернативных источников фосфора. Решение задачи прямой конверсии NaH 2 ₽O 2 в фосфорорганические производные имеет важное значение для нашей страны, так как фосфорорганические экстрагенты необходимы для комплексной переработки богатейших запасов руд редких, благородных и радиоактивных металлов.
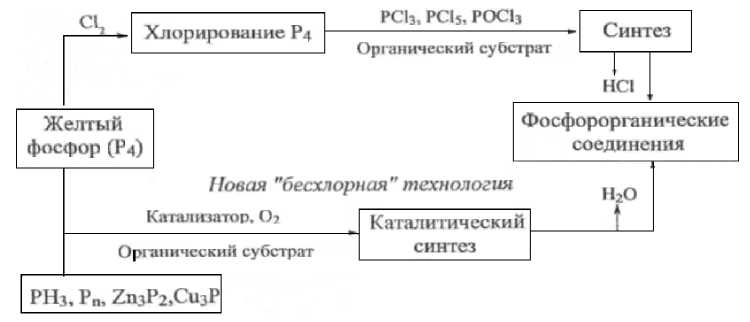
Рисунок 1 - Синтез ФОС по традиционной и каталитической технологии
Объекты и методы исследований
В настоящей работе объектом исследования являлся гипофосфид натрия. Гипофосфит натрия является доступным сырьем, относительно безвредным и дешевым. В Казахстане налажено производство гипофосфита из фосфорного шлама.
Обнаружено, что при введении гипофосфита натрия в спиртовый раствор FeСl 3 при температуре 50-80 ° С происходит окисление NaH 2 PO 2 кислородом с преимущественным образованием диалкилфосфитов [3].
NaH2PO2 + 02 + ROH ^ (RO)2HPO - (RO)3PO - (RO)2(HO)PO (1) Кат. =FeCl3
Исследование реакции окислительного алкоксилирования гипофосфита натрия в присутствии ацидокомплекса железа (III) проводили по следующей схеме лабораторной установки, представленной на рисунке 1.
-
• кинетическим и потенциометрическим методами изучали влияние концентрации реагентов, природы катализатора, лигандов и температуры на скорость реакции и выход продуктов;
-
• физико-химическими методами исследовали промежуточные комплексы и продукты реакции;
-
• на основе экспериментальных и литературных данных предположили вероятную схему механизма реакции, вывели кинетическое уравнение, определили активационные и кинетические параметры процесса [3].
Кинетику реакции изучали волюмомет-рическим методом по поглощению кислорода на термостатированной установке (рис. 2) с интенсивно встряхиваемым реактором типа «каталитическая утка», снабженным потенциометрическим устройством и соединенным с газометрической бюреткой.
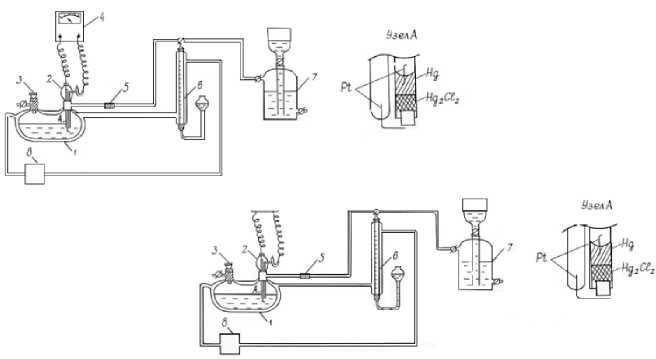
Рисунок 2 – Схема лабораторной установки: 1 – реактор-каталитическая «утка»; 2 – потенциометрическое устройство; 3 – устройство для отбора проб реакционного раствора; 4 – милливольтметр рН-121; 5 – поглотитель влаги (CaCl 2 ); 6 – газометрическая бюретка; 7 – газометр для О 2 или смеси Ar-O 2 ; 8 – термостат U-10.
Результаты и их обсуждени е
Исследование влияния концентрации гипофосфита в атмосфере O 2 показало, что внесение навески NaH 2 PO 2 в темно-желтый спиртовый раствор Fe(III) приводит к смещению редокс–потенциала системы в катодную сторону на 0,05-0,2 Вв течение 10 минут (рис.3).
Одновременно при этом происходит осветление раствора и выпадает белый осадок. В ходе опыта скорость реакции быстро увеличивается, достигает максимума, а затем постепенно падает до нуля.
Из конверсионных, кинетических и потенциометрических кривых видно, что варьирование концентрации гипофосфита в интервале 0,06 - 0,36 моль/л приводит к возрастанию скорости реакции и количества поглощенного кислорода, согласно стехиометрии реакции. Величина катодного смещения ф Fe увеличивается с ростом количества введенного NaH 2 PO 2 . По мере поглощения кислорода реакционная смесь приобретает первоначальный темно-желтый цвет, потенциал смещается в анодную область.
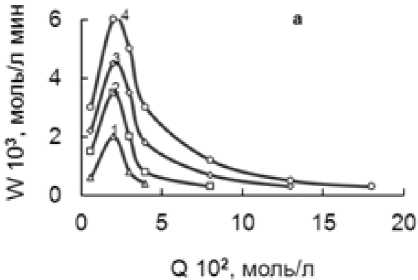
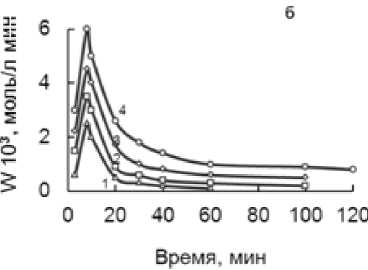
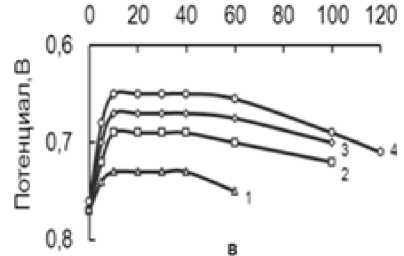
Рисунок 3 – Конверсионные (а), кинетические (б), потенциометрические (в) кривые при [BuOH] 10,9, [FeCl 3 ] 0,6 моль/л. Обозначения кривых ([NaH 2 PO 2 ], моль/л): - 0,06 (1); 0,12 (2); 0,24 (3); 0,36 (4)
В таблице 1 приведены данные по окислению NaH 2 PO 2 кислородом в спиртовых растворах.
Из таблицы 1 видно, что в изученных условиях основным продуктом является диал- килфосфит, количество которого при повышении [NaH2PO2] растет от 45 до 77%. В оптимальных условиях выход диалкилфосфита составляет 80%, ди- и триалкилфосфатов в сумме - 10-20%.
Таблица 1 - Окисление NaH 2 PO 2 кислородом в спиртовых растворах FeCI 3
|
Состав раствора, моль/л |
Т, ° С |
P O2 , атм |
Выход, % |
||||
|
FECI 3 |
NaH 2 PO 2 |
BuOH |
(RO) 2 HPO |
(RO) 3 PO |
(RO) 2 (HO) |
||
|
0,6 |
0,36 |
10,9 |
60 |
1 |
32 |
11 |
37 |
|
0,6 |
0,36 |
10,9 |
70 |
1 |
70 |
11 |
19 |
|
0,6 |
0,36 |
10,9 |
80 |
1 |
77 |
11 |
12 |
|
0,6 |
0,06 |
10,9 |
80 |
1 |
45 |
25 |
30 |
|
0,6 |
0,24 |
10,9 |
80 |
1 |
55 |
24 |
21 |
|
0,6 |
0,36 |
10,9 |
80 |
1 |
77 |
11 |
12 |
|
0,2 |
0,36 |
10,9 |
80 |
1 |
13 |
4 |
23 |
|
0,3 |
0,36 |
10,9 |
80 |
1 |
19 |
21 |
30 |
|
0,6 |
0,36 |
10,9 |
80 |
1 |
77 |
11 |
12 |
В результате реакции были получены следующие продукты: диалкилфосфит, дитриалкилфосфат. Хроматографический анализ диалкилфосфитов и триалкилфосфатов осуществлялся на хроматографе Chrompack 9002 с применением пламенно-ионизационного детектора в режиме программированного нагрева колонок от 100 до 200 ° С, при скорости газа-носителя ~ 30мл/мин и температуре испарителя 360 ° С на капиллярной колонке CIPSIL 19СВ (25000 x 0,25мм). Концентрацию продуктов оценивали по калибровочным графикам, полученным методом абсолютной калибровки. Таким образом, исследования, проведенные в этом разделе, показали, что в отличие от солей меди (II) [4] в спиртовых растворах FeCl 3 при 60-800С гипофосфит натрия окисляется кислородом с преимущественным образованием диалкилфосфитов. Выход диалкилфос-фитов зависит от природы спирта, соли железа и температуры.
Заключение
Фосфорная промышленность Казахстана имеет законченный технологический цикл от добычи фосфоритной руды до электротермического производства фосфора. Фосфор является одним из важнейших промышленных продуктов с обширной областью применения (синтетические моющие средства, минеральные удобрения, экстрагенты, основа лекарственных препаратов и др.).Одними из наиболее перспективных фосфорилирующих агентов с точки зрения доступности, и экологической безопасности являются гидрофосфорильные соединения (ГФС), в частности фосфорнова-тистая кислота и ее соли.
Гипофосфиты широко используются в аналитической химии, в качестве восстановителей при покрытии металлов защитным слоем и в других прикладных направлениях. Проведенные нами исследования и разработки новых каталитические реакции могут служить основой создания экологически безопасной технологии синтеза ценных эфиров фосфора. Мировое производство триалкилфосфатов по традиционной «хлорной» технологии составляет десятки тысяч тонн в год. Ди- и триалкилфосфаты применяются в качестве комплексообра-зователей, экстрагентов, присадок к горючесмазочным материалам, мономеров для синтеза термо- и огнестойких полимеров, пластификаторов, ингибиторов коррозии. Диалкилфос-фиты обладают высокой реакционной способностью и используются для лабораторного и промышленного синтеза более сложных биологически активных соединений и лекарственных препаратов.
Список литературы Исследование синтеза фосфорорганических соединений в присутствии катализатора
- Алешкова М.М., Полимбетова Г.С., Ибраимова Ж.У., Борангазиева А.К. Кинетика и механизм реакции окислительного алкоксилирования гипофосфита натрия кислородом в растворах меди (II)//Изв. НАНРК. Сер.хим. -2005. -№ 6. -С. 8-17.
- Abdreimova R.R., Akbaeva D.N., Faizova F. Kh., Polimbetova G.S., Aibasova S. M., Borangazieva A.K., Aliev M.B. Catalitic Synthesis of the esters of phosphorus asids from white phosphorus and aliphatic or aromatic alcohols//J.Eurasian Chem. Tech. -2008. -Р.P.11-17
- Чернышева Н. А., Михайленко В. Л., Гусарова Н. К., Федоров С. В., Трофимов Б. А. Синтез трис (органилтиоэтил) фосфитов и их производных на основе реакции фосфита с винилсульфидами//ЖОХ. 2011. -Т. 81, вып. 3. -С. 373
- Отжан У.Н., Зайнуллина.А.Ш., Бугубаева Г.О. Синтез фосфорорганических соединений в присутствии катализаторов CuCl2//Вестник АТУ, Алматы, 2016 -№ 3. -С. 119.


